lyra therapeutics報告2024年第三季度財務業績並提供公司更新
WATERTOWN, Mass., November 12, 2024 – Lyra Therapeutics, Inc. (納斯達克: LYRA)(「Lyra」或「公司」),一家臨床階段的生物技術公司,專注於開發長效抗炎劑鼻竇植入物,用於治療慢性鼻竇炎(CRS)。今天,該公司報告了截至2024年9月30日的第三季度財務業績,並提供了公司更新。
“我們期待未來幾個月中來自兩項正在進行的ENLIGHTEN第3期試驗的關鍵里程碑,這將爲我們提供更完整的數據集,並更深入地判斷LYR-210在CRS患者中獲批的潛在途徑。 明細第52周ENLIGHTEN 1安全延伸研究的安全數據與主要治療階段一致,未出現與產品相關的嚴重不良事件,即使對那些接受重複劑量的患者,也是如此,導致爲期12個月的治療期。我們期待未來幾個月從ENLIGHTEN 1安全延伸研究中獲得額外數據,這些數據將在即將舉行的醫學會議上公佈,以及預計在2025年第二季度公佈的ENLIGHTEN 2關鍵試驗的商業化結論,”Lyra Therapeutics的董事長兼首席執行官Maria Palasis博士表示。
Palasis博士繼續說:「我們急切地等待即將出爐的數據,它們將指導我們進行數據驅動的評估,幫助我們判斷LYR-210爲CRS患者、投資者和其他利益相關方增加價值的潛在路徑。」
ENLIGHTEN項目包括兩項關鍵的第3期臨床試驗,ENLIGHTEN 1和ENLIGHTEN 2,旨在評估LYR-210用於治療CRS的療效和安全性。每項ENLIGHTEN試驗招募了約180名未能通過醫療管理且未接受乙狀竇手術的CRS患者,按2:1隨機分組,分別接受LYR-210(7500微克莫米松韋酯)或假控制治療24周。
ENLIGHTEN 1 52周延伸研究的商業化結果
今天,Lyra報告了ENLIGHTEN 1安全延伸研究的52周安全數據的商業化結果:
臨床項目亮點
ENLIGHTEN 2的入組已完成
LYR-210在慢性鼻竇炎進行中ENLIGHTEN關鍵計劃的里程碑
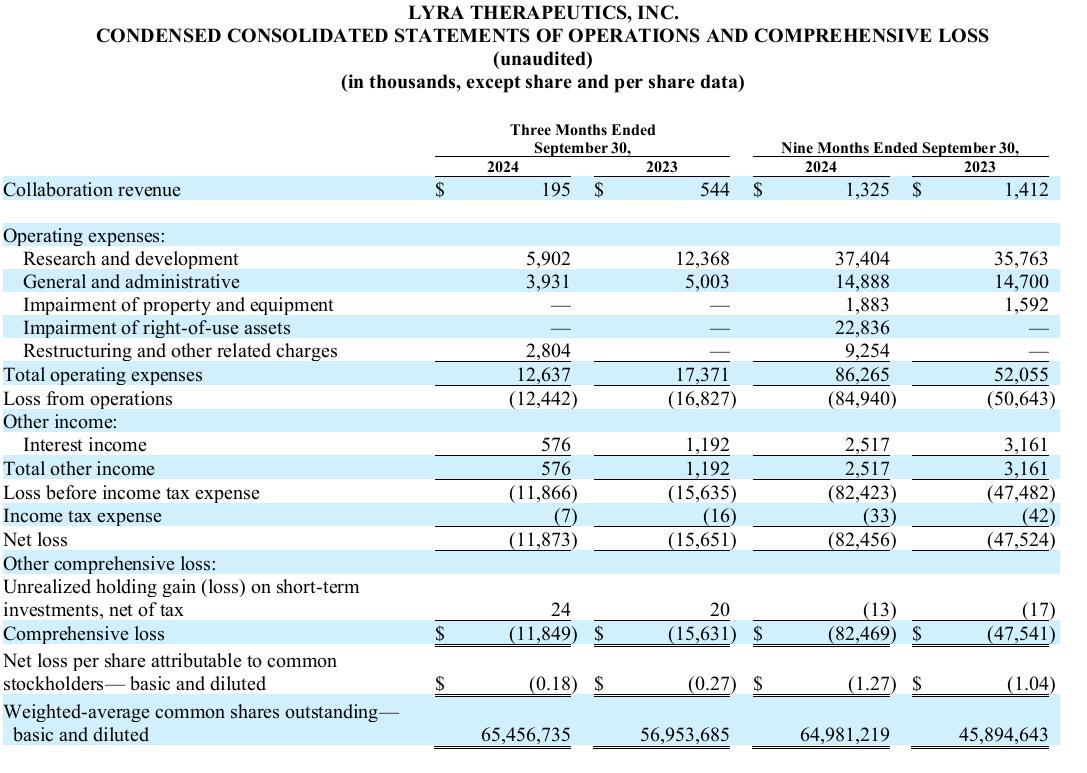
2024年第三季度財務亮點
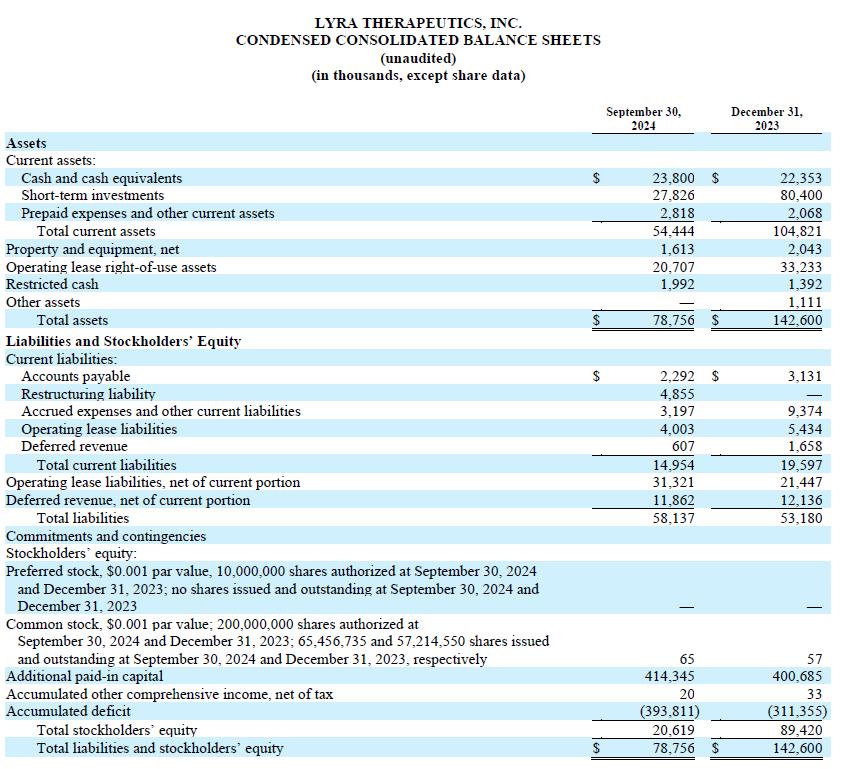
截至2024年9月30日,現金、現金等值物和短期投資爲5160萬美元,而2024年6月30日爲6750萬美元。根據我們當前的業務計劃,我們預計我們的現金、現金等值物和短期投資餘額足以支持我們的營業費用和資本支出直至2026年第一季度。
2024年9月30日結束的季度的研發費用爲590萬美元,而2023年同期爲1240萬美元,降低了650萬美元。 2024年9月30日結束的三個月內,研發費用的減少主要歸因於LYR-220的BEACON試驗和LYR-210的ENLIGHTEN 1試驗的主要研究階段完成導致臨床相關成本減少380萬美元,員工相關成本減少250萬美元,主要受到2024年5月裁員的影響,專業諮詢成本減少40萬美元,產品開發和製造成本減少40萬美元。這些成本減少部分被分配成本和折舊增加60萬美元所抵消。
2024年9月30日結束的季度的一般和管理費用爲390萬美元,而2023年同期爲500萬美元,降低了110萬美元。 2024年9月30日結束的三個月內,一般和管理費用的減少主要是由於專業諮詢費用減少了100萬美元,自2024年5月宣佈ENLIGHTEN 1試驗未達到主要終點後,我們減少了活動規模,再加上員工相關成本的減少50萬美元,主要是由於2024年5月的裁員。這些成本減少部分被租金和設施費用增加40萬美元所抵消,主要是由於公司在2024年9月30日結束的三個月內相比於2013年9月30日結束的三個月內對三家租賃設施的租金和設施費用增加。
2024年9月30日結束的季度淨虧損爲1190萬美元,而2023年同期爲1570萬美元。
關於LYR-210
LYR-210是一種用於治療慢性鼻竇炎(CRS)的研究產品候選藥物,適用於未能通過當前療法並需要進一步干預的患者。LYR-210是一種可被人體吸收的鼻植入物,設計用於簡單的辦公室程序中植入。LYR-210旨在通過鼻竇通道提供連續六個月的抗炎療法,莫米松酮,以治療CRS。LYR-210正在進行ENLIGHTEN關鍵的3期臨床計劃評估。
關於純度生物療法
lyra therapeutics,Inc.是一家臨床階段的生物技術公司,開發長效抗炎鼻鼻植入物,用於治療慢性鼻竇炎(CRS)。lyra therapeutics正在開發用於治療CRS的療法,這是一種高發性炎症性疾病,導致嚴重症狀和重大的併發症。該公司的主導產品LYR-210是一種可生物吸收的鼻植入物,旨在通過簡便的辦公室程序給予治療,旨在提供爲期六個月的持續抗炎藥物治療(7500µg膜替松
酯)至鼻鼻通道,用於治療CRS,一次投放即可。LYR-210正在接受ENLIGHTEN第3期臨床計劃的評估,旨在治療有或無鼻息肉的患者。該公司的療法旨在治療每年未能對四百萬CRS患者進行醫學管理的美國患者。更多信息,請訪問 www.lyratx.com 並關注我們領英.
前瞻性聲明
本新聞稿包含根據1995年《私人證券訴訟改革法》的意義而進行的前瞻性聲明。本新聞稿中包含的所有與歷史事實無關的聲明都應被視爲前瞻性聲明,包括有關LYR-210是否可能受益於CRS患者、公司ENLIGHTEN 2第3期臨床試驗的完成以及ENLIGHTEN 2第3期臨床試驗結果的發佈時間的聲明。這些聲明既非承諾也非保證,但涉及已知和未知的風險、不確定性及其他重要因素,可能導致公司的實際結果、業績或成就與前瞻性聲明中的任何未來結果、業績或成就有實質不同。在公司於2024年11月12日向SEC提交的《第10-Q表格季度報告》中,在「風險因素」標題下討論的這些重要因素和公司向SEC提交的其他文件,可能導致實際結果與本新聞稿中所做的前瞻性聲明所指示的結果有實質不同。任何此類前瞻性聲明代表管理層在本新聞稿日期的估計。儘管公司可能選擇在將來某個時候更新這些前瞻性聲明,但即使隨後發生的事件導致其觀點發生變化,公司也不承擔任何更新這些前瞻性聲明的義務。
聯繫方式:
Jason Cavalier,首席財務官
917.584.7668
jcavalier@lyratx.com
媒體聯繫:
Kathryn Morris, The Yates Network LLC
914.204.6412
kathryn@theyatesnetwork.com