Exhibit 99.2

theravance biopharma®、theravance®、十字星/星標識和醫療產品使不同的®是Theravance Biopharma集團公司(在美國和其他某些國家)的註冊商標。此處使用的所有第三方商標歸其各自所有者所有。©2024 Theravance Biopharma。保留所有權利。 Theravance Biopharma 2024年第三季度財務業績及業務更新2024年11月12日

2 未來展望性聲明 本演示文稿包含根據1995年私人證券訴訟改革法案定義的"未來展望性"聲明,涉及目標、計劃、目標、期望和未來事件等聲明。Theravance Biopharma, Inc.(以下簡稱"公司")打算使這些未來展望性聲明受到1934年修正的證券交易法第21E節和1995年私人證券訴訟改革法案的關於未來展望性聲明的安全港條款覆蓋。此類聲明的示例包括以下聲明:關於公司對未來盈利能力、支出和現金使用的期望,公司的目標、設計、策略、計劃和目標,YUPELRI銷量的未來增長,未來的版稅支付,爲股東提供價值的能力,公司的監管策略和臨床研究的時間,我們調查中療法的潛在安全性、有效性或差異性的可能,由公司及其合作伙伴對聯邦地方法院的某些仿製藥公司提起的專利侵權訴訟的狀態;由於將公司的TRELEGY ELLIPTA版稅利益出售給Royalty Pharma而應支付的條件款項,以及關於將OHSA分數用作臨床試驗終點的期望。這些聲明基於Theravance Biopharma管理層截至本新聞稿和電話會議日期的當前估計和假設,並受到風險、不確定性、情況變化、假設以及可能導致Theravance Biopharma實際結果與未來展望性聲明所反映結果明顯不同的其他因素的影響。可能導致實際結果與這些未來展望性聲明所示不同的重要因素包括:可能會增加公司的現金需求或支出超出其預期以及可能會不利影響其盈利能力的因素,里程碑閾值是否可達到,開始、招募或完成臨床研究的延遲或困難,臨床或非臨床研究結果表明公司的產品候選藥物或產品不安全、無效或無差異化的可能性,來自對公司不利的監管機構決定的風險,依賴第三方進行臨床研究,延遲或未能取得和保留產品候選藥物的監管批准,與或依賴第三方發現、研發、生產和商業化產品存在的風險,以及建立和保持具有適當技術專業知識和支持基礎設施的銷售、營銷和分銷能力的能力,公司保護和強制執行其知識產權權利的能力,公司股票的交易價格和成交量的波動,以及總體經濟和市場情況。影響公司的其他風險列在公司於2024年8月8日向SEC提交的10-Q表格及其他向SEC提交的週期性報告中。除上述風險外,研究生物製品在與SEC提交的文件中描述的風險外,其他未知或不可預測的因素也可能影響Theravance Biopharma的結果。不能保證任何未來展望性聲明,實際結果可能與這些聲明大不相同。鑑於這些不確定性,您不應過分依賴這些未來展望性聲明。Theravance Biopharma不承擔根據新信息、未來事件或其他方面更新其未來展望性聲明的義務,法律要求除外。 非GAAP財務措施 適用於此新聞稿的Theravance Biopharma提供了非GAAP盈利能力目標和非GAAP指標。 Theravance Biopharma認爲,非GAAP盈利能力目標和持續運營中的非GAAP淨利潤(損失)爲投資者評估未來業績前景和實際表現提供有意義的信息,因爲它們通過排除可能不表示核心營運結果和公司現金狀況的項目,爲分析其業務績效提供更好的指標。因爲非GAAP財務指標和指標,如非GAAP盈利能力和持續運營中的非GAAP淨利潤損失,不是標準化的,可能無法將這些措施與其他公司相同或類似名稱的非GAAP目標或措施進行比較。因此,Theravance Biopharma的非GAAP措施應被視爲對公司實際GAAP結果和其他目標的補充,而不是替代或孤立的。請參見本演示文稿附錄,以示非GAAP持續運營中的淨利潤(損失)與其相應措施淨利潤(損失)的對應調解。由於未來關於非GAAP持續運營中的淨利潤(損失)與其相應GAAP措施的調解的不確定性以及未來支出和其他因素的潛在變動,不可能不費不適當的努力基礎上提供這樣的調解表。

3. 議程 歡迎致辭/開場白 萊克·溫寧漢姆:首席執行官 YUPELRI®/商業情況更新 隆達·法爾納姆:高級副總裁,首席業務官 Ampreloxetine更新 艾恩·米勒博士:高級副總裁,開發財務更新 總結致辭/Q&A 阿齊茲·薩瓦夫:高級副總裁,首席財務官 萊克·溫寧漢姆/團隊TRELEGY ELLIPTA更新 阿齊茲·薩瓦夫:高級副總裁,首席財務官

4. 戰略目標:2024年第三季度進展 1. 在美國,Viatris正在領導YUPELRI的商業化,Theravance Biopharma在損益分擔協議下共同推廣該產品(Viatris佔65%;Theravance Biopharma佔35%)。2. 資料來源:Viatris客戶需求(2024年第三季度)。3. 資料來源:IQVIA DDD, HDS, VA和非報告醫院直至2024年9月。4. 資料來源:按美元報告的GSK淨銷售額。5. 截至2024年09/30,Theravance有望從Royalty Pharma(RP)直接獲得高達2億美元的Trelegy銷售里程碑獎金。如果RP從GSK獲得超過2.4億美元的版稅付款,則將觸發第一個2.5億美元的付款,基於2024年TRELEGY全球淨銷售額,如果RP從GSK獲得超過2.75億美元的版稅付款,將觸發額外的2.5億美元的付款(總額爲5億美元),我們預計RP應該獲得這些付款,以應對2024年TRELEGY全球淨銷售額分別達到約29億美元和32億美元。• 第三季度報告淨銷售額同比增長7%,環比增長14%,達到6220萬美元,創歷史新高• 第三季度需求同比增長14%,也達到了新高• 強勁的醫院表現持續,劑量同比增長40%(2024年第三季度與2023年第三季度)• 塞班花園計劃(CYPRESS)招募進展符合預期• 預計將於2025年中招募CYPRESS開放標籤部分的最後一名患者,預計約6個月後獲得首席數據 AmpreloxetineTRELEGY• 第三季度TRELEGY淨銷售額達到7.89億美元,同比增長+17%,年度淨銷售額達到26億美元,同比增長30%• 2024年TRELEGY里程碑閾值:• 淨銷售達到約29億美元時的2.5億美元• 淨銷售達到約32億美元時的5億美元

5個項目解鎖股東價值 5 • 分離董事會主席和首席執行官的職責 • 推選Susannah Gray爲董事會主席 • Gray女士在生物製品領域擁有超過30年的經驗,專注於公司財務和資本市場領域,最近擔任皇家制藥管理有限責任公司的財務與策略執行副總裁 企業治理 • 由新任董事會主席Susannah Gray領導 • 包括獨立董事Jeremy Grant,Dean Mitchell,Donal O’Connor和Deepa Pakianathan • Lazard擔任財務顧問 戰略審查委員會 重申承諾向股東返還多餘資本

The Only Once - 慢性阻塞性肺疾病的每日一次霧化LAMA維持治療藥物 與VIATRIS合作協議(35% / 65%的利潤分成) Rhonda Farnum 高級副總裁,首席業務官 COPD,慢性阻塞性肺疾病;LAMA,長效毒蕈鹼拮抗劑
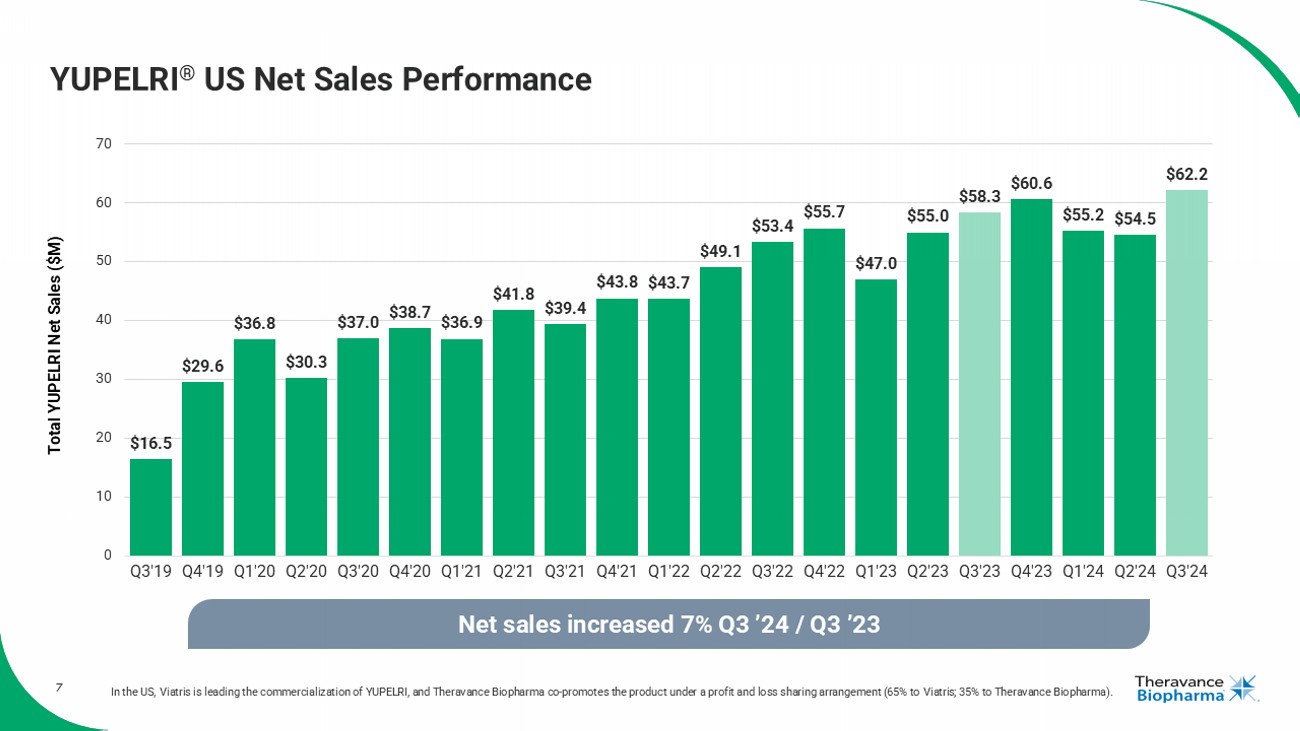
YUPELRI®美國淨銷售業績 美國Viatris正在領導YUPELRI的商業化,而Theravance Biopharma則在利潤與損失共享安排下共同推廣該產品(65%歸Viatris;35%歸Theravance Biopharma)。 $16.5 $29.6 $36.8 $30.3 $37.0 $38.7 $36.9 $41.8 $39.4 $43.8 $43.7 $49.1 $53.4 $55.7 $47.0 $55.0 $58.3 $60.6 $55.2 $54.5 $62.2 0 10 20 30 40 50 60 70 Q3'19 Q4'19 Q1'20 Q2'20 Q3'20 Q4'20 Q1'21 Q2'21 Q3'21 Q4'21 Q1'22 Q2'22 Q3'22 Q4'22 Q1'23 Q2'23 Q3'23 Q4'23 Q1'24 Q2'24 Q3'24 淨銷售額較Q3’23增長7% 總YUPELRI淨銷售額(百萬美元)
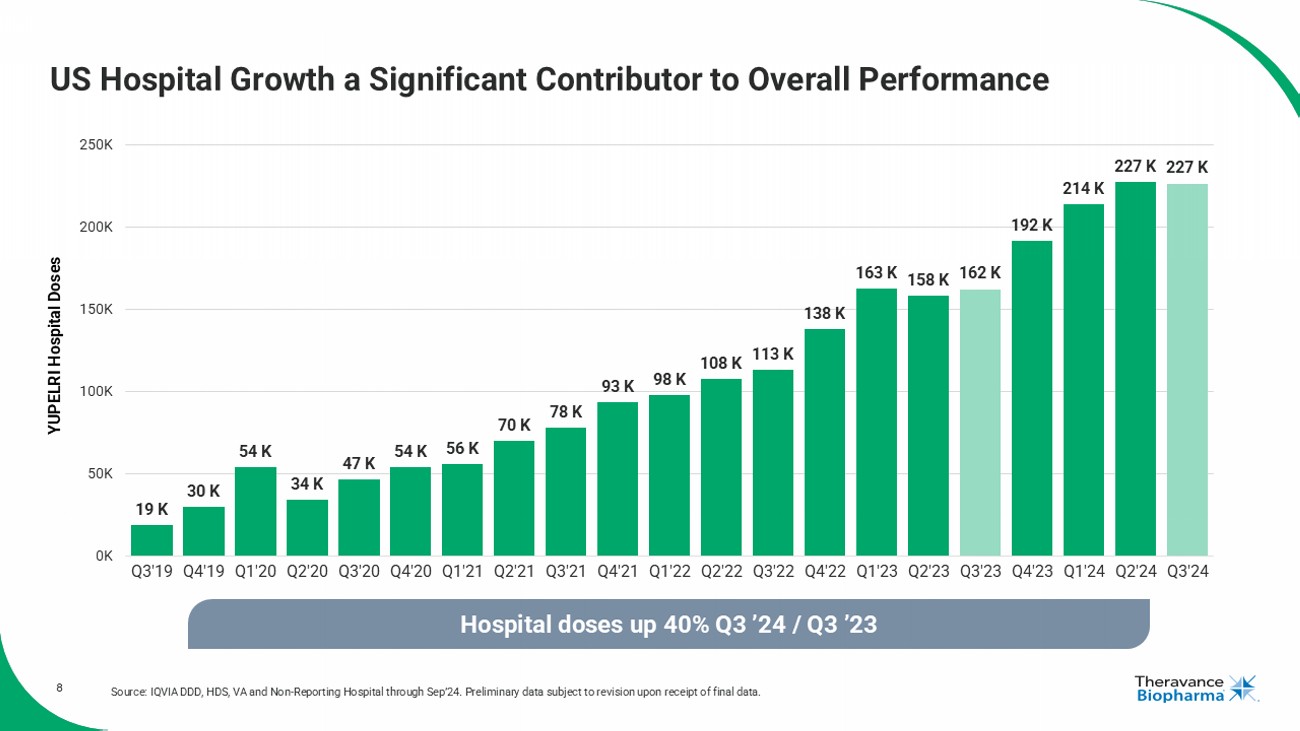
8 美國醫院成長是整體業績的重要貢獻者 數據來源:IQVIA DDD,HDS,VA和非報告醫院至24年9月。初步數據待最終數據確認後修訂。 1.9萬 3萬 5.4萬 3.4萬 4.7萬 5.4萬 5.6萬 7萬 7.8萬 9.3萬 9.8萬 10.8萬 11.3萬 13.8萬 16.3萬 15.8萬 16.2萬 19.2萬 21.4萬 22.7萬 22.7萬 0萬 5萬 10萬 15萬 20萬 25萬 Q3'19 Q4'19 Q1'20 Q2'20 Q3'20 Q4'20 Q1'21 Q2'21 Q3'21 Q4'21 Q1'22 Q2'22 Q3'22 Q4'22 Q1'23 Q2'23 Q3'23 Q4'23 Q1'24 Q2'24 Q3'24 YUPELRI 醫院劑量 醫院劑量較Q3’23增加40%
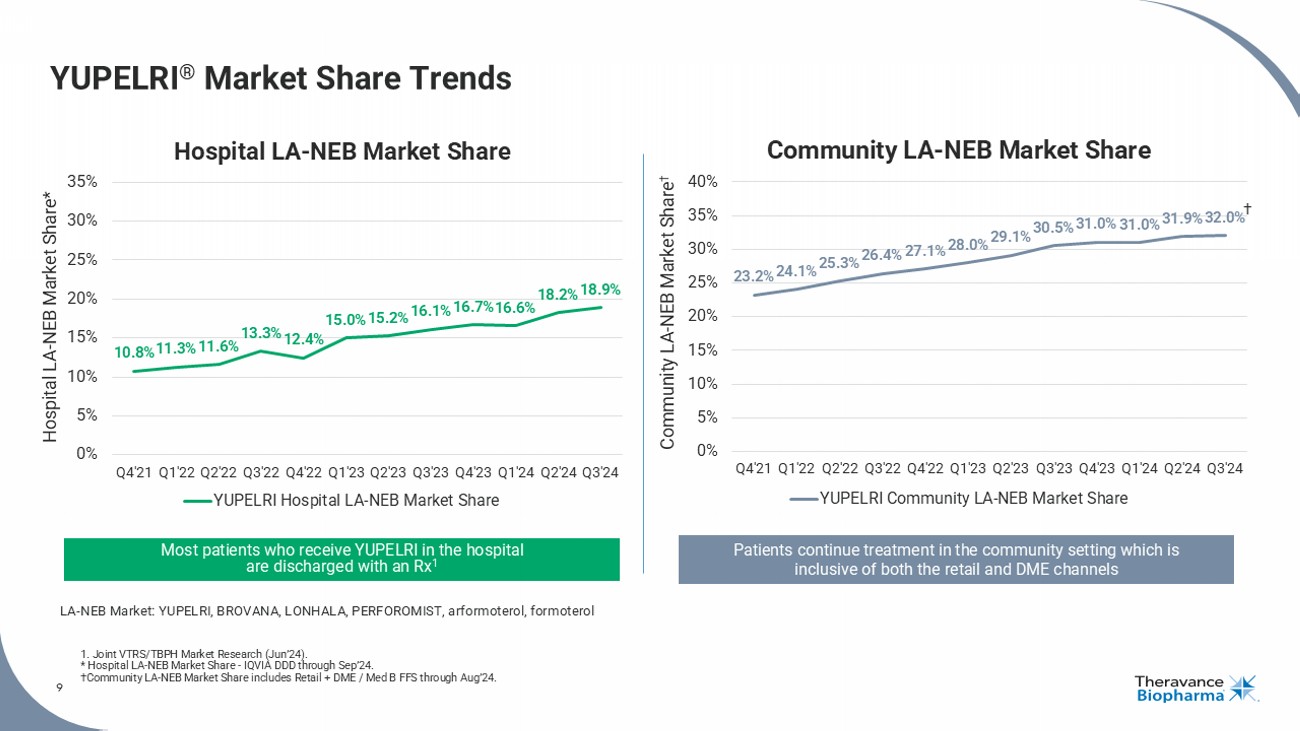
YUPELRI®市場份額走勢 1. 聯合VTRS/TBPH市場調研('24年6月)。* 醫院LA - NEb市場份額 - 通過IQVIA DDD截至'24年9月。† 社區LA - NEb市場份額包括零售+DME/ Med b FFS截至'24年8月。9 10.8% 11.3% 11.6% 13.3% 12.4% 15.0% 15.2% 16.1% 16.7% 16.6% 18.2% 18.9% 0% 5% 10% 15% 20% 25% 30% 35% Q4'21 Q1'22 Q2'22 Q3'22 Q4'22 Q1'23 Q2'23 Q3'23 Q4'23 Q1'24 Q2'24 Q3'24 醫院LA - NEb市場份額* YUPELRI醫院LA-NEb市場份額 患者在社區環境中繼續治療,其中包括零售和DME渠道23.2% 24.1% 25.3% 26.4% 27.1% 28.0% 29.1% 30.5% 31.0% 31.0% 31.9% 32.0% 0% 5% 10% 15% 20% 25% 30% 35% 40% Q4'21 Q1'22 Q2'22 Q3'22 Q4'22 Q1'23 Q2'23 Q3'23 Q4'23 Q1'24 Q2'24 Q3'24 社區LA - NEb市場份額† YUPELRI社區LA-NEb市場份額 大多數在醫院接受YUPELRI的患者出院時會帶有處方1 LA-NEb市場:YUPELRI、BROVANA、LONHALA、PERFOROMISt、阿福莫特羅、福莫特羅 醫院LA-NEb市場份額 社區LA-NEb市場份額†
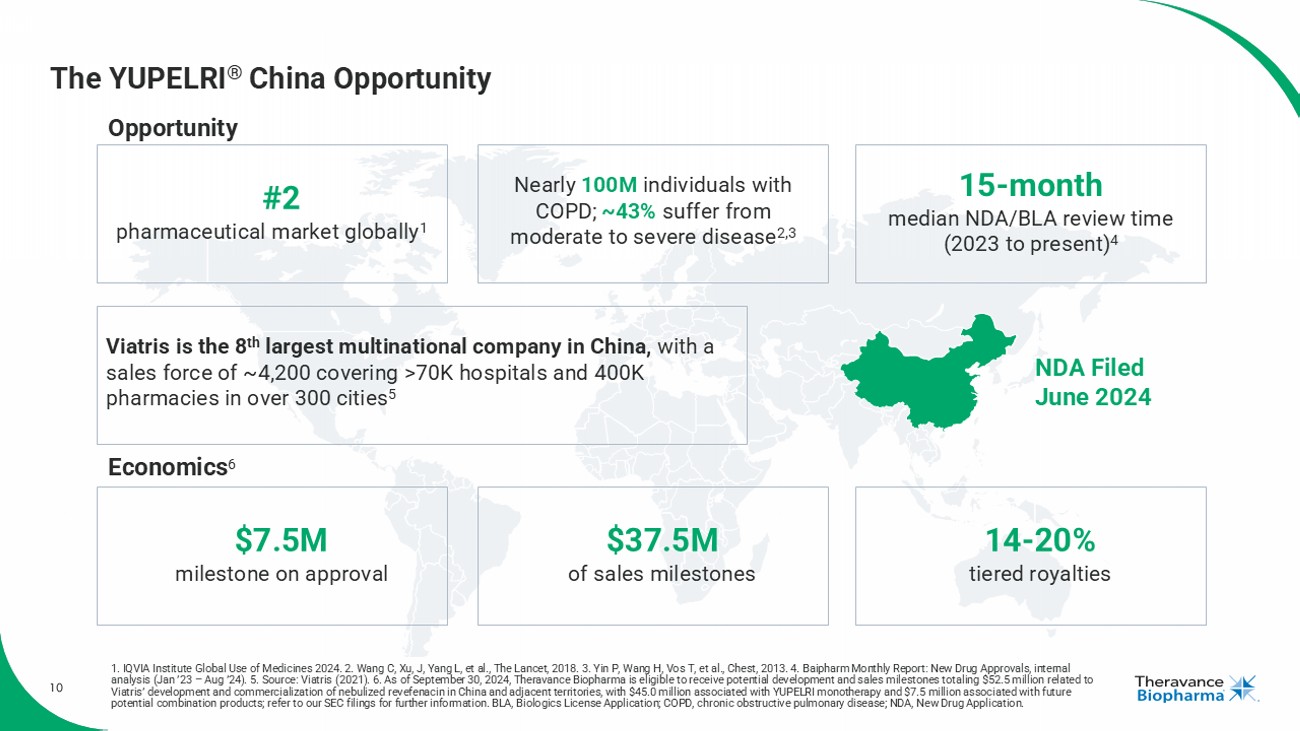
10 YUPELRI®中國機遇 2024年6月遞交新藥申請 Viatris是中國第八大跨國公司,在中國有約4,200名銷售人員,覆蓋7萬多家醫院和40萬家藥店,涵蓋300多個城市 5 全球第二大製藥市場 1 COPD患者近1億;約43% 患有中重度疾病 2,3 NDA/BLA審查時間中位數爲15個月(2023至今)4 經濟 6 認證通過750萬美元 銷售里程碑達到3750萬美元 14-20% 分層版稅 機會 1. IQVIA研究機構2024年全球用藥情況。 2. Wang C, 徐J, 楊L等,柳葉刀,2018。 3. Yin P, 王H, 瓦斯等,胸腔,2013。 4. Baipharm月度報告:新藥審批,內部分析('23年1月 - '24年8月)。 5. 來源:Viatris(2021年)。 6. 截至2024年9月30日,Theravance Biopharma有資格獲得可能與Viatris在中國及相鄰地區推出和商業化nebulized revefenacin相關的發展和銷售里程碑,其中4500萬美元與YUPELRI單獨療法相關,750萬美元與將來潛在的組合產品相關;請參閱我們的SEC文件以獲取更多信息。BLA,生物製品許可申請;COPD,慢性阻塞性肺病;NDA,新藥申請。

11次/天霧化長效MAMA COPD維持治療藥物o醫保b部門治療;有附加保險的FFS受益人的支出成本低至$0 1 o上一年度美國銷售額增長8%,達到2.33億美元;theravance公司獲得美國利潤的35% 2 o品牌盈利,利潤率擴大顯著的增長潛力o多達190萬患者可能從YUPELRI在美國受益o中國已提交NDA(2024年6月)即將到來的里程碑和版稅潛力o美國:總計單藥銷售里程碑高達1.5億美元3;第1年美國淨銷售額超過2.5億美元時的首4 o中國:直至4500萬美元的單藥發展和銷售里程碑;14-20%分層特許使用費4 IP保護在美國獲得至2039年YUPELRI®價值主張1. Ochieng, N.,等,「醫療保險受益者覆蓋來源快照」,KFF,2023年12月13日,www.kff.org/medicare/issue-brief/a-snapshot-of-sources-of-coverage-among-medicare-beneficiaries/。2.在美國,Viatris正帶頭商業化YUPELRI,並且Theravance Biopharma共同推廣該產品按盈利和損失共享安排(65% 到Viatris;35%到Theravance Biopharma)。3.截至2024年9月30日,Theravance Biopharma有資格從Viatris獲得潛在的全球發展、監管和銷售里程碑支付(不包括China和相鄰領土),總計高達2.05億美元;詳細信息請參閱我們的SEC文件。4.截至2024年9月30日,Theravance Biopharma有資格收到與Viatris在中國及相鄰地區開發和商業化霧化revefenacin相關的5250萬美元的潛在發展和銷售里程碑,其中4500萬美元與YUPELRI單獨療法有關,750萬美元與未來潛在組合產品有關;詳細信息請參閱我們的SEC文件。COPD,慢性阻塞性肺疾病;FFS,按服務費用付費;LAMA,長效毒蕈鹼拮抗劑;NDA,新藥申請。

作爲第一款且唯一一款每天僅需一次即可使用的三聯療法吸入治療器,用於成人患有COPD或哮喘,與Royalty Pharma阿齊茲·薩瓦夫高級副總裁、首席財務官達成里程碑和版稅協議,GSK的TRELEGY COPD,慢性阻塞性肺病
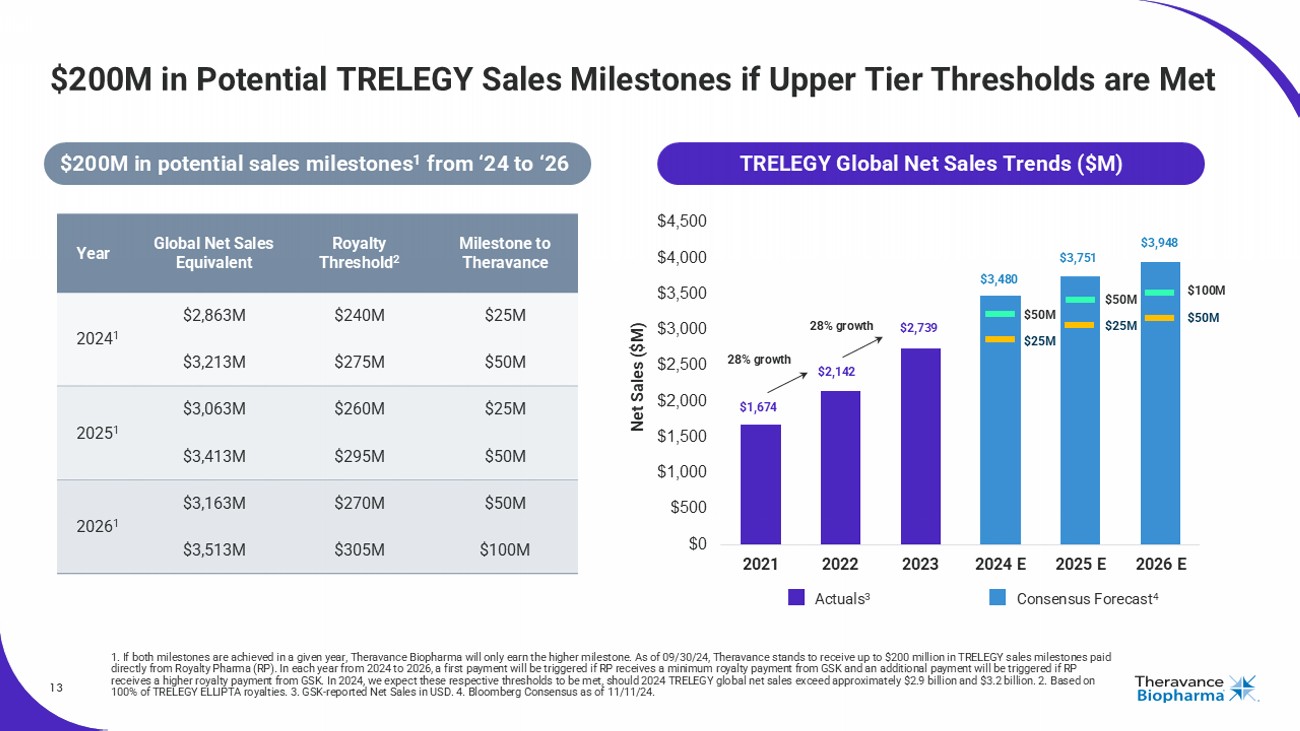
如果達到上限閾值,TRELEGY銷售額潛在里程碑爲2億美元13億元。如果在給定年度實現了兩個里程碑,Theravance Biopharma將只獲得更高的里程碑。截至09/30/24,預計Theravance將直接從Royalty Pharma(RP)處獲得高達2億美元的TRELEGY銷售額里程碑。從2024年到2026年的每年,如果RP從GSk收到最低版稅付款,將觸發第一筆付款,如果RP從GSk收到較高的版稅付款,將觸發額外付款。2024年,我們預計這些閾值將被滿足,如果2024年TRELEGY全球淨銷售額超過約29億元和32億元。基於TRELEGY ELLIPTA版稅的100%。GSk - 報告的淨銷售額以美元計算。2024年11月11日的彭博一致預測。0 5億美元 2.5億美元 5億美元 2.5億美元 1億美元 5億美元 1,674 2,142 2,739 3,480 3,751 3,948 28%增長28%增長給Theravance Royalty的里程碑閾值2個全球淨銷售額相當於2024年每年2.5億美元 2,4000萬2024年2863.00萬2024年 1個5,000萬2,7500萬3,2130.00萬2025年 1個5,000萬2,9500萬3,4130.00萬2026年 1個1億美元3,0500萬3,5130.00萬TRELEGY全球淨銷售額趨勢(最低潛在銷售額爲2億美元,從2024年到2026年)

從2029年開始返還的全球TRELEGY版稅 1.符合資格的領土首次推出後約15年後結束資格:預計美國版稅將在2032年末結束,而非美國版稅將根據國家自身的基礎在2030年代中期結束。2.在合格領土的全球淨銷售額佔6.5%至10.0%的總版稅;Theravance收到版稅的85%。版稅詳情:-版稅返還給Theravance:-美國之外的版稅將於2029年7月1日返還-美國版稅將於2031年1月1日返還-計算在合格領土的全球淨銷售額上-逐漸提高的實際費率爲5.5-8.5%-直接由Royalty Pharma支付Theravance的版稅比例年度全球淨銷售額1的5.5% 6.5% 金融壓力位 1 7.7%9% 22. 5億美元 8.5% 10.0% 超過22.5億美元的淨銷售額版稅閾值從2029年開始至2030年代中期至2030年代中期返回的版稅

作爲開發中的第一種每日一次的選擇性去甲腎上腺素重攝取抑制劑,用於治療多系統萎縮患者的症狀性nOH的ampa黃金,阿因·米勒博士,多系統萎縮開發高級副總裁;nOH,神經源性直立性低血壓AMPRELOXETINE

16 Ampreloxetine更新CYPRESS研究:o重要進展激活其餘主要學術中心/卓越中心o入組與預期一致,開發時間表如期進行1. A麥勒,多系統萎縮,nOH患者的ampo黃金長期安全2. 安普雷洛西汀對神經源性直立性低血壓症狀患者的長期安全性。R Freeman,I Biaggioni,R Vickery,L Norcliffe-Kaufmann萬 Gu erin萬 Bryarly,V Iodice萬 Rudzińska-Bar,m Boczarska-Jedynak,C Oehlwein,C Shibao,H Kaufmann. 2024年9月26日至10月1 日,在費城,賓夕法尼亞州舉行的國際帕金森病和運動障礙大會報告2. 症狀性神經源性直立性低血壓(nOH)對α-突觸核蛋白病患者症狀負擔和日常功能的影響。V Iodice萬 Guerin,S Johnstone,L Norcliffe-Kaufmann,A Miller,R Vickery。2024年11月6日至9日,在加利福尼亞州聖巴巴拉舉行的國際自主神經系統研討會上報告MSA,多系統萎縮;nOH,神經源性直立性低血壓。科學報告:o來自0170研究開放標籤擴展(OAK)的長期數據,於9月份國際帕金森病和運動障礙大會上報告,支持安普雷洛西汀的安全性和耐受性概況。o在2024年美國自主神經學會會議上,分析了0169研究(SEQUOIA)在原發性自主神經功能障礙中的表現,突顯了nOH在這些患者中的症狀負擔和MSA患者更大的需求

17 Ampreloxetine在nOH多系統萎縮中的價值主張重大未滿足的醫療需求o美國有大約40,000名患者患有罕見病,海外有顯著未滿足需求1,2,3o常用藥物在MSA中很少有效,並面臨重要的安全性和耐受性限制4,5具有獨特的首個類療法,具有孤兒藥物疾病指定6o每日一次劑量在目標人群中具有持久且具有臨床意義的療效o不會出現俯臥低血壓惡化的信號,進一步使其與競爭格局區別開風險減輕的監管和商業途徑CYPRESS旨在使用OSHA綜合終點複製正面第3階段MSA研究0170的結果o與FDA就OHSA綜合作爲主要終點相一致,CYPRESS加上0170的結果符合要求o聚焦商業努力可以最佳地應對集中治療景觀授予IP至2037年1. Kalra Dk等人。Clin Med Insights: Cardiol . 2020(70%-90%);14:1179546820953415。2. Delveinsight MSA市場預測(2023);與單純性自主神經功能障礙和多系統萎縮相關的直立性低血壓症狀,CJ Mathias(1999)3. Thelansis nOH市場報告2023年;TBPH內部分析。4. NORTHERA®(droxidopa)[說明書]。Deerfield,IL:Lundbeck。2014年。5. ProAmatine®(咪噠定氫氯酸鹽)[警告參考4052798]。6.反映了瑞蓋製藥基於迄今的臨床試驗數據對安普雷洛西汀的期望。安普雷洛西汀正在開發中,未獲任何適應症批准。文件數據。MSA,多系統萎縮;nOH,神經源性直立性低血壓;OHSA,直立性低血壓症狀評估。

致富金融升博士阿齊茲·薩瓦夫,首席財務官
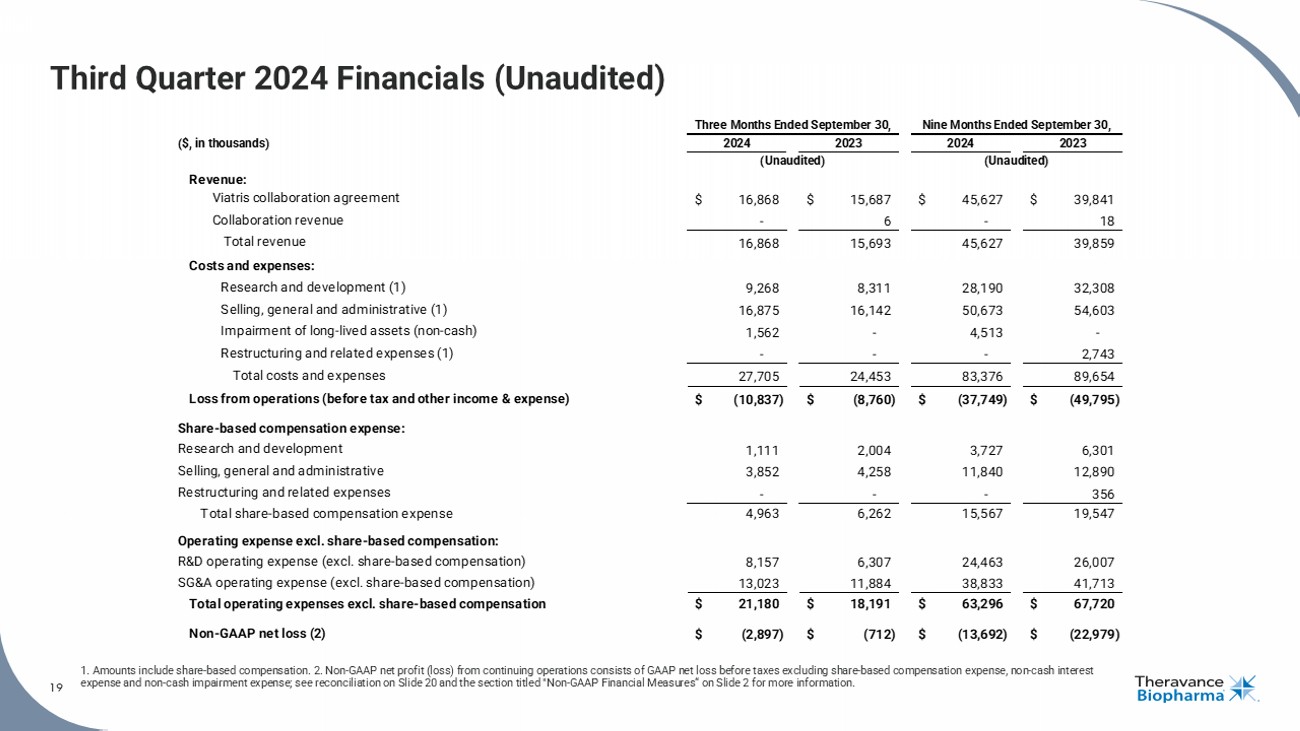
2024年第三季度財務數據(未經審計)1.金額包括股票補償。 2.持續營運中的非通用會計淨利潤(虧損)包括稅前通用會計淨虧損,不包括股票補償費用、非現金利息費用和非現金減值費用;請參見幻燈片20上的和標題爲「非通用會計財務指標」的第2張幻燈片上的調和表,了解更多信息。 19(千美元) 營業收入:Viatris合作協議 16,868 15,687 45,627 39,841 合作收入 - 6 - 18 總收入 16,868 15,693 45,627 39,859 成本和費用: 研發(1) 9,268 8,311 28,190 32,308 銷售,總務和管理(1) 16,875 16,142 50,673 54,603 長期資產減值(非現金) 1,562 - 4,513 - 重組和相關費用(1) - - - 2,743 總成本和費用 27,705 24,453 83,376 89,654 虧損(稅前)$(10,837) $(8,760) $(37,749) $(49,795) 股票補償費用:研發 1,111 2,004 3,727 6,301 銷售,總務和管理 3,852 4,258 11,840 12,890 重組和相關費用 - - - 356 股權報酬費用總額 4,963 6,262 15,567 19,547 非股票補償的營業費用: R&D營業費用(不包括股票補償) 8,157 6,307 24,463 26,007 SG&A營業費用(不包括股票補償) 13,023 11,884 38,833 41,713 總營業費用(不包括股票補償)21,180 18,191 63,296 67,720 非通用會計淨虧損(2)$(2,897) $(712) $(13,692) $(22,979) 2024年9月30日結束的三個月2023年(未經審計)2024年9月30日結束的九個月2023年(未經審計)

2024年第三季度財務報表(未經審計)(續)請查看幻燈片2上標題爲「非依照美國通用會計準則的財務數據」部分,獲取更多信息。按照美國通用會計準則計算的淨虧損 $ (12,698) $ (8,950) $ (40,891) $ (46,683) 調整項目:股權獎勵支出 4,963 6,262 15,567 19,547 非現金長期資產減值損失 1,562 - 4,513 - 非現金利息支出 630 609 1,903 1,727 所得稅費用 2,646 1,367 5,216 2,430 非美國通用會計淨虧損 $ (2,897) $ (712) $ (13,692) $ (22,979) 每股基本和攤薄非美國通用會計淨虧損每股 $ (0.06) $ (0.01) $ (0.28) $ (0.40) 用於計算每股基本和攤薄非美國通用會計淨虧損的股數 49,038 52,361 48,690 57,287(未經審計)按千美元計算,美國通用會計原則與非美國通用會計淨虧損的調整情況陳述 2024年9月30日結束的三個月及九個月 2023年9月30日結束的三個月及九個月(未經審計)
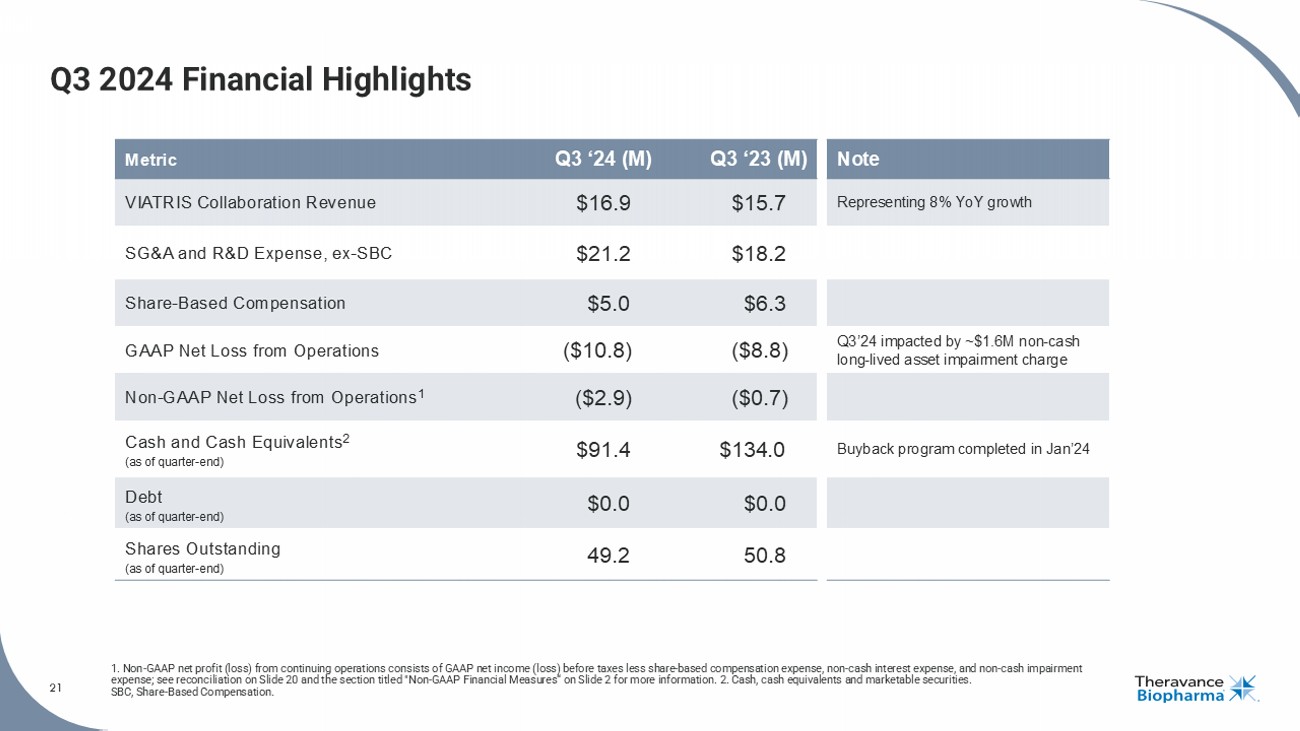
2024年第三季度財務亮點 1. 持續營運的非美國通用會計淨利潤(虧損)包括稅前美國通用會計原則淨利潤(虧損)扣除股權獎勵支出、非現金利息支出和非現金減值支出;請查閱第20頁的調整對比和幻燈片2上標題爲「非依照美國通用會計準則的財務數據」部分,獲取更多信息。 2. 現金、現金等價物和有價證券。SBC,股權獎勵。註釋 第三季度‘23(百萬)第三季度‘24(百萬)代表8%同比增長的指標 $15.7 $16.9 viatris 合作營收 $18.2 $21.2 銷售與研發支出,不包含股權獎勵 $6.3 $5.0 股權獎勵 第24季度受大約160萬美元的非現金長期資產減值損失影響 ($8.8) ($10.8) 現運營淨虧損 ($0.7) ($2.9) 非美國通用會計淨虧損 1 2024年1月完成回購計劃 $134.0 $91.4 現金及現金等價物 2(季末) $0.0 $0.0 債務(季末) 50.8 49.2 流通股數(季末)
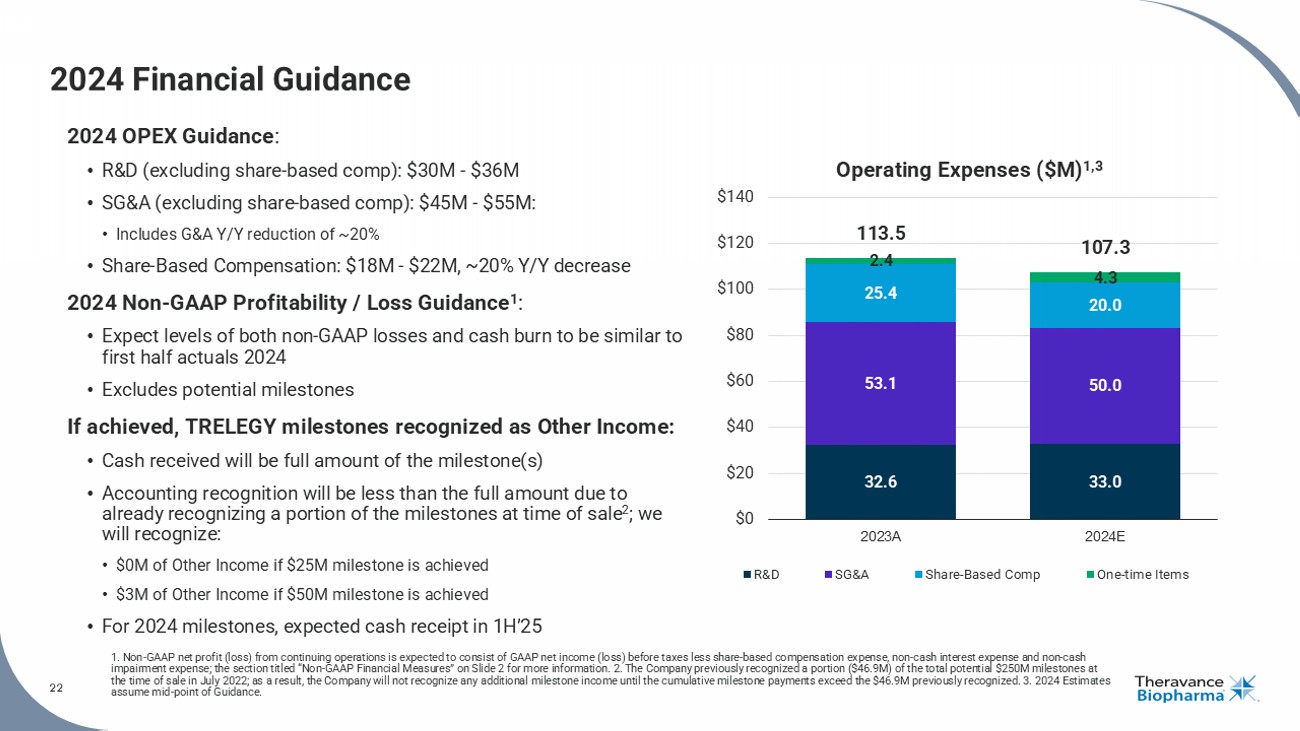
2024年財務業務1. 非GAAP持續經營淨利潤(損失)預計包括稅前GAAP淨收入(損失)扣除股份報酬費用、非現金利息費用和非現金減值費用;有關更多信息,請參閱幻燈片2中的標題爲「非GAAP財務指標」的部分。2.公司先前在2022年7月銷售時認可總共25000萬美元潛在里程碑中的一部分(46.9百萬美元);因此,公司在累計里程碑付款超過先前認可的4690萬美元之前,將不再確認任何額外的里程碑收入。3.2024年度預計假設爲指導中點。2024年營業費用預算: •研發(不包括股份報酬): 3000萬-3600萬美元 •SGA(不包括股份報酬): 4500萬-5500萬美元: •包括G和A較去年減少約20% •股份報酬: 1800萬-2200萬美元,較去年減少約20% 2024年度非GAAP盈利/虧損指引1: •預計非GAAP虧損水平和現金消耗量類似於2024年上半年的實際情況 •不包括潛在的里程碑如果已實現,TRELEGY的里程碑將被認可爲其他收入: •收到的現金將是里程碑的全額 •會計確認將少於到期總額,因爲在銷售時已經認可里程碑的一部分2;我們將認可: •如果2500萬美元的里程碑達成,將認可0百萬美元的其他收入 •如果5000萬美元的里程碑達成,將認可300百萬美元的其他收入 •對於2024年度里程碑,預計將在2025年上半年收到現金32.6 33.0 53.1 50.0 25.4 20.0 2.4 4.3 113.5 107.3 0 20 40 60 80 100 120 140 2023A 2024E R和D SGA股份報酬 一次性項目營業費用(百萬美元) 1,3

23 最大化股東價值 在患有MSA和nOH的患者中完成關鍵的第3階段 研發 破壞性罕見神經疾病,導致約80%的患者出現不可緩解的自主神經功能障礙症狀 2,3 Ampreloxetine: 可能是獨特設計以減輕這些症狀並改善生活質量的第一類藥物 強大的財務狀況,現金9140萬美元,無債務; 預期現金使用有限 最多可通過2026年獲得2萬美元的TRELEGY里程碑獎金;從2029年開始,回收的版稅 潛力 達到2千萬美元 4 成立戰略評估委員會,以評估解鎖價值的替代方案 致力於將多餘資本返還給股東 簡述: Theravance的戰略優先事項 1.來源: Citeline Pharma Custom Intelligence Primary Research 2023年4月,Symphony Health METYS Prescription Dashboard, SolutionsRx Med b FFS. 2. Kalra Dk,等人。Clin Med Insights: Cardiol . 2020(70% - 90%);14:1179546820953415. 3. Delveinsight MSA市場預測(2023年);與直立性低血壓有關的症狀, 純自主性功能失敗和多系統萎縮, CJ Mathias(1999). 4.從2024年到2026年,Theravance有可能直接從Royalty Pharma(RP)獲得最多2千萬美元的TRELEGY銷售里程碑獎金。如果RP根據TRELEGY全球淨銷售獲得特定最低版稅支付,將觸發這些支付。從2029年開始,Theravance有資格收取與TRELEGY全球淨銷售有關的版稅支付(有關更多信息,請參閱SEC備案資料)。 LAMA,長效抗膽鹼藥; MSA,多系統萎縮; nOH,神經性直立性低血壓。增長YUPELRI 只需一天一次的霧化LAMA:目前可滲透的可尋址市場不到5% 贏得戰略與臨床最佳實踐一致

Rick Winningham首席執行官Aziz Sawaf、CFA高級副總裁兼首席財務官Rhonda Farnum高級副總裁兼首席商務官Áine Miller高級副總裁,開發Q&A會話

25 YUPELRI®(revefenacin)吸入溶液YUPELRI®吸入溶液適用於維持治療患有慢性阻塞性肺疾病(COPD)的患者。重要安全信息(美國)YUPELRI對revefenacin或本產品的任何成分過敏的患者禁忌。在COPD急性惡化或潛在危及生命的情況下不應在患者中啓動YUPELRI,也不應作爲急性療法用於緩解急性症狀,即用於支氣管痙攣急性發作的救治療法。急性症狀應該用吸入短效β2激動劑治療。與其他吸入藥物一樣,YUPELRI可能引起矛盾性支氣管痙攣,可能危及生命。如果使用YUPELRI後發生矛盾性支氣管痙攣,應立即使用吸入短效支氣管舒張劑治療。應立即停止YUPELRI治療,並採用替代治療。在狹角青光眼患者中應謹慎使用YUPELRI。患者應該被告知,如果出現任何急性狹角青光眼的體徵和症狀,包括眼部疼痛或不適、視物模糊、視覺幻影或彩色圖像伴隨着結膜充血和角膜水腫時,應立即諮詢醫療保健提供者。尿瀦留的惡化可能會發生。在前列腺增生或膀胱頸梗阻患者中謹慎使用,並指示患者立即聯繫醫療保健提供者,如果出現症狀。使用YUPELRI後可能發生即時過敏反應。如果發生反應,應立即停止YUPELRI,並考慮替代治療。在YUPELRI組臨床試驗中發生的最常見不良反應,其發生率≥2%,且高於安慰劑組的包括咳嗽、鼻咽炎、上呼吸道感染、頭痛和背痛。不推薦YUPELRI與抗膽鹼藥物或OATP 10億1和OATP 10億3抑制劑聯合使用。不推薦在任何程度肝功能受損患者中使用YUPELRI。OATP,有機陰離子轉運肽。25

YUPELRI®(revefenacin)吸入液是一種每天一次的祛痰劑,已獲得美國慢性阻塞性肺病(COPD)的維持治療批准。 Theravance Biopharma的市場研究顯示,在美國約有9%接受COPD治療的患者使用霧化器進行持續維持治療。 1 祛痰劑是COPD維持治療的基石,YUPELRI®被定位爲首個每日一次的單一藥物支氣管擴張劑產品,適用於需要或偏好霧化療法的COPD患者。 YUPELRI®在計量噴霧器和乾粉設備配方中的穩定性表明,該祛痰劑也可以作爲新型便攜式組合產品的基礎。 1.TBPH市場調研(N = 160名醫生);指的是美國COPD患者。 COPD,慢性阻塞性肺病; LAMA,長效毛果蛋白拮抗劑。

附錄I:YUPELRI

YUPELRI機遇:擴大~190萬名COPD患者中Neb LAMA的使用1.可尋址患者人口量化了目標患者中的患者人數。來源:Citeline Mark et Research(Jun'23)。 2.慢性阻塞性肺病全球倡議2024年報告。 3.根據美國包裝說明書指示用於緩解支氣管痙攣的藥物。 COPD,慢性阻塞性肺病; GOLD,慢性阻塞性肺病全球倡議; LABA,長效β2激動劑; LAMA,長效毛果蛋白拮抗劑; Neb,霧化療法。~20萬名目前長效Neb患者~20萬名不恰當使用短效(SA)Neb作爲維持治療的患者3 ~150萬名症狀患者因認知、手部靈活性和/或吸氣流量降低而僅使用便攜式設備作爲維持治療。 GOLD指南現在建議b和E患者接受LABA/LAMA聯合治療2越多症狀越高的惡化風險A b E SA Neb患者轉用YUPELRI 時,主要原因是引述控制不佳的症狀和急性惡化1改用YUPELRI的患者中,從便攜式設備轉換的佔大多數,並引述手部靈活性差、認知困難和呼峯吸氣流量低爲轉換原因1 領先的SA Neb必須每天服用4-6次 GOLD風險分類:正確使用吸入器受影響於:•認知能力•手部靈活性/協調性•吸氣流量•吸入器設備類型•吸入器技巧教育
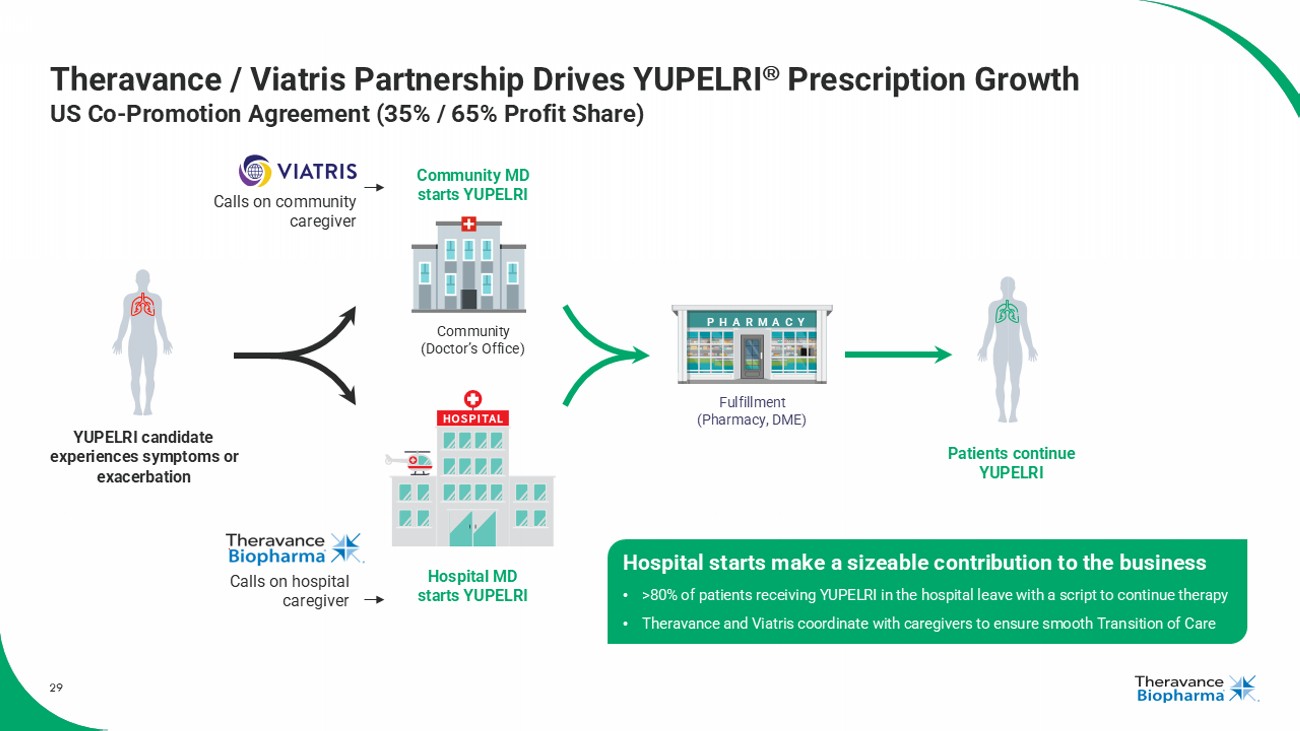
29 Theravance / Viatris 合作推動 YUPELRI 處方增長 美國共同推廣協議 (35% / 65%利潤分成) 社區 (醫生辦公室) 醫院 MD 開始 YUPELRI 社區 MD 開始 YUPELRI 醫院開始對業務產生重大貢獻 • 超過80%在醫院接受 YUPELRI 治療的患者離開時帶着處方繼續治療 • Theravance 和 Viatris 與護理人員協調,以確保平穩的護理過渡 患者繼續 YUPELRI 候選患者 對YUPELRI經驗症狀或 惡化 實現(藥房,醫療器械) 藥房 拜訪社區 護理人員 拜訪醫院護理人員

附錄 II: ampreloxetine
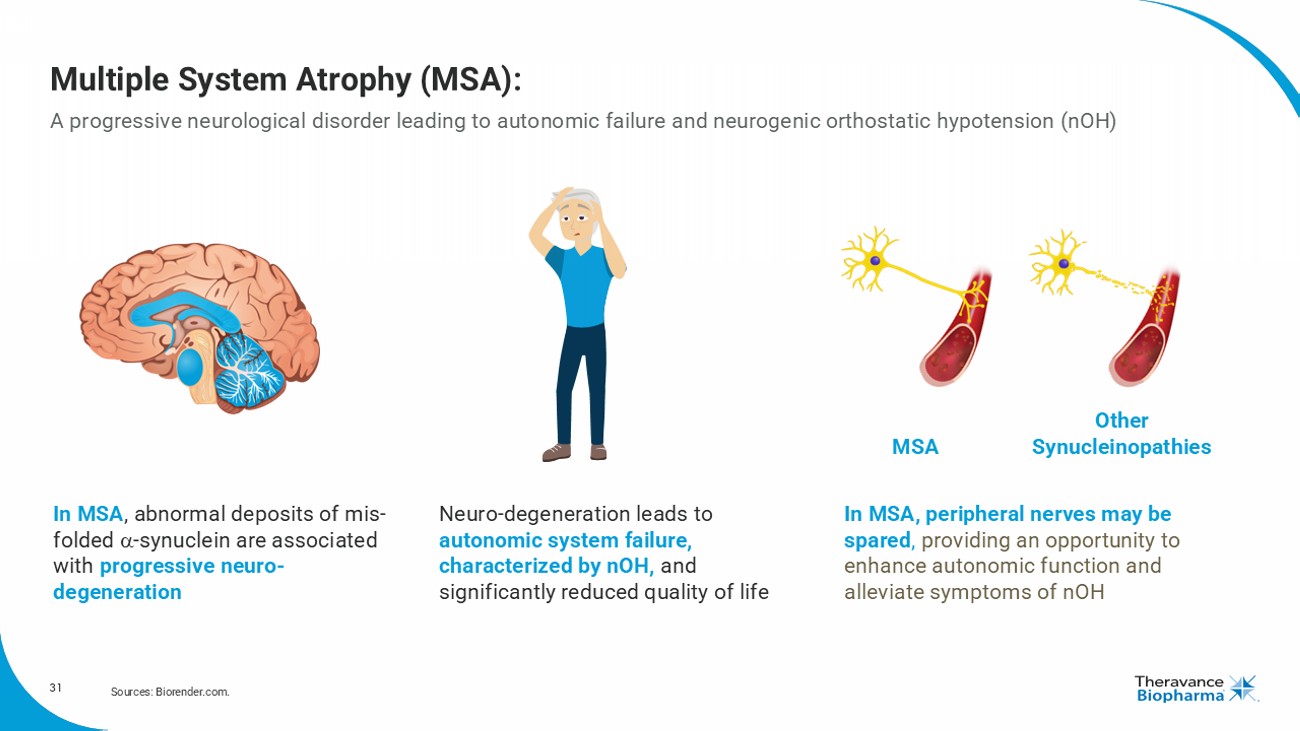
31 多系統萎縮( MSA): 一種漸進性神經系統疾病,導致自主神經功能衰竭和神經性直立性低血壓(nOH) 參考資料: Biorender.com. 在 MSA 中,異常的mis-folded α-突觸核蛋白沉積與漸進性神經退行性有關 神經退行性導致自主神經系統衰竭,表現爲 nOH,顯著降低生活質量 在 MSA 中,外周神經可能不受累,提供了改善自主功能和緩解 nOH 症狀的機會 MSA 其他 突觸核蛋白病
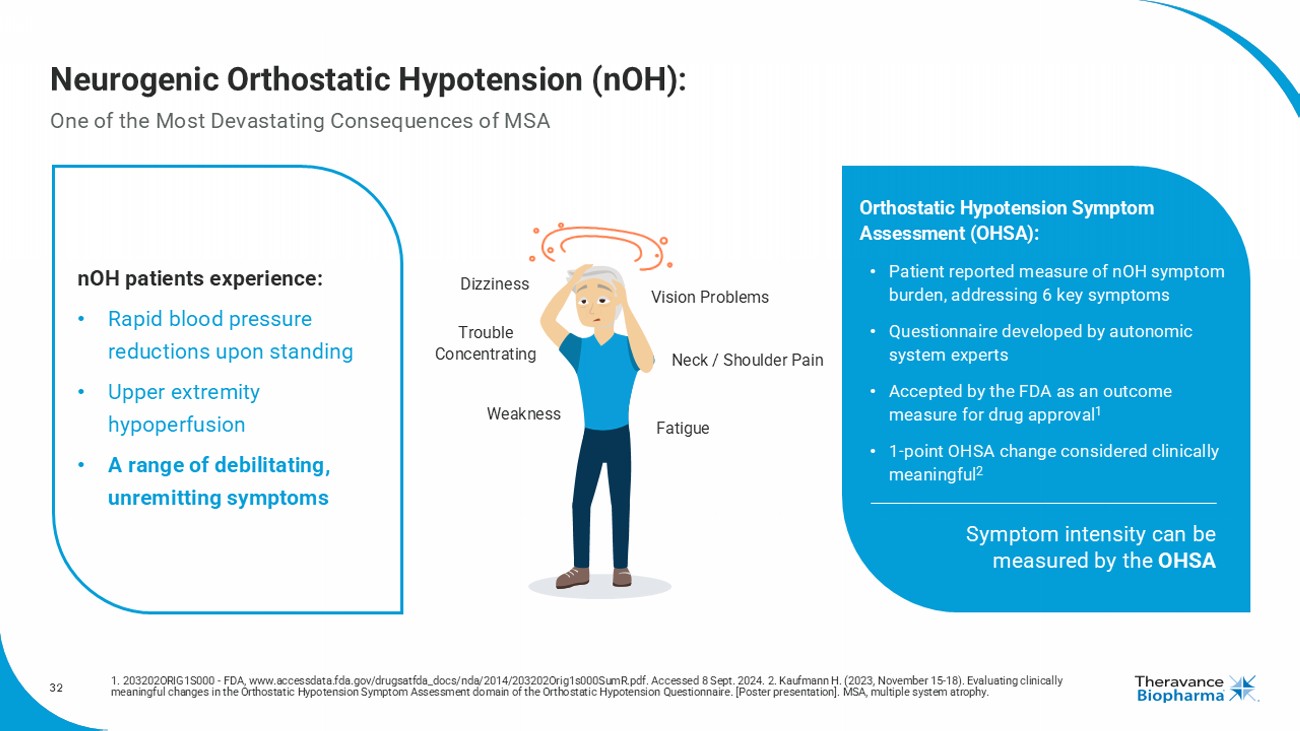
32 神經性直立性低血壓(nOH): MSA 中最具毀滅力的後果之一 1. 203202ORIG1S000 - FDA, www.accessdata.fda.gov/drugsatfda_docs/nda/2014/203202Orig1s000SumR.pdf. 訪問日期2024年9月8日. 2. Kaufmann H. (2023年11月15日 - 18日). 評估直立性低血壓症狀評估領域的臨床意義變化. [海報展示]. MSA, 多系統萎縮 nOH 患者經歷: • 站立時血壓迅速下降 • 上肢低灌注 • 一系列令人難以承受的持續性症狀 直立性低血壓症狀評估(OHSA): • 患者報告的 nOH 症狀負擔指標,涵蓋6個關鍵症狀 • 由自主神經系統專家制定的問卷 • 被 FDA 接受作爲藥物批准的結果指標 1 • 1分 OHSA 變化被視爲臨床意義重大 2 症狀強度可以通過 OHSA 測量 眩暈 視力問題 注意力不集中 頸部 / 肩部疼痛 虛弱 疲勞
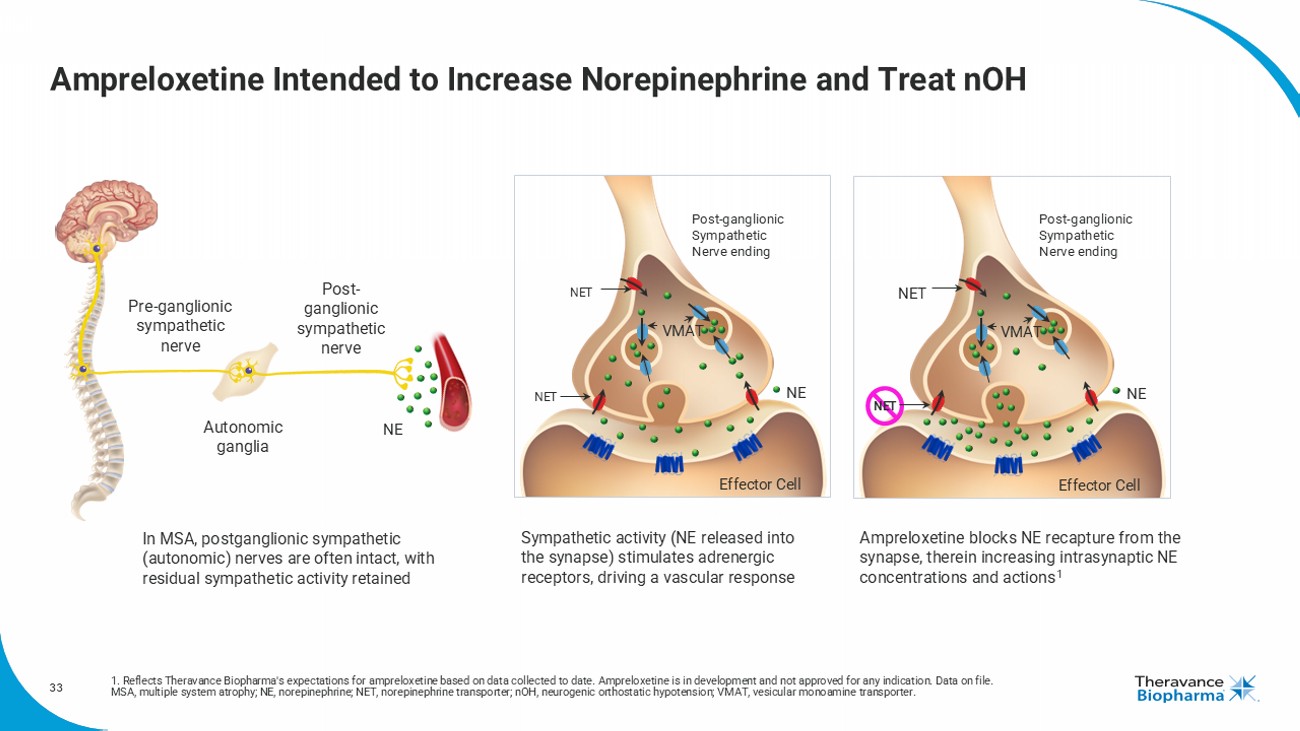
33安普洛施汀旨在增加去甲腎上腺素並治療nOH-節後神經節前交感神經節前交感神經自主神經節後交感神經末梢NEtNEVMAt效應細胞NEt交感活性(釋放到突觸中的NE)刺激腎上腺素受體,驅動血管反應在MSA中,節後交感(自主)神經通常完整,殘餘的交感活性得以保留安普洛施汀阻斷從突觸中重新捕獲NE,從而增加突觸間NE濃度和作用節後交感神經末梢NEtNEVMAt效應細胞NEt1.反映Theravance Biopharma對迄今收集的安普洛施汀數據的期望。安普洛施汀正在開發中,尚未獲得任何適應證。檔案中的數據。MSA,多系統萎縮;NE,去甲腎上腺素;NEt,去甲腎上腺素轉運體;nOH,神經性直立性低血壓;VMAt,囊泡單胺轉運體。
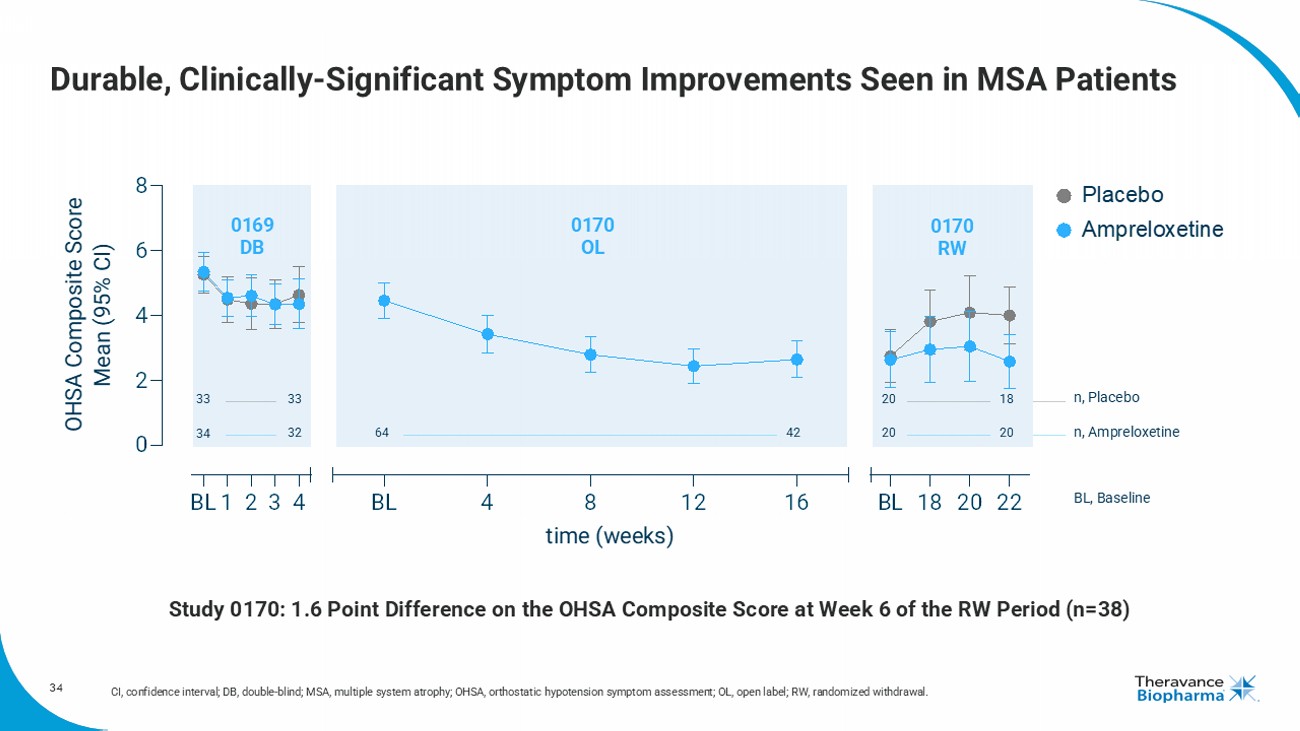
34 MSA患者表現出持久且臨床意義顯著的症狀改善CI,置信區間;Db,雙盲;MSA,多系統萎縮;OHSA,直立性低血壓症狀評估;OL,開放標籤;RW,隨機退出。 BL123420248BL4881216BL182022時間(周)OHSA複合評分均值(95% CI)安慰劑安普洛施汀33332018333220206442n,安慰劑n,安普洛施汀BL,基線0169Db0170OL0170RW研究0170:廣義模型OHSA複合評分在RW期第6周的1.6分差異(n=38)
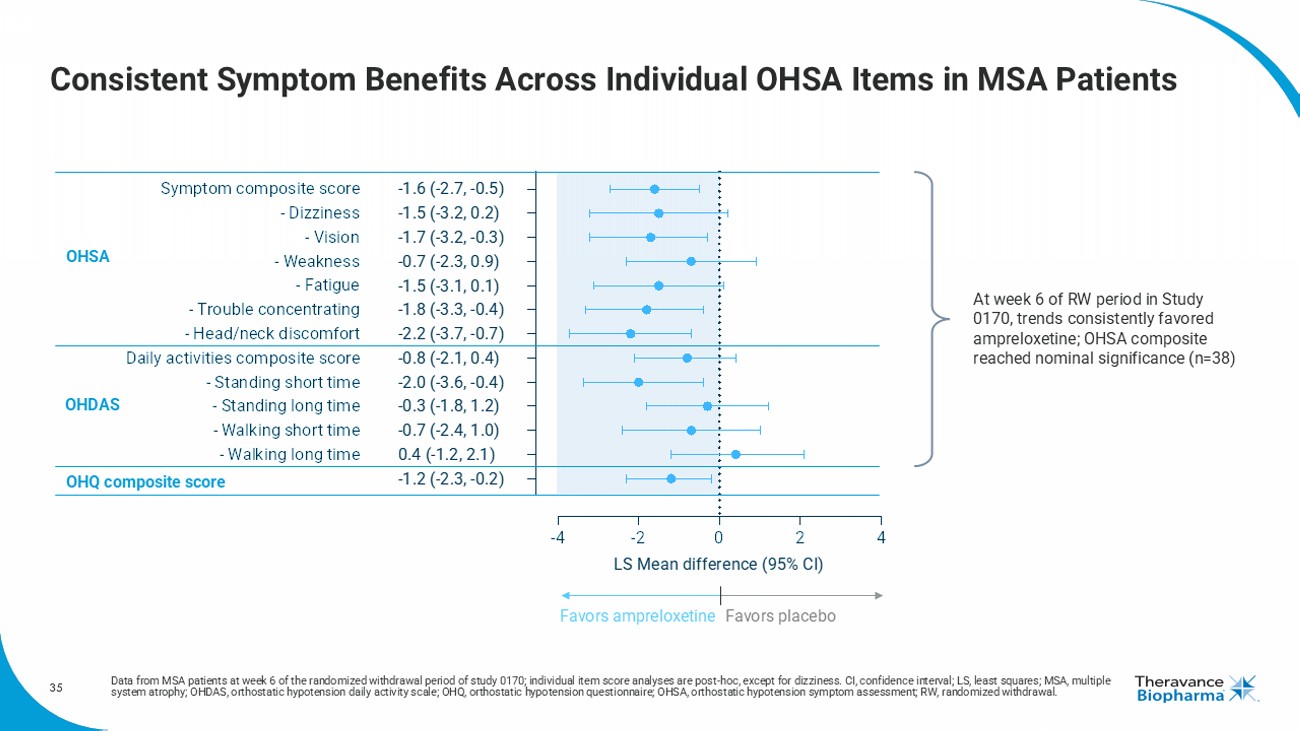
35 MSA患者的個體OHSA項目在症狀良好上保持一致於研究0170的隨機撤離期第6周的MSA患者數據;個體項目得分分析爲事後分析,除了頭暈。CI,置信區間;LS,最小二乘;MSA,多系統萎縮;OHDAS,直立性低血壓日常活動量表;OHQ,直立性低血壓問卷;OHSA,直立性低血壓症狀評估RW,隨機退出。-4-2 024OHQ複合評分-長時間行走-短時間行走-長時間站立-短時間站立日常活動綜合評分-頭頸不適-注意力不集中-疲勞-乏力-視力-頭暈症狀綜合評分LS均值差異(95% CI)-1.6(-2.7,-0.5)-1.5(-3.2,0.2)-1.7(-3.2,-0.3)-0.7(-2.3,0.9)-1.5(-3.1,0.1)-1.8(-3.3,-0.4)-2.2(-3.7,-0.7)-0.8(-2.1,0.4)-2.0(-3.6,-0.4)-0.3(-1.8,1.2)-0.7(-2.4,1.0)0.4(-1.2,2.1)-1.2(-2.3,-0.2)OHSA OHDAS支持安普洛施汀支持安慰劑OHQ複合評分在研究0170的RW期第6周,趨勢一直傾向於支持安普洛施汀;OHSA複合項達到名義顯著性(n=38)
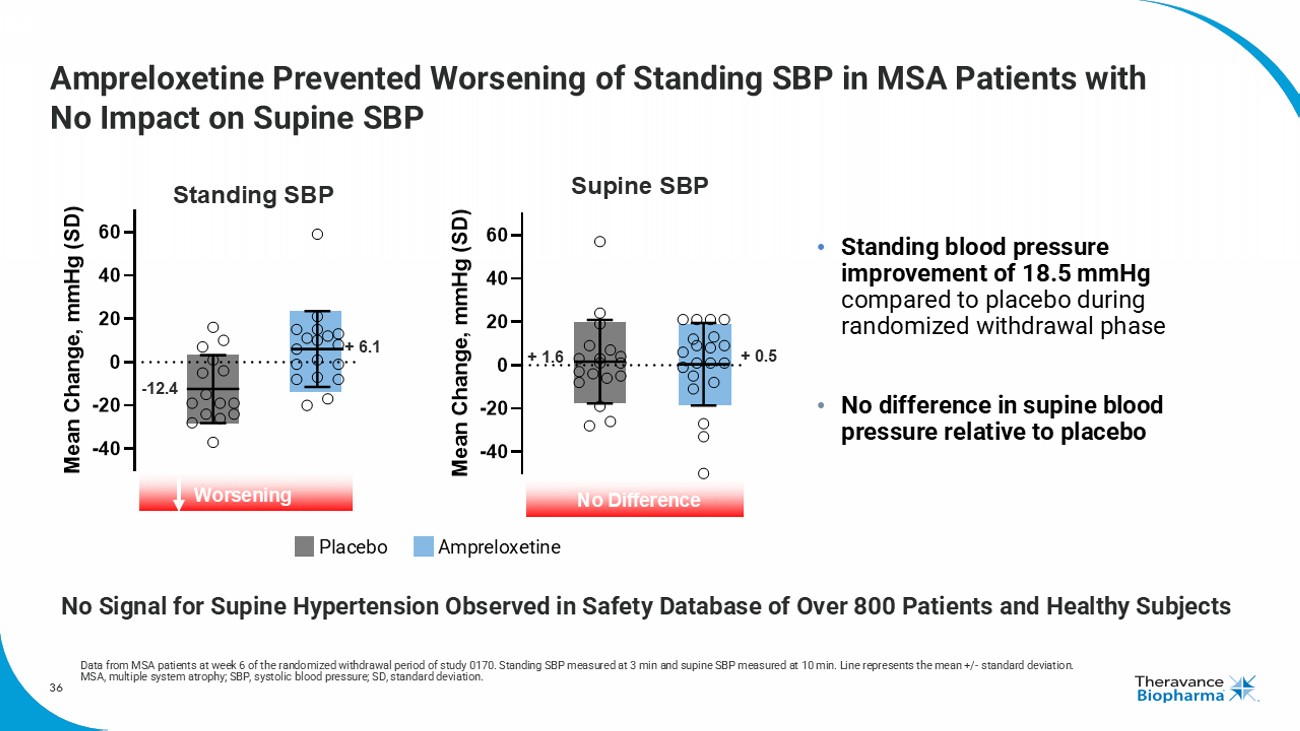
6000萬 e a n C h a n g e,按照奧普雷洛西汀對多系統萎縮症患者坐立位SBP的惡化預防,對平臥位SBP沒有影響進行比較。在隨機退出階段,與安慰劑相比,站立血壓改善了18.5mmHg,而平臥血壓相對於安慰劑未見差異。0170研究隨機退出期的第6周來自MSA患者的數據。站立SBP在3分鐘測量,平臥SBP在10分鐘測量。線代表平均值+/-標準偏差。MSA,多系統萎縮症;SBP,收縮壓;SD,標準偏差。安慰劑奧普雷洛西汀 -12.4+6.1站立式SBP惡化,在超過800名患者和健康受試者的安全數據庫中未觀察到平臥高血壓信號-40-20 0 20 40 6000萬 e a n C h a n g e,按照奧普雷洛西汀對多系統萎縮症患者的研究0170複製設計。
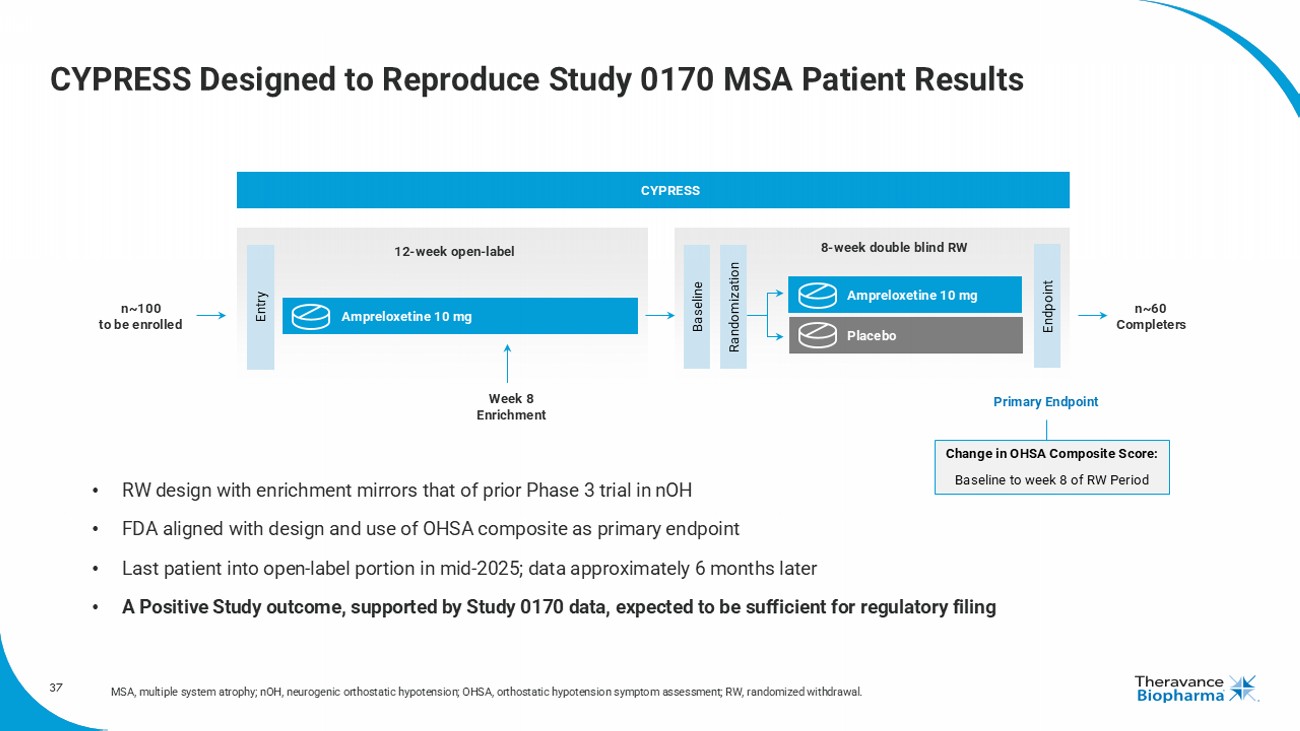
CYPRESS旨在重現0170研究多系統萎縮症患者的結果。MSA,多系統萎縮症;nOH,神經源性直立性低血壓;OHSA,直立性低血壓症狀評估;RW,隨機退出。入組終點8周雙盲隨機退出12周開放標籤基線隨機化奧普雷洛西汀10mg奧普雷洛西汀10mg安慰劑第 8周增值約100名患者,完成CYPRESS OHSA複合評分的變化:從隨機退出期的基線到第8周。 • 增值的RW設計反映了以往nOH的3期試驗 • FDA與設計對齊並使用OHSA複合評分作爲主要終點 • 最後一個患者於2025年中進入開放標籤部分;數據大約6個月後 • 預期有積極的研究結果,由0170研究數據支持,可滿足監管申請主要終點
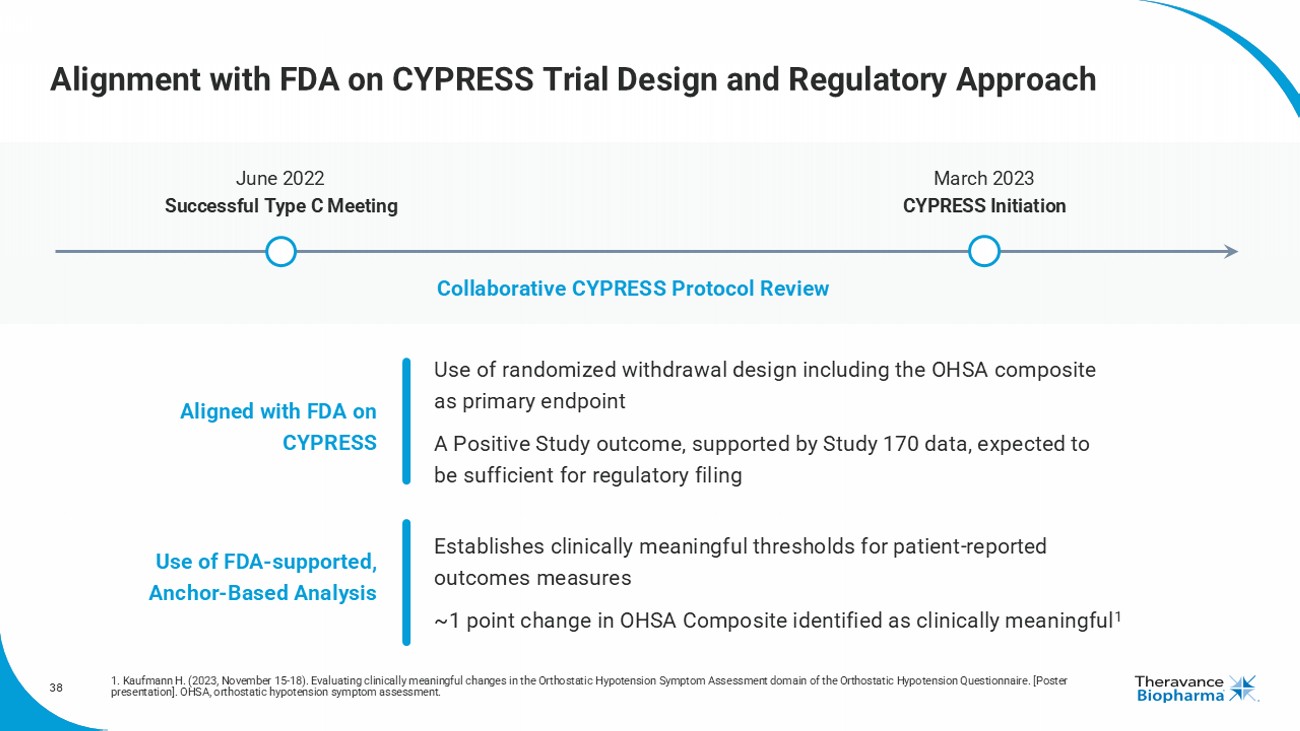
與FDA在CYPRESS試驗設計和監管方法上的一致性1。Kaufmann H.(2023年11月15-18日)。評估直立性低血壓症狀評估問卷領域中具有臨床意義的變化[海報展示]。OHSA,直立性低血壓症狀評估。在FDA的支持下與CYPRESS設計對齊,使用FDA支持的錨點分析2022年6月成功的C型會議2023年3月CYPRESS啓動協作CYPRESS協議審查 • 使用隨機退出設計,包括OHSA複合終點作爲主要終點 • 預計有積極的研究結果,由170研究數據支持,將足以遞交監管申請建立患者報告結果措施的臨床意義閾值,OHSA複合變化1點被確認爲臨床意義
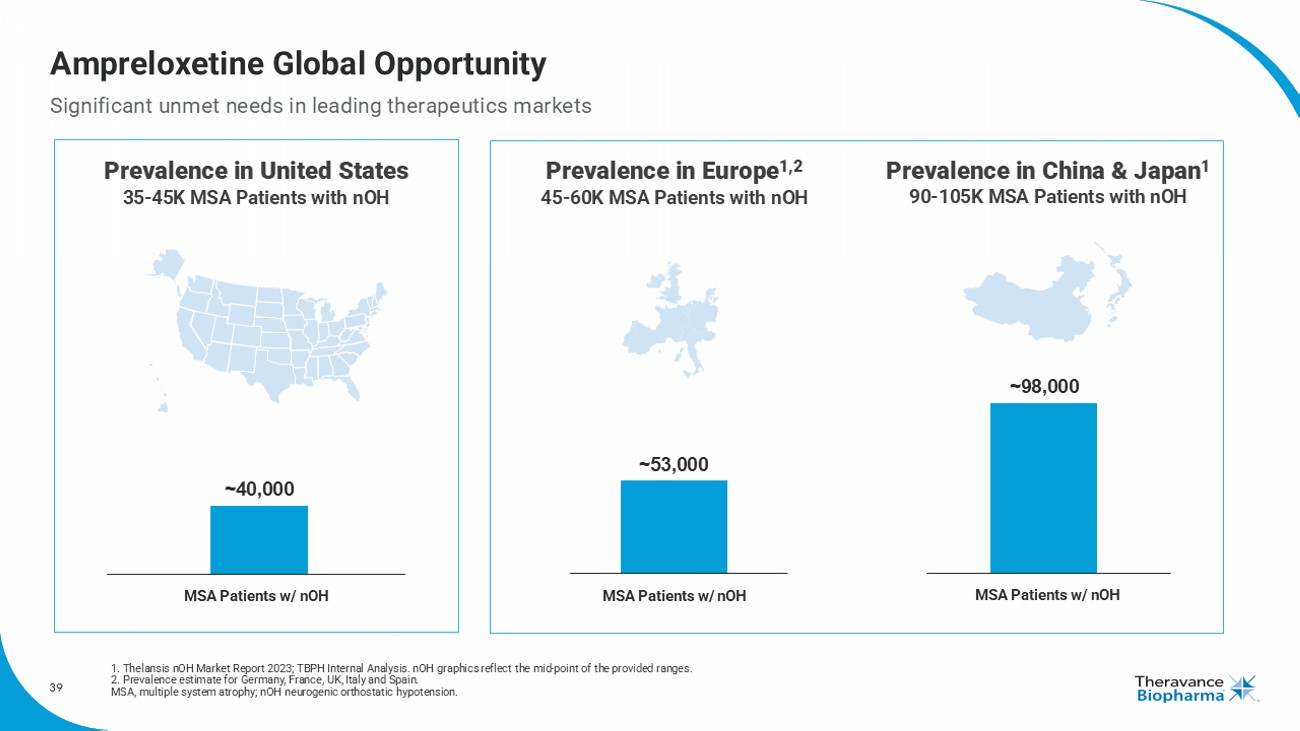
歐洲Msa患者中盛行率爲4.5 - 6萬,患有nOH的患者 中國和日本的患者盛行率爲9 - 10.5萬,患有nOH的患者 Ampreloxetine的全球機會 全球領先治療市場存在重大未滿足需求 1. Thelansis nOH市場報告2023; TBPH內部分析。 nOH圖反映所提供範圍的中點。 2. 德國,法國,英國,意大利和西班牙的盛行率估計 MSA,多系統萎縮症; nOH,神經性直立性低血壓。 ~ 40,000 ~ 53,000 ~ 98,000患有nOH的MSA患者 患有nOH的MSA患者 美國患者盛行率爲0.5 - 4.5萬,患有nOH的MSA患者 ~ 53,000 ~ 98,000患有nOH的MSA患者
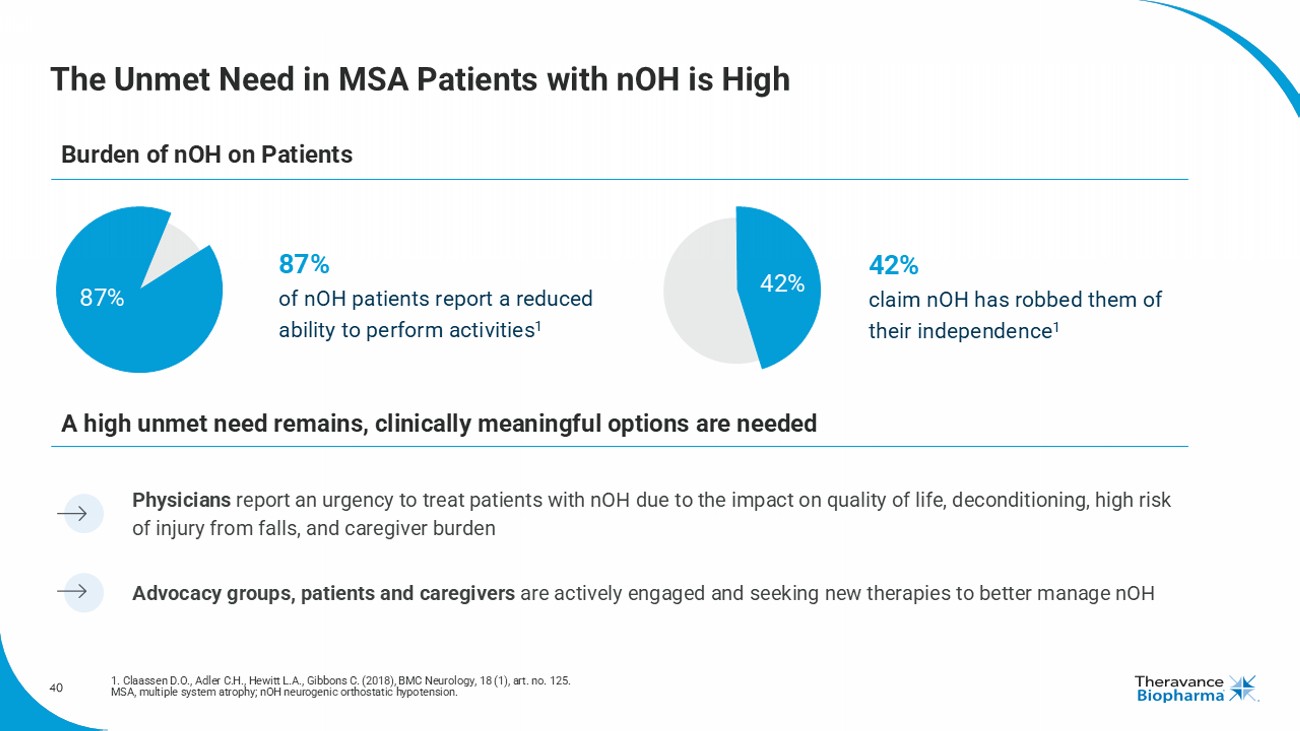
42在患有nOH的MSA患者中未滿足的需求較高 1. 克拉森D.O.,阿德勒C.H.,休伊特L.A.,吉布恩斯C.(2018年),BMC神經病學,18(1),藝術編號125。 MSA,多系統萎縮症; nOH,神經性直立性低血壓。 支持團體,患者和護理人員積極參與並尋求新療法以更好地管理nOH 醫生報告,由於對生活質量,去適應,摔倒受傷的高風險和護理負擔的影響,急於治療患有nOH的患者 對患有nOH的患者的負擔仍然較高,需要臨床意義的選擇 87%的nOH患者報告能力下降 42%的人稱nOH讓他們失去了獨立性
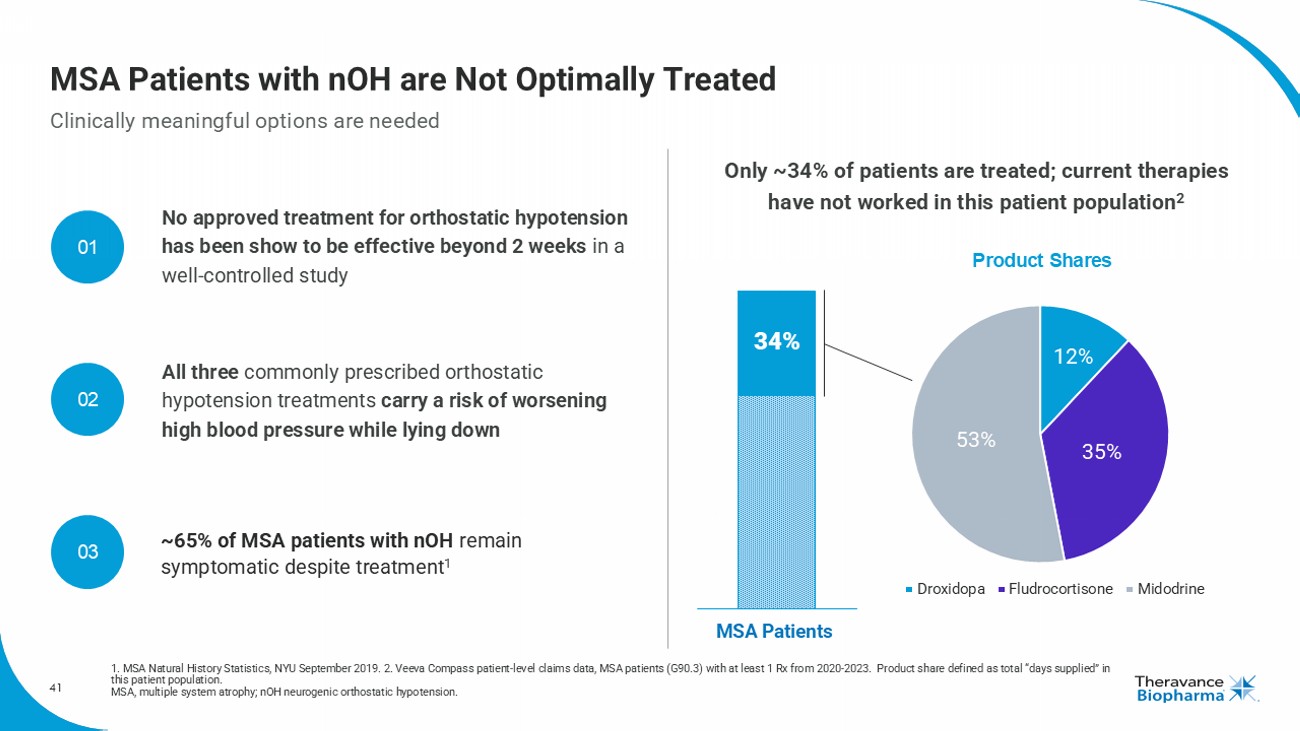
MSA患者中未得到最佳治療 1. MSA自然歷史統計,紐約大學2019年9月。 2. Veeva Compass患者級索賠數據,MSA患者(G90.3)至少從2020年至2023年有1個處方。 產品份額定義爲在該患者人群中的總「供應天數」。 MSA,多系統萎縮症; nOH,神經性直立性低血壓。 只有約34%的患者接受治療;目前的療法在這一患者人群中無效 3種常用的直立性低血壓治療均存在在躺下時加重高血壓的風險 未經證實的治療直立性低血壓表現在臨床研究中並未在2周後顯示有效性 65%的患有nOH的MSA患者即使接受治療仍然有症狀 12% 35% 53%氫葡萄糖醛醇米多啪 產品份額01 02 03
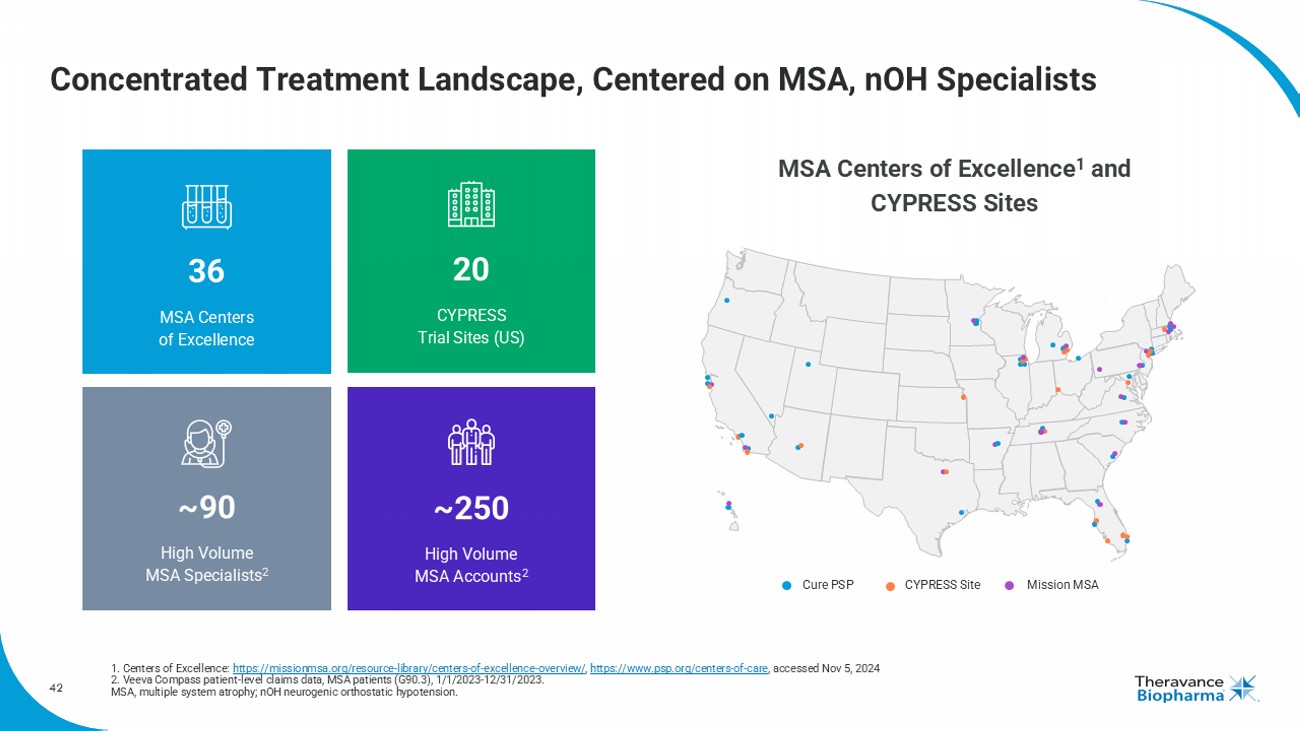
42專注治療景觀,以MSA爲中心,nOH專家 1. 卓越中心: https://missionmsa.org/resource-library/centers-of-excellence-overview/, https://www.psp.org/centers-of-care,於2024年11月5日訪問 2. Veeva Compass患者級索賠數據,MSA患者(G90.3),2023年1月1日至2023年12月31日。 MSA,多系統萎縮; nOH,神經性直立性低血壓。 36 MSA卓越中心20 CYPRESS試驗點(美國)~250高通量MSA帳戶2 ~90高通量MSA專家2 MSA卓越中心1和CYPRESS站點42 Cure PSP CYPRESS站點Mission MSA
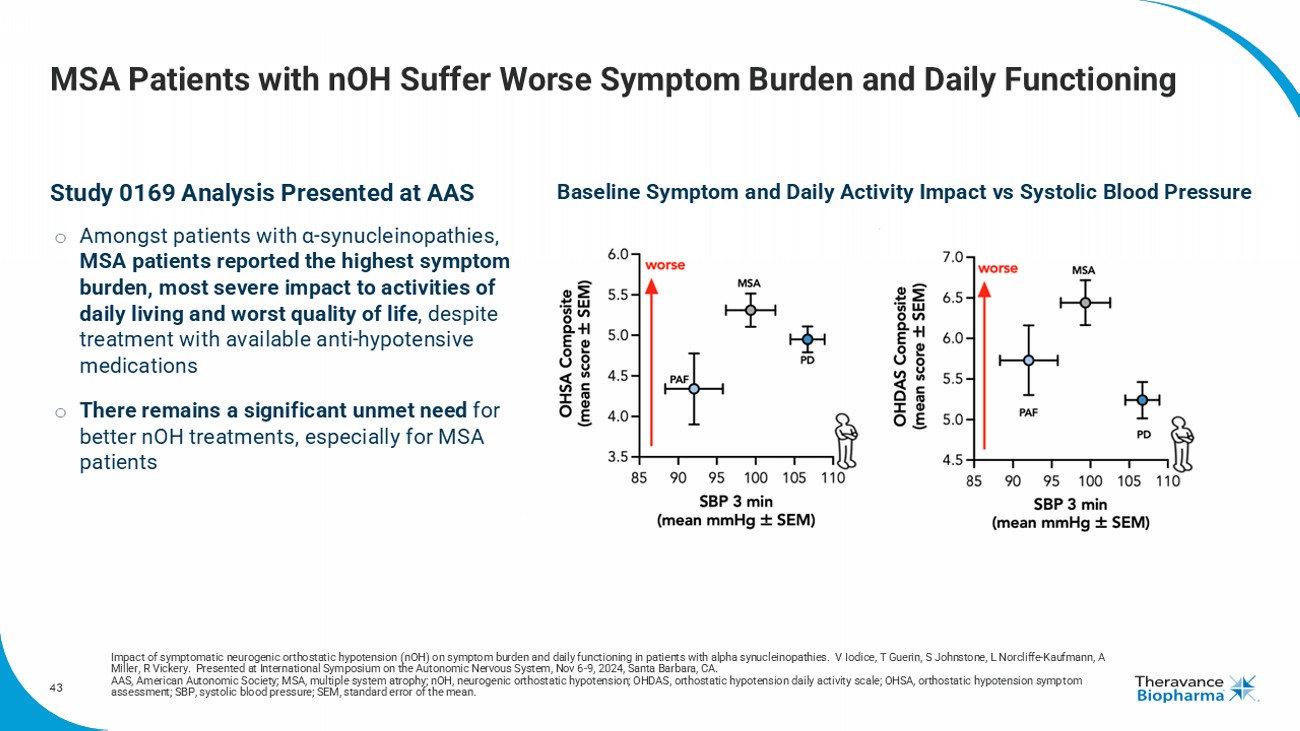
43名nOH患者的MSA患者症狀負擔更嚴重,日常功能受影響神經性直立性低血壓(nOH)對α-突觸蛋白病患者的症狀負擔和日常功能影響 V Iodice 萬億Guerin,S Johnstone,L Norcliffe-Kaufmann,A Miller,R Vickery。在2024年11月6日至9日在加利福尼亞聖巴巴拉舉行的國際自主神經系統研討會上發表。 AAS,美國自主神經系統學會; MSA,多系統萎縮; nOH,神經性直立性低血壓; OHDAS,直立性低血壓日常活動評分表; OHSA,直立性低血壓症狀評估; SBP,收縮壓; SEm,均值的標準誤差。 研究0169分析 在α-突觸蛋白病患者中,MSA患者報告了最高的症狀負擔,對日常生活活動影響最嚴重,生活質量最差,儘管接受了現有的抗低血壓藥物治療 仍然存在明顯的未滿足需求,特別是對於MSA患者 基線症狀和日常活動影響與收縮壓

附錄三:公司/其他

45項專利保護延長至2030年代末COPD,慢性阻塞性肺疾病; nOH,神經性直立性低血壓; PTE,專利期延長。 估計專利到期日發明化合物2028物質組成YUPELRI® /revefenacin 2030 - 2031晶型2039治療COPD患者維持的方法2030(加上最長5年的PTE)物質組成Ampreloxetine 2037治療nOH的方法