美國
證券交易委員會
華盛頓特區 20549
表格 8-K
當前 報告
根據第13條或15(d)條
證券交易法1934年第
報告日期(最早報告的事件日期):2024年10月15日
ATLANTIC COASTAL ACQUISITION CORP. II
(根據其章程規定的發行人的確切名稱)
| 特拉華州 | 001-41224 | 87-1013956 | ||
| (註冊地或其他司法管轄區) (委員會文件號碼) |
(委員會 文件號) |
(IRS僱主 唯一識別號碼) |
| 聖約翰街6號,5樓 關於Veeva Systems |
10013 | |
| ,(主要行政辦公地址) | (郵政編碼) |
(248) 890-7200
(如果自上次報告以來有變化,則填上其曾用名或舊地址)
無
(曾用名或 地址信息,如果自上次報告以來有所更改)
請勾選以下適當的框,如果此 文件是打算同時滿足註冊人根據以下任何規定的申報義務(參見下面的常規說明A.2。) 表格8-K 如果申報打算同時滿足註冊人根據以下規定的任何義務,請參見一般指示A.2。
| ☒ | 根據證券法規第425條規定的書面通信(17 CFR 230.425) |
| ☐ | 依據交易所法案規則14a-12徵集材料14a-12 交易所法案下(17 CFR 240.14a-12) |
| ☐ | 預開始通信事項依據規則240.13e-4(c)進行通信事項交易所法案14d-2(b)交易所法案240.13e-4(c))交易所法案240.14d-2(b)) |
| ☐ | 預開始通信事項依據規則240.13e-4(c)進行通信事項依據交易所法240.13e-4(c)進行通信事項交易所法案240.13e-4(c))240-13e-4(c)) |
根據證券法案第12(b)條款登記的證券:
| 每種類別的證券 |
交易 符號: |
每個註冊的交易所的名稱 紐約證券交易所 | ||
| 單位,每單位包括一股A系列普通股,面值爲$0.0001,以及 一半一份可贖回權證 | ACABU | 納斯達克證券交易所 LLC | ||
| 作爲單位的一部分包括A系列普通股的股份 | ACAB | 納斯達克證券交易所 LLC | ||
| warrants包含在單位中,每個完整的權證可行權購買一股 A系列普通股,行使價格爲$11.50 | ACABW | 納斯達克證券交易所 LLC |
請通過勾選表明公司是否符合1933年證券法 第405條規定的新興成長公司,或1934年證券交易法 第12b-2條規定的新興成長公司。
新興成長公司
如果是 新興成長公司,請通過勾選表明是否公司選擇不使用根據交易所 法第13(a)條提供的適用於遵守任何新的或修訂的財務會計準則而提供的延長過渡期。 ☐
| 項目7.01。 | 監管FD披露。 |
2024年10月9日,大西洋沿岸收購公司II(corp)向證券交易委員會提交了一份有關先前宣佈的與Abpro Corporation(corp)擬議業務合併的Form註冊聲明的修正案。ACAB”) filed an amendment to its Registration Statement on Form S-4 證券交易委員會(Exchange)SEC)公司美國2026年票據業務組合”).
作爲附件99.1附上並通過引用納入本項目7.01的是ACAb和公司爲與業務組合有關的使用準備的修訂後的投資者展示。這是根據項目7.01提供的,並不會被視爲根據《1934年交易法》第18條的目的而文件。使擁有公司註冊證券類別10%以上股權的官員、董事或實際股東代表簽署人遞交表格3、4和5(包括修正版及有關聯合遞交協議),符合證券交易法案第16(a)條及其下屬規則規定的要求;”), or otherwise be subject to the liabilities of that section, nor will it be deemed to be incorporated by reference in any filing under the Securities Act of 1933 (the “證券法”) or the Exchange Act.
重要信息及查找位置。
有關業務合併及其擬議交易(「擬議交易」的連接,ACAb已向SEC提交了一份Form S-4修訂後的註冊聲明(「註冊聲明」),其中包括擬議交易的相關ACAB普通股持有人分發給ACAB股東的代理聲明,用於ACAB就擬議交易和註冊聲明中描述的其他事項請求股東代理投票,並與擬議交易相關發行給股東的證券的招股說明書。註冊聲明生效後,ACAb將向其股東寄送最終的代理聲明/招股說明書,一旦可用,投資者、安全持有人和其他利益相關方應在這些文件可獲取時仔細閱讀該代理聲明/招股說明書,任何修訂以及向SEC提交的任何其他文件,因爲這將包含有關ACAb、公司和擬議交易的重要信息。一旦可用,投資者和安全持有人可以通過SEC在http://www.sec.gov維護的網站,或通過向地址:Atlantic Coastal Acquisition Corp. II, 6 St Johns Lane, Floor 5 New York, NY 10013發出請求,免費獲取ACAb提交給SEC的最終代理聲明/招股說明書和其他文件。擬議交易ACAb已提交了一份註冊聲明 修訂後 註冊聲明蘋果公司CEO庫克大規模拋售股票,套現逾3億港元,資金已存入上市公司設立的專項帳戶(「信託帳戶」),以公共股東(定義詳見下文)爲受益人的註冊聲明(FORM S-1)中所規定的一定金額及特定款項。信託帳戶中持有的基金類型(包括資金持有的利息)除支付公司稅費以外,一旦實現以下最早的情況之一即可支取: (i) 完成首次(業務)組合;(ii) 如果公司未能在2025年3月3日之前完成首次(業務)組合,則可以贖回100%的發行股份(如下所述);或 (iii) 股東表決贖回發行股份。 若要批准修訂本Amended and Restated Certificate,必須就修訂對決定最早如下情形之一的公司的義務以在首次業務組合中允許贖回或未在終止日期之前完成首次業務組合即贖回100%的發行股份產生影響或涉及股東權益或首次業務組合前的活動(如第9.7節所述),對修訂進行表決。發售期(「發售期」)所出售單位的組成部分的Common Stock股份的持有人(「發售股份」),不論這些發售股份是在發售期內還是在發售市場上的二級市場中購買,也不論這些持有人是公司的發起人,高管或董事,或上述任何關聯方的子公司,均在此被稱爲「公共股東」。其中包括有關ACAB向其普通股股東分發的代理聲明,以就有關擬議交易的股東表決進行代理徵集等內容,根據註冊聲明的描述,涉及與擬議交易相關的供股證券的招股說明書。註冊聲明生效後,ACAb將通過郵件向其股東寄送最終的代理聲明/招股說明書,一旦可獲得,投資者和安全持有者以及其他感興趣的各方均應仔細閱讀代理聲明/招股說明書及任何修訂,以及提交給SEC的任何其他文件的全部內容,因爲它們將包含有關ACAb、公司和擬議交易的重要信息。一旦可獲得,投資者和安全持有者可以通過SEC網站http://www.sec.gov或向Atlantic Coastal Acquisition Corp. II的地址6 St Johns Lane, Floor 5 New York, NY 10013發送請求免費獲取最終的代理聲明/招股說明書和其他提交給SEC的文件。
招標者
全員皆可 以及該公司及其董事、某些高級管理人員和其他管理人員及僱員可能被視爲就擬議交易徵集委託代表。有關ACAb的董事和高管的信息已在其年度報告中披露 本日天氣良好 本日天氣良好 該財政年度截至2023年12月30日年報以及註冊聲明中關於委託代理徵集的參與者的額外信息。有關委託徵集人員及其直接和間接權益的描述,包括安防-半導體持股或其他方式,已納入註冊聲明和其他與擬議交易有關的已提出或將要提出SEC的相關材料中。股東、潛在投資者和其他感興趣的人員在做出任何投票或投資決定之前應仔細閱讀註冊聲明。一旦提供,這些文件可免費從上述來源獲取。
不作出售或邀請
此當前報告分類包含依據聯邦證券法與公司相關的特定前瞻性聲明,包括涉及Notes的初始結算預期(包括時間和來自Notes初始結算的淨收益金額)的聲明。這些前瞻性聲明通常被稱爲「相信」、「計劃」、「期望」、「預計」、「估計」、「企圖」、「戰略」、「未來」、「機會」、「計劃」、「可能」、「應」、「將」、「願意」和類似表達方式。前瞻性聲明是基於當前預期和假設的未來事件的預測、預期和其他聲明,因此受到風險和不確定性的影響。許多因素可能導致實際未來事件與前瞻性聲明有所不同,包括但不限於:滿足Notes初始結算的前提條件以及關於公司業務所述風險因素在公司提交給SEC的2024年6月30日季度報告的「風險因素」部分中描述以及公司隨後提交給SEC的其他文件。這些文件確定並解決了其他重要的風險和不確定性,可能使公司的實際事件和結果與此類前瞻性聲明所包含的事件和結果有所不同。 Form 8-K 不得 不構成出售要約或買入證券的邀約,也不得在任何此類邀約、徵求或出售在未在任何此類司法管轄區依據該司法管轄區的證券法的註冊或資格之前就執行。除通過符合《證券法》第10條要求的招股說明書進行外,不得進行證券發行。
前瞻性聲明
此當前報告分類包含依據聯邦證券法與公司相關的特定前瞻性聲明,包括涉及Notes的初始結算預期(包括時間和來自Notes初始結算的淨收益金額)的聲明。這些前瞻性聲明通常被稱爲「相信」、「計劃」、「期望」、「預計」、「估計」、「企圖」、「戰略」、「未來」、「機會」、「計劃」、「可能」、「應」、「將」、「願意」和類似表達方式。前瞻性聲明是基於當前預期和假設的未來事件的預測、預期和其他聲明,因此受到風險和不確定性的影響。許多因素可能導致實際未來事件與前瞻性聲明有所不同,包括但不限於:滿足Notes初始結算的前提條件以及關於公司業務所述風險因素在公司提交給SEC的2024年6月30日季度報告的「風險因素」部分中描述以及公司隨後提交給SEC的其他文件。這些文件確定並解決了其他重要的風險和不確定性,可能使公司的實際事件和結果與此類前瞻性聲明所包含的事件和結果有所不同。 表格8-K包括 某些聲明並非歷史事實,而是根據1995年美國《私人證券訴訟改革法》安全港條款的前瞻性聲明。前瞻性聲明通常伴隨着諸如「相信」、「預計」、「期待」、「預測」、「估計」、「打算」、「策略」、「未來」、「機會」、「計劃」、「可能」、「應該」、「將會」、「將會繼續」、「很可能會導致」或類似表達。這些詞語預測或指示未來事件或趨勢,或者不涉及歷史事項的聲明。這些前瞻性聲明包括但不限於關於營業收入、其他財務和績效指標的估計和預測,以及市場機會和預期的投影,ACAB公司與該公司達成明確協議或完成與該公司的交易的能力;ACAB公司取得必要的融資來完成擬議的交易的能力;以及擬議交易完成的預期時間。這些聲明是基於各種假設以及ACAB公司和該公司管理層的當前期望,不是對實際業績的預測。這些前瞻性聲明僅供說明目的,並不應視爲任何投資者的擔保、保證、預測或確定的事實或概率倉想。實際事件和情況很難或不可能預測,並且將與假設有所不同。 許多實際事件和情況不在ACA和該公司的控制之下。這些前瞻性聲明受到許多風險和不確定因素的影響,包括一般經濟、金融、法律、政治和業務狀況以及國內外市場的變化;該公司是或可能成爲訴訟一方的司法程序結果;各方無法達成最終協議或及時成功完成擬議交易或滿足擬議交集結束的其他條件,包括任何要求的監管批准獲得、被延遲或受到意外情況影響的風險,這可能對合並公司產生不利影響;ACAB的股東未獲得擬議交易的批准的風險;未能實現擬議交易的預期收益,包括因延遲完成擬議交易,或難以或與整合ACAB和該公司業務相關的費用有困難而產生的;ACAB公司股東提出的贖回請求金額;可能產生可能導致ACA和/the公司終止業務合併協議權利的事件風險;與公司業務推出以及預期業務里程碑的時間相關的風險;競爭對該公司未來業務的影響;以及ACAB公司註冊聲明中討論的因素。 提交S-1表格 於2022年1月18日向美國證券交易委員會提交的年度報告 本日天氣良好 本日天氣良好 截至2023年12月31日的財年季度報告 10-Q 截至2024年3月31日和6月30日的季度報告以及ACAb提交或將提交給SEC的《註冊聲明》下面的「風險因素」和其他文檔。 如果風險成爲現實或假設被證明不正確,實際結果可能會與這些前瞻性聲明所暗示的結果大相徑庭。 目前ACAb和公司尚不知曉或ACAb和公司目前認爲不重要的其他風險可能也會導致實際結果與前瞻性聲明中的結果不符。此外,前瞻性聲明反映了ACAb和公司對未來事件的期望、計劃或預測,截至本《Form 8-k》的日期。ACAb和公司預計隨後的事件和發展將導致他們的評估發生變化。但是,儘管ACAb和公司可能選擇在未來某個時點更新這些前瞻性聲明,但ACAb和公司明確聲明不承擔這種義務。 不應依賴這些前瞻性聲明,以代表ACAb或公司截至本《Form 8-k》的日期後的任何日期的評估。 提交Form 8-k表格的ACAb 和公司預期隨後的事件和進展將導致他們的評估發生變化。然而,儘管ACAb和公司可能選擇在未來某個時點更新這些前瞻性聲明,ACAb和公司明確聲明沒有義務這樣做。 不應依賴這些前瞻性聲明,以代表ACAb或公司在本Current Report on Form 8-k之後的任何日期的評估。 因此 不應過度依賴前瞻性聲明。 ACAb和公司均不保證ACAb或公司,或合併後的公司將實現其目標。
| 財務報表和展品。 | (d)展覽品。 |
(d)展品
| 展示文件 |
Description | |
| 99.1 | 投資者介紹形式 | |
| 104 | 封面交互數據文件(嵌入在Inline XBRL文檔中)。 | |
簽名
根據《1934年證券交易法》的要求,經註冊人已通過其代表證書籤署此報告,並經授權簽署該報告。
| 大西洋沿岸收購公司II | ||
| 由: | /s/ Shahraab Ahmad | |
| 姓名: | Shahraab Ahmad | |
| 職稱: | 首席執行官 | |
日期:2024年10月15日

99.1企業展示2024年10月1日

免責聲明 本演示文稿(本「演示文稿」)僅供信息目的提供,並已準備好幫助感興趣的各方就Abpro公司(「Abpro」)和大西洋沿岸收購corp.II(「ACAB」)之間的潛在業務組合以及相關交易(「擬議業務組合」)進行自己的評估,而不用於其他目的。本演示文稿中未作出任何明示或暗示的陳述或保證。在法律許可的最大程度上,Abpro、ACAb或其各自的附屬公司、股東、關聯公司、代表、合作伙伴、董事、官員、僱員、顧問或代理商在任何情況下均不承擔對於使用本演示文稿、其內容、遺漏、對其中包含的信息或相關信息所傳達的意見的依賴或與之有關或在該等情況下產生的直接或間接的或間接的損失或利潤損失的責任。本演示文稿並非標榜爲全面涵蓋性文稿,也不包含可能需要作出對Abpro或擬議業務組合進行全面分析所需的所有信息。查看本演示文稿的人士應各自對Abpro及其中包含的信息的相關性和充分性進行評估,並進行認爲必要的其他調查。前瞻性聲明 本演示文稿包含與擬議業務組合相關的某些前瞻性聲明,包括關於擬議業務組合的益處,擬議業務組合的預期時間安排,Abpro提供的產品和服務以及其經營的市場以及Abpro預期的未來結果的聲明。這些前瞻性聲明通常由「相信」、「項目」、「期望」、「預期」、「估計」、「打算」、「策略」、「未來」、「機會」、「計劃」、「可能」、「應該」、「將」、「將會」、「將繼續」、「很可能會導致」的詞語和類似表達進行確定。前瞻性聲明是基於當前預期和假設的有關未來事件的預測、預測和其他聲明,因此,受到風險和不確定性的影響。許多因素可能導致實際未來事件與本演示文稿中的前瞻性聲明有實質性不同,但不限於:(i)擬議業務組合可能無法及時或根本無法完成,這可能對ACAB的證券價格產生不利影響;(ii)擬議業務組合可能未能在ACAB的業務組合截止日期完成,如ACAB尋求,可能未能獲得業務組合截止日期的延期;(iii)未能滿足完成擬議業務組合的條件,包括獲得ACAB和Abpro股東的必要批准,ACAB公衆股東贖回後的最低信託帳戶金額的滿足以及接受某些政府和監管批准;(iv)在決定是否追求擬議業務組合時缺乏第三方評估;(v)可能發生可能導致協議和合並計劃終止的任何事件變化或其他情況;(vi)擬議業務組合的公告或掛牌對Abpro的業務關係、績效和業務總體產生的風險;(vii)擬議業務組合對Abpro當前計劃的中斷風險以及由於擬議業務組合導致的Abpro員工流失可能導致的潛在困難;(viii)可能提起針對Abpro或針對ACAb與合併計劃協議或擬議業務組合相關的任何法律訴訟的結果;(ix)ACAB證券能否在納斯達克證券交易所上市;(x)ACAB證券價格可能因多種因素(包括Abpro計劃運營的競爭和受監管行業的變化、競爭對手績效變化、影響Abpro業務的法律和法規變化以及合併資本結構變化)而波動;(xi)完成擬議業務組合後能否實施商業計劃、預測和其他期望,以及確定和實現額外機會;(xii)Abpro知識產權(包括版權、專利、商標和商業祕密)的可執行性以及對他人知識產權可能構成侵權的潛在風險;(xiii)與實現盈利能力和現金生成有關的風險;(xiv)與擬議業務組合相關的費用以及未能實現擬議業務組合預期收益或實現預估的經形結果和基礎假設,包括預計股東贖回;(xv)可能無法有效管理增長的風險;(xvi)Abpro對高級管理層和其他關鍵員工的依賴;(xvii)與一般經濟條件有關的風險,包括需求、利率、通貨膨脹、供應鏈和烏克蘭和中東衝突的影響;(xviii)對ACAB或Abpro信息技術系統發起網絡攻擊的風險;(xix)能否吸引並留住具備所需技能和專業知識的員工;(xx)勞動力和研發成本的增加;(xxi)自然災害、不利氣候條件或公共衛生危機的影響;重要地區有較大的Abpro經營集中風險的地緣政治、經濟和氣候或氣候相關風險;(xxii)無法成功將Abpro產品推向市場(包括獲得監管批准);(xxiii)任何終止Abpro現有協議開發其產品;(xxiv)其他人的行爲或不作爲對Abpro聲譽造成損害;調查活動或法律訴訟。上述風險列表並不詳盡。您應仔細考慮前述因素以及ACAB於2021年12月2日(經修訂後)提交的S-1表格中「風險因素」部分、ACAB截至2023年12月31日的10-k年度報告,ACAB截至2024年3月31日和2024年6月30日的10-Q季度報告,註冊聲明(如定義所述)以及包含在其中的代理聲明/招股說明書和ACAb不時向美國證券交易委員會(「SEC」)提交的其他文件。這些文件確定並解決了可能導致實際事件和結果與前瞻性聲明不同的其他重要風險和不確定性。前瞻性聲明僅在發表時有效。讀者應警惕不要過度依賴前瞻性聲明,Abpro和ACAb不承諾並無意更新或修訂這些前瞻性聲明,無論是由於新信息、將來事件還是其他原因。Abpro和ACAb均不提供任何保證,也不承諾Abpro或ACAb分別將實現其期望。

關於Abpro和ACAb之間擬議的業務合併的補充信息及相關信息,請使用Form S-4提交的註冊聲明考慮到擬議的業務合併(「註冊聲明」),其中將包括ACAb的代理聲明/招股說明書。代理聲明/招股說明書將發送給所有ACAb和Abpro股東。ACAb還將與SEC提交關於擬議的業務合併的其他文件。在做出任何投票決定之前,建議ACAb和Abpro的投資者和安全持有人閱讀註冊聲明,其中包含的代理聲明/招股說明書,以及與擬議的業務合併相關的所有其他已提交或即將提交給SEC的文件,因爲這些文件將包含有關擬議的業務合併的重要信息。投資者和安全持有人將能夠通過SEC維護的網站www.sec.gov免費獲取代理聲明/招股說明書和所有其他已提交或即將提交給SEC的相關文件。此外,ACAb提交的文件可通過書面請求免費獲取,ACAb的地址爲紐約州紐約市聖約翰斯大道6號5樓,郵政編碼10013號。參與徵詢ACAb和Abpro及其各自董事和高管可能被視爲是與擬議的業務合併相關聯的ACAB股東代理徵詢的參與方。有關ACAB董事和高管以及他們對ACAB證券的持有情況的信息已在ACAB向SEC提交的文件中披露,包括ACAB於2021年12月2日向SEC提交的S-1表格註冊聲明。至今其所持有的ACAB證券數量自ACAB在S-1表格註冊聲明中註明的金額以來發生變動,這些變動已經或將在向SEC提交的4號表「股權持有變動聲明」中予以反映。當擬議的業務合併的代理聲明/招股說明書可獲得時,通過閱讀有關擬議的業務合併的代理聲明/招股說明書可以獲得有關這些人及其他可能被視爲是擬議的業務合併參與者的利益的更多信息。您可以按照前段落所述免費獲取這些文件。行業和市場數據本演示由Abpro和ACAb準備,包括市場數據及來自Abpro和ACAb認爲可靠的來源的其他統計信息,包括獨立行業出版物、政府出版物或其他發表的獨立來源。一些數據還基於Abpro或ACAb的善意估計,這些估計均來自其對內部來源和上述獨立來源的審查。儘管Abpro和ACAb相信這些來源是可靠的,但Abpro和ACAb未經獨立核實這些信息,不能保證其準確性和完整性。財務信息;非GAAP財務措施本演示中包含的財務信息和數據未經審計,不符合S-X條例。因此,此類信息和數據可能不包含在由ACAb向SEC提交的註冊聲明中,也可能會在擬通過SEC的註冊聲明和其中包含的代理聲明/招股說明書中進行調整或呈現不同。本演示中的某些度量標準不具有美國通行會計準則(「GAAP」)規定的標準化含義,因此被視爲是非GAAP度量標準。這些度量標準可能與其他公司提供的類似度量標準不可比,並且不應被視爲美國GAAP下報告的度量標準的替代。這些度量標準通常由Abpro和ACAb用來爲股東和潛在投資者提供有關Abpro或ACAB流動性及其資金運營能力的額外信息。您應查閱將包含在註冊聲明中的Abpro的審計財務報表。請參閱附錄,獲取相關的非GAAP調節。非要約或招售本演示不構成出售證券的要約或購買證券的招售,亦不得在任何可能構成違法的司法轄區在根據任何此類司法轄區的證券法的要求之前註冊或合格,也不得在在美國1933年證券法要求的招股書形式用於註冊。使用預測本演示包含了關於Abpro和ACAb的預測財務信息。此類預測財務信息構成前瞻性信息,僅供說明目的,並不應被視爲有必然表徵未來結果的依據。這些財務預測信息的假設和估計本身就極不確定,受到各類重大商業、經濟、競爭和其他風險和不確定性的影響。請參見上述「前瞻性聲明」。實際結果可能與本演示中包含的財務預測信息所反映的結果有實質差異,並不應將此類信息包含在本演示中視爲是任何人對這些預測所反映的結果已實現的表示。商標僅僅爲方便起見,商標、商號和服務標記可能出現在本演示中,但任何此類引用均不意味着以任何方式表明我們放棄或不會依照適用法律的規定主張我們或適用許可方對這些商標、商號和服務標記的權利。本演示中出現的所有商標、商號和服務標記均爲各自所有者的財產。

44交易總覽 投資亮點 1 2 管道和科技 經驗豐富的團隊 3 4 平台首選候選人表格 附加管道內容 5 6 候選人計劃發展附錄 7 8 時間表
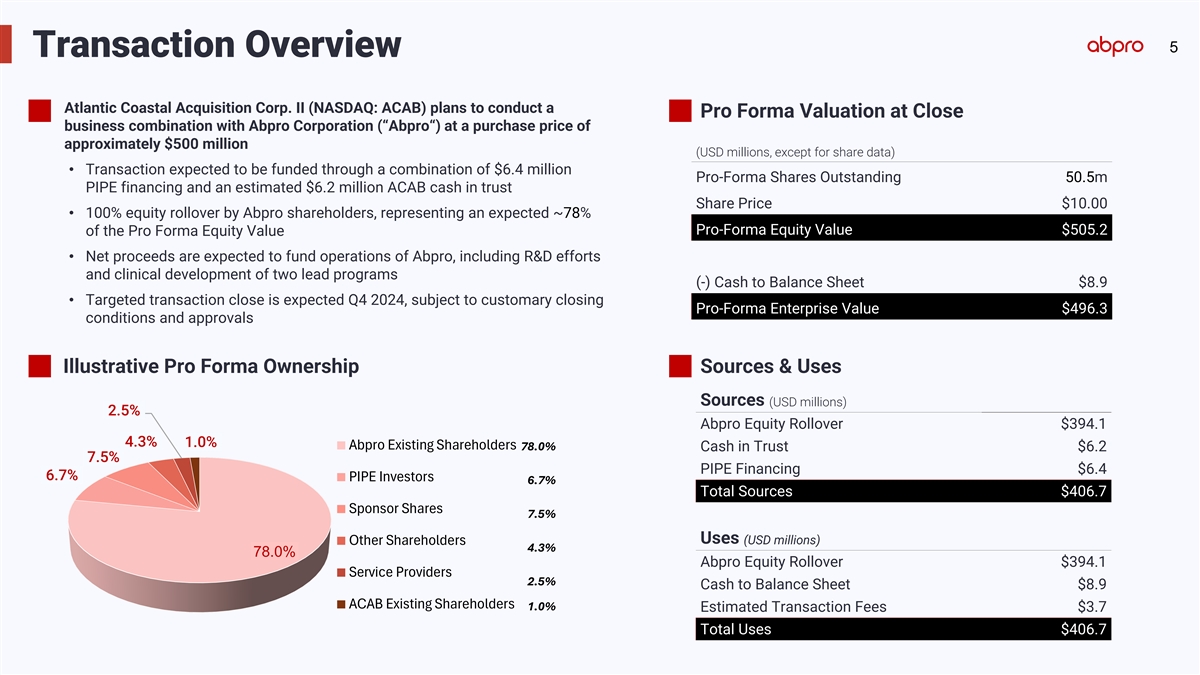
5筆交易概覽 大西洋沿岸收購公司II(納斯達克:ACAB)計劃進行一項收購價格約50000萬美元(美元百萬,除股份數據外)的收益預估價合併業務與Abpro公司(「Abpro」) • 預計交易將通過640萬美元的專項股份,5050萬美元的PIPE融資和預計620萬美元的ACAb信託現金的組合進行資助 股價10.00美元 • Abpro股東將進行100%股權滾動,預計佔比約78%的收益預估價 Pro-Forma 股權價值505.2美元 • 預計淨收益將用於資助Abpro的運營,包括兩項主要項目的研發工作和臨床開發(-) 現金餘額表8.9美元 • 目標交易完成預計爲2024年第4季度,需要符合慣例的收益預估價496.3企業價值的關閉條件和批准 證明性專項佔有權來源及用途來源(美元百萬) 2.3% 2.5% Abpro股權滾動394.1美元 4.3% 1.0% 1.3% 3.6% Abpro現有股東78.0% 信託現金6.2美元 7.1% 7.5% PIPE融資6.4美元 6.7% 7.5% PIPE投資者6.7% 總來源406.7美元 贊助商股份7.5% 用途(美元百萬) 其他股東4.3% 78.1% 78.0% Abpro股權滾動394.1美元 服務提供商2.5% 現金至資產負債表8.9美元 ACAb現有股東1.0% 估計的交易費用3.7美元 總使用406.7美元
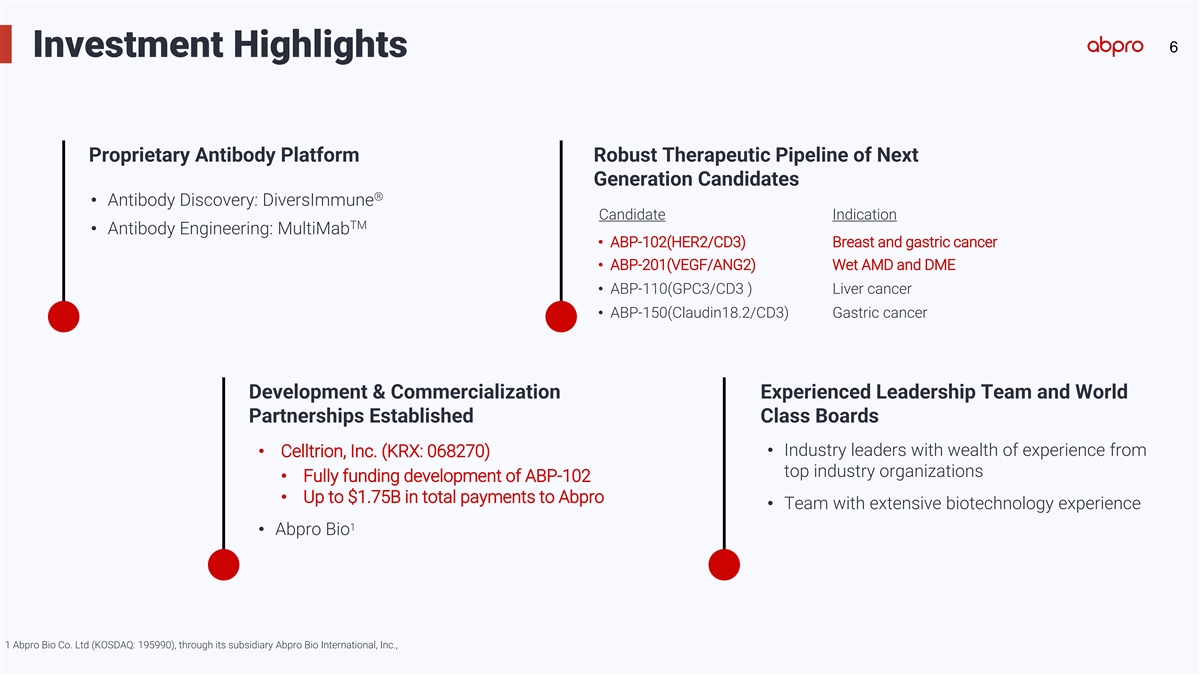
6投資亮點 推出自有抗體平台 強大的治療管道,下一代候選者 ® • 抗體發現: DiversImmune候選療法 預示Tm • 抗體工程: MultiMab • ABP-102(HER2/CD3) 乳腺和胃癌 • ABP-201(VEGF/ANG2) 溼性AMD和DME • ABP-110(GPC3/CD3) 肝癌 • ABP-150(Claudin18.2/CD3) 胃癌 開發與商業化經驗豐富 領導團隊和全球合作 團隊建立了行業領導者與財富 齊聚經驗的領導團隊 來自於 • Celltrion, Inc. (KRX: 068270) 頂尖行業組織 • 全面資助ABP-102的發展 • 向Abpro支付總額高達$17.5億 • 擁有豐富的生物技術經驗的團隊 • Abpro Bio 1 Abpro Bio Co. Ltd (KOSDAQ: 195990),通過其子公司Abpro Bio International, Inc.
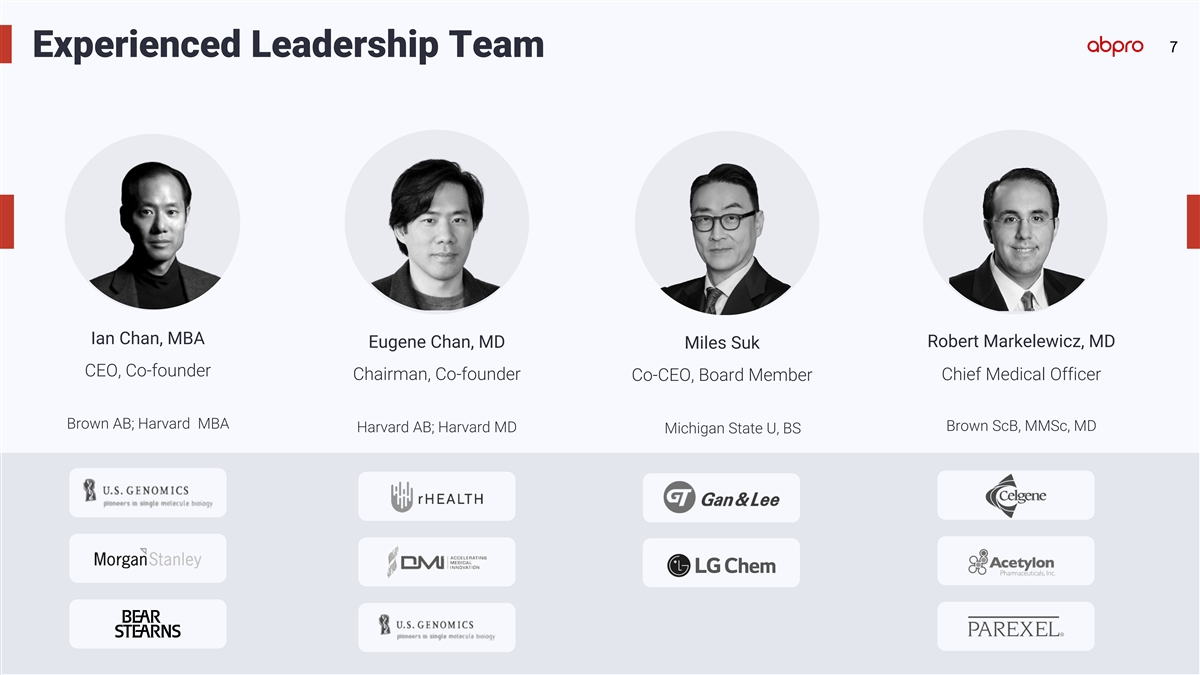
7 位經驗豐富的領導團隊 Ian Chan,MBA Robert Markelewicz,MD Eugene Chan,MD Miles Suk,首席執行官,聯合創始人主席,聯合創始人首席醫療官聯席首席執行官,董事會成員布朗學士;哈佛MBA布朗Scb,MMSc,醫學博士哈佛學士;哈佛醫學博士密歇根州大學,學士

8大西洋沿岸管理團隊Shahraab Ahmad Burt Jordan Jason Chryssicas Tony Eisenberg 總裁 主席,首席執行官,首席財務官,首席戰略官

99位董事會專家 1 2 2 Robert Langer, 博士 Laurie Glimcher, 醫學博士 Ron Levy, 醫學博士 David H. Koch Institute教授,麻省理工學院前總裁和首席執行官,現代na,BIND的創始人,達那-法伯癌症研究所腫瘤科,Momenta,AIR,等等 斯坦福醫學院 2 2 2 George Tsokos, 醫學博士 Shiv Pillai, 博士 Steven Schnittman, 醫學博士,博士 內科學教授,內科學教授,哈佛傳染病專家,貝斯以色列Deaconess 醫學院和馬薩諸塞州 前國立衛生研究院/首席HIV科,醫療中心普通醫院前副總裁 bms系統 1. 董事會成員 2. 科學顧問委員會成員

具有下一代候選人的10條管道 總指示計劃 目標 前臨床階段 啓用 1期 2期 3期 可尋址市場 1 糖尿病性視網膜病變/溼性AMD 抗VEGF/ANG2 ABP-201 104億美元 乳腺、胃 2 抗HER2/CD3 ABP-102 121億美元 癌症 3 肝癌 抗GPC3/CD3 ABP-110 129億美元 4 胃癌 抗CLAUDIN18.2/CD3 ABP-150 131.1億美元 1 預見性和戰略情報,溼性老年性黃斑變性 市場概況,2019年3月。 2 研究和市場,全球HER2+乳腺癌市場將於2030年擴大到121億美元,2021年9月21日。 3 SNS Insider,肝癌治療市場預計到2030年將超過12910.02萬美元,受肝癌發病率上升和早期診斷進展的推動,2023年10月25日。 4 數據橋市場研究,全球胃癌市場-行業趨勢和預測到2029年,2022年9月。

TECHNOLOGY PLATFORM

® 12 12 Diversimmune發現平台特點:• 快速生成創建針對傳統上難以靶點的抗體療法的抗體發現平台力求迅速產生多樣化的抗體全球製藥和研究機構驗證• 靶標種類在早期目標300多個活動中得到驗證既有臨床驗證又有新穎的目標發展• 克服挑戰傳統上難以進入的抗原臨床前結果免疫發表於:• 藥樣特性通過參與尋找確保在GSK SAP澱粉蛋白優化計劃中扮演關鍵角色旨在確保生成的抗體具有助於第2期治療開發的特點• 創造「基石」多樣化旨在提供功能性抗體基礎單元,具有卓越的親和力和特異性,以解決疾病特定挑戰
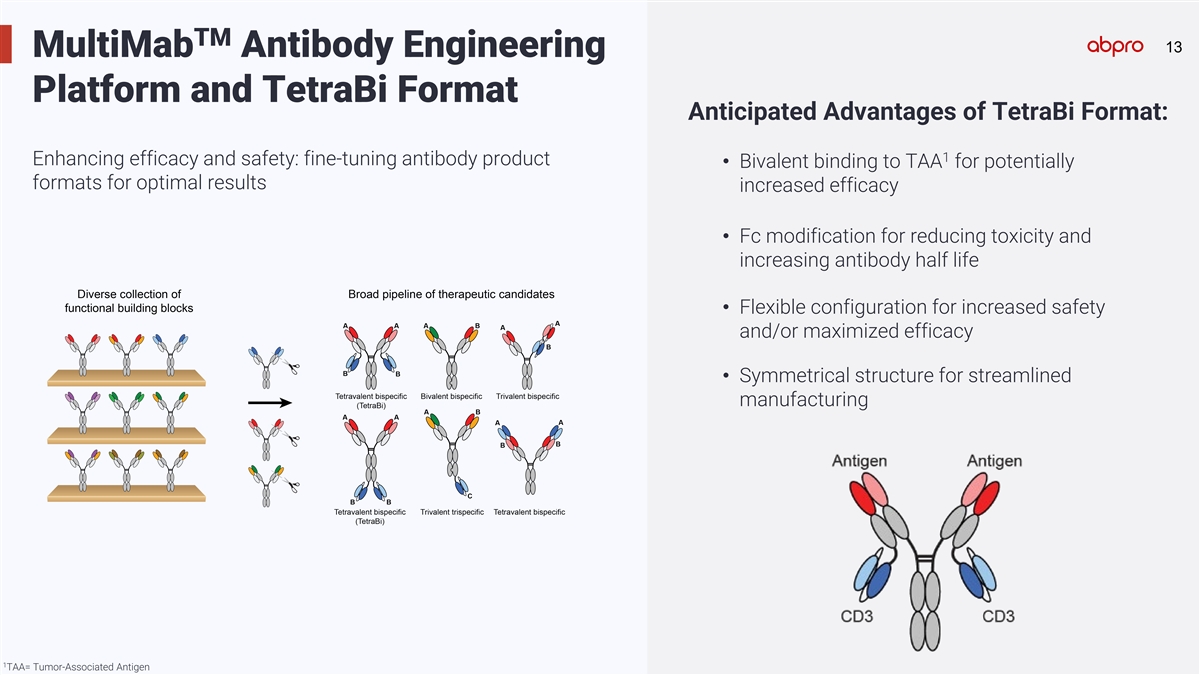
Tm 13 13 MultiMab抗體工程平台和TetraBi格式 TetraBi格式的預期優勢:1. 增強療效和安全性:微調抗體產品 • 雙價結合腫瘤相關抗原(TAA),可能的格式爲了達到最佳效果增加療效 • Fc修飾以減少毒性並增加抗體半衰期 • 靈活的配置以增加安全性和/或最大化療效 • 對稱結構以便進行簡化的製造 1.TAA= 腫瘤相關抗原

主導項目 • ABP-102 • ABP-201

ABP-102 HER2/CD3 T-Cell Engager Treatment for HER2+ Breast Cancer & Gastric Cancer

16 16 ABP-102: Strategic Partnership Global Development & with Celltrion Commercialization Partnership Highlights Leading biopharmaceutical company headquartered in Incheon, South Korea; KRX: 068270 Fully Funded Anticipated Development Plan • Celltrion funds all development costs, including preclinical and • Investigational New Drug (IND) enabling studies underway clinical studies - Preliminary cyno tox study completed • 2H 2025: File IND application and Initiate Phase 1/2 clinical trial $1.75B • Abpro to receive payments up to $1.75B, including equity Indication: investment, Progressive HER2+ Breast and Gastroesophageal Adenocarcinomas development/commercial milestone payments Design: 1 First-In-Human, multicenter, open-label, single-agent, Phase 1/2 trial 50% • Abpro retains a 50% share of profits worldwide 1 The proceeds from commercialization are subject to a 50/50 profit split. Amounts that may be paid by third party collaborators, for example upfronts, milestones and/or royalty payments from territorial commercialization partners, are also subject to a 50/50 split. Following commercial approval of ABP-102, we have agreed to reimburse Celltrion 250% of its direct and certain indirect costs and expenses incurred through first commercial sale. Celltrion is entitled to offset amounts otherwise due to us under the agreement until our share of these costs has been paid back; provided that we are entitled to a minimum 25% of profit from commercial sales and from third party collaborators regardless of the amount of unreimbursed development costs outstanding (and then 50% once the reimbursement has been made in full). In addition, we are entitled to up to over $1.75 billion in development and sales milestones. We are responsible for world-wide patent prosecution, with Celltrion reimbursing 50% of our out-of-pocket costs.

17 Potential benefits of Potential Competitive ABP-102 in immuno- Advantages: Addressing Unmet oncology Needs in HER2+ • Activating T cells to kill tumor cells • Current HER2-directed therapies have Cancers Treatment: demonstrated increased chemical off TetraBi antibody targets HER2 on target toxicity (e.g. TKIs and ADCs) tumor cells and CD3 on T cells ABP-102 Competitive and/or reduced efficacy from drug resistance or limited potency Landscape • Reduce activity on -low or negative requiring combination with HER2 cells for safety chemotherapy (i.e.: mAbs), especially selectively targets HER2-high and in the relapsed and refractory disease intermediate expressing cells population • May improve clinical efficacy • ABP-102 was designed to overcome $12.1 billion by inducing T cell infiltration into these challenges as a single-agent HER2+ tumors, potentially targeting Projected global HER2+ market size by therapy that potently engages the 1 various solid tumors with HER2 2030 patient’s natural immune system overexpression. without toxic chemicals to directly target and destroy the tumor • Enhances binding, selectivity for Development Fully Funded tumor cells, potency, and By collaboration partner Celltrion therapeutic index with Dual HER2 binding sites
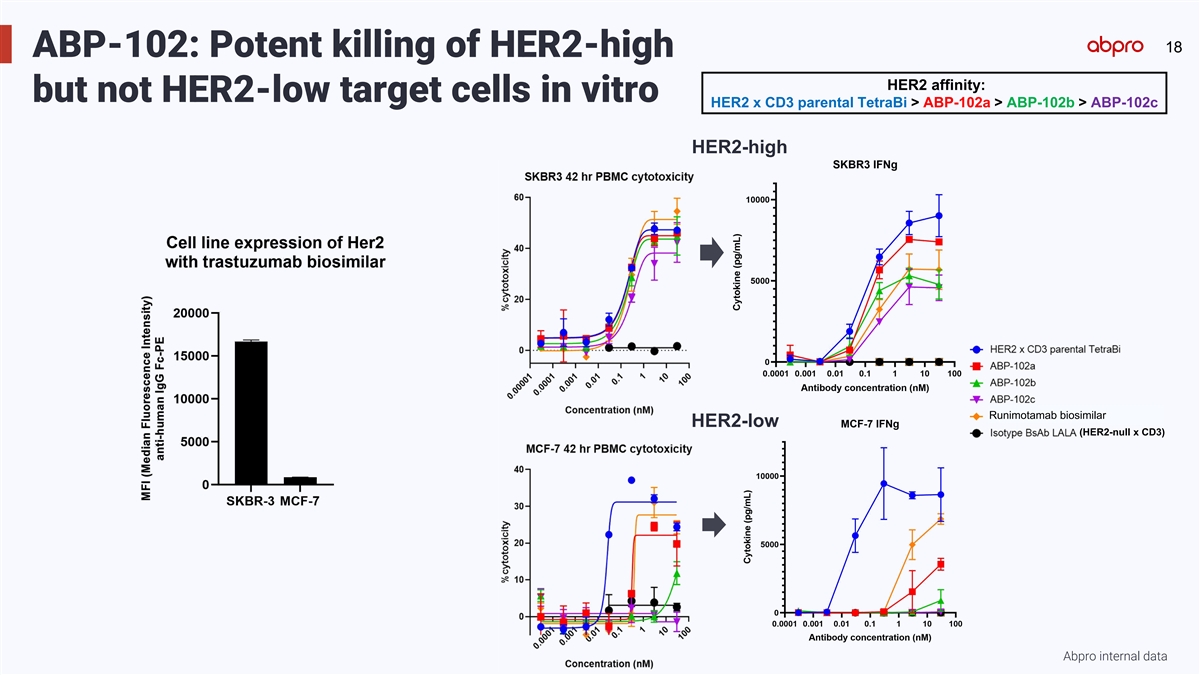
18 18 ABP-102: Potent killing of HER2-high HER2 affinity: but not HER2-low target cells in vitro HER2 x CD3 parental TetraBi > ABP-102a > ABP-102b > ABP-102c HER2-high Runimotamab biosimilar HER2-low (HER2-null x CD3) Abpro internal data

ABP-201 VEGF/ANG-2 BISPECIFIC ANTIBODY Treatment for Diabetic Macular Edema (“DME”) & Wet Age-related Macular Degeneration (”AMD”)

20 20 Addressing Unmet Needs in Wet AMD/DME Treatment: ABP-201 • We believe that ABP-201 will Competitive Landscape require less frequent dosing, providing a significant $10.4 billion advantage in the commercial Global Wet AMD market setting. 1 size projection in 2024 • We anticipate that ABP-201 will not suffer from drug Potential Competitive Advantages: resistance to the same extent as drugs that target VEGF • Unlike Eylea and Lucentis, ABP-201 seeks to inhibit both alone, as increased signaling VEGF and ANG-2 by ANG-2 in response to anti- • Unlike Vabysmo, ABP-201 has two binding sites for VEGF VEGF therapy is one of the and ANG-2, designed to more effectively trap each ligand primary mechanisms of resistance to VEGF inhibitors. • ABP-201 has a longer half-life in the eye than Eylea, which contributes to pharmacological durability 1. Prescient and Strategic Intelligence, Wet Age-Related Macular Degeneration Market Overview, March 2019. 2. Risk-adjusted revenues for ABP-201; Does not account for costs Source: Health Advances model and analysis
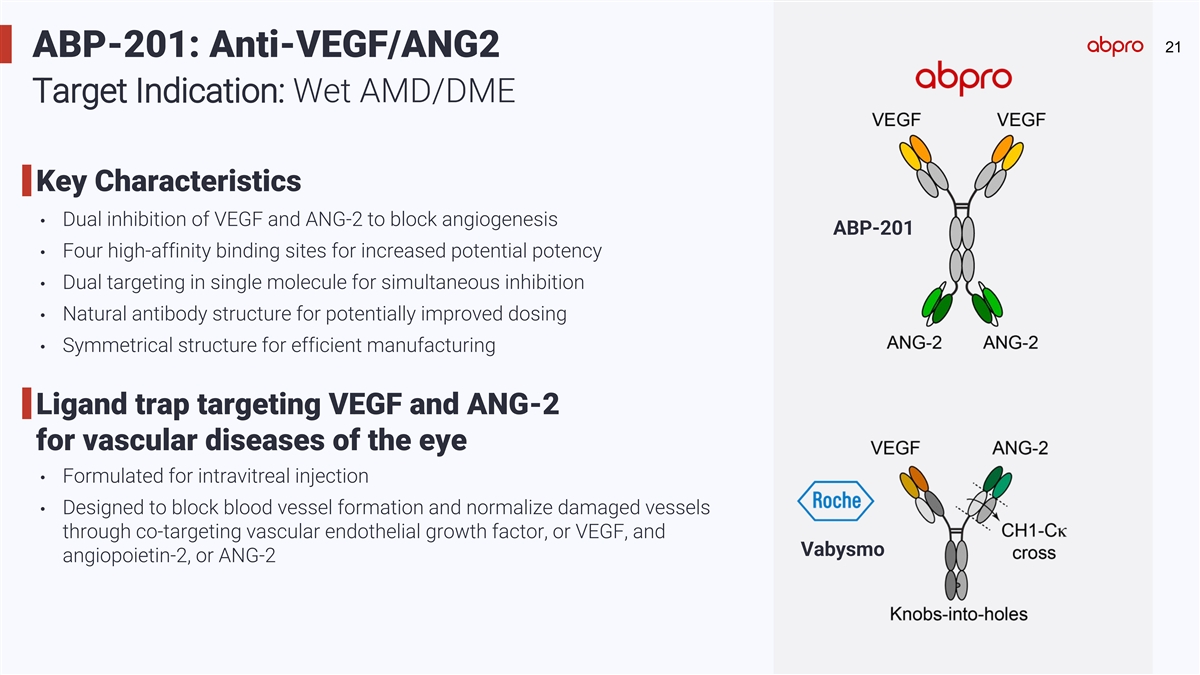
21 ABP-201: Anti-VEGF/ANG2 Target Indication: Wet AMD/DME Key Characteristics • Dual inhibition of VEGF and ANG-2 to block angiogenesis ABP-201 • Four high-affinity binding sites for increased potential potency • Dual targeting in single molecule for simultaneous inhibition • Natural antibody structure for potentially improved dosing • Symmetrical structure for efficient manufacturing Ligand trap targeting VEGF and ANG-2 for vascular diseases of the eye • Formulated for intravitreal injection • Designed to block blood vessel formation and normalize damaged vessels through co-targeting vascular endothelial growth factor, or VEGF, and Vabysmo angiopoietin-2, or ANG-2
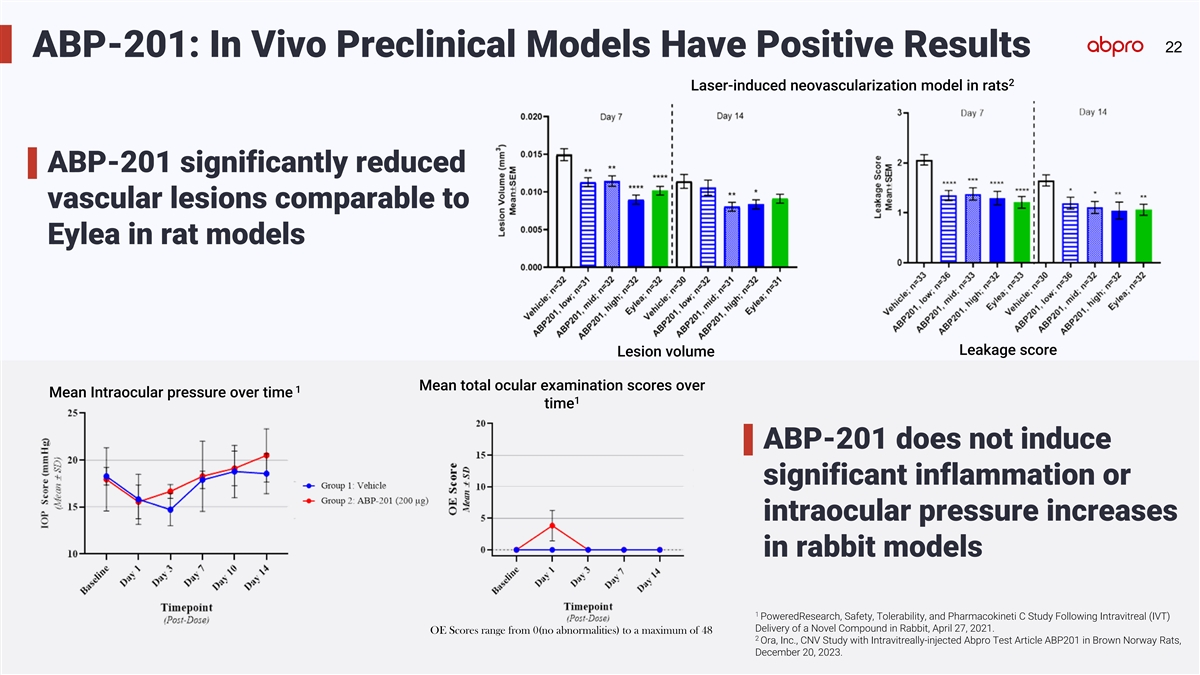
22 ABP-201: In Vivo Preclinical Models Have Positive Results 2 Laser-induced neovascularization model in rats ABP-201 significantly reduced vascular lesions comparable to Eylea in rat models Leakage score Lesion volume Mean total ocular examination scores over 1 Mean Intraocular pressure over time 1 time ABP-201 does not induce significant inflammation or intraocular pressure increases in rabbit models 1 PoweredResearch, Safety, Tolerability, and Pharmacokineti C Study Following Intravitreal (IVT) Delivery of a Novel Compound in Rabbit, April 27, 2021. OE Scores range from 0(no abnormalities) to a maximum of 48 2 Ora, Inc., CNV Study with Intravitreally-injected Abpro Test Article ABP201 in Brown Norway Rats, December 20, 2023.
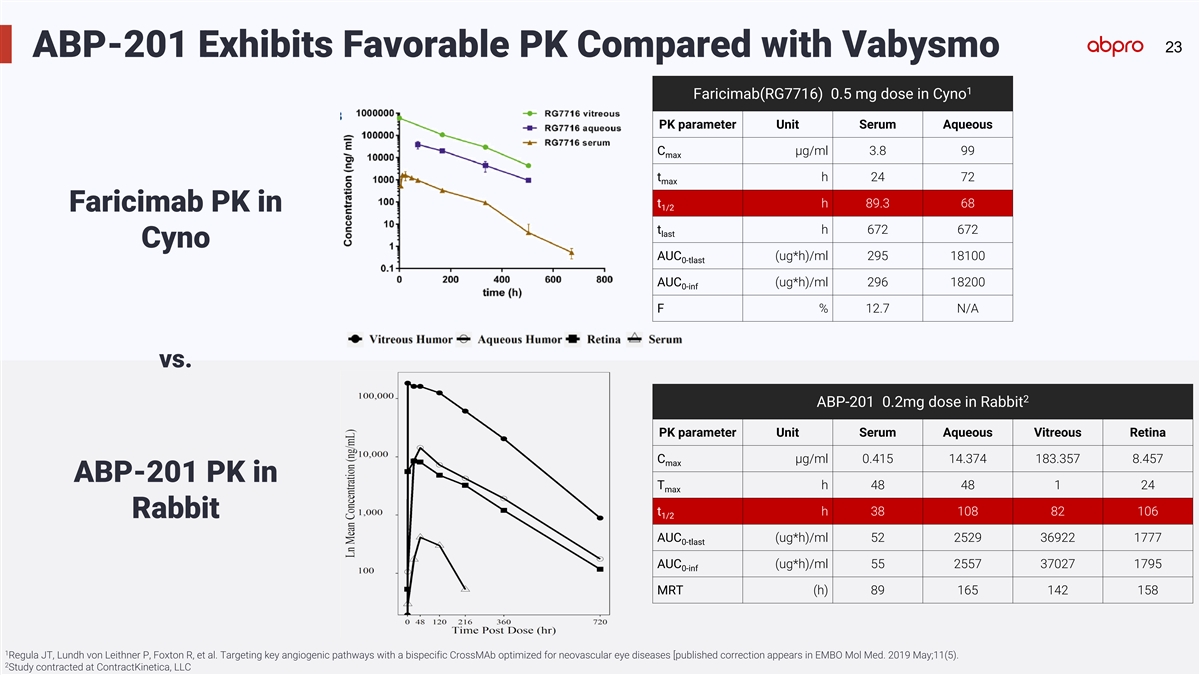
23 ABP-201 Exhibits Favorable PK Compared with Vabysmo 1 Faricimab(RG7716) 0.5 mg dose in Cyno PK parameter Unit Serum Aqueous C µg/ml 3.8 99 max t h 24 72 max t h 89.3 68 1/2 Faricimab PK in t h 672 672 last Cyno AUC (ug*h)/ml 295 18100 0-tlast AUC (ug*h)/ml 296 18200 0-inf F % 12.7 N/A vs. 2 ABP-201 0.2mg dose in Rabbit PK parameter Serum Aqueous Vitreous Retina Unit C µg/ml 0.415 14.374 183.357 8.457 max ABP-201 PK in T h 48 48 1 24 max t h 38 108 82 106 Rabbit 1/2 AUC (ug*h)/ml 52 2529 36922 1777 0-tlast AUC (ug*h)/ml 55 2557 37027 1795 0-inf MRT (h) 89 165 142 158 1 Regula JT, Lundh von Leithner P, Foxton R, et al. Targeting key angiogenic pathways with a bispecific CrossMAb optimized for neovascular eye diseases [published correction appears in EMBO Mol Med. 2019 May;11(5). 2 Study contracted at ContractKinetica, LLC

24 24 Current Status: • Investigation New Drug (IND) enabling studies underway Anticipated Development Plan • Q1 2026: File IND application and Initiate a Phase 1 trial in patients with ABP-201 Wet AMD Development • Following the identification of the Collaboration Highlights: Strategy maximum tolerated dose (MTD) in Phase 1, a larger randomized Phase 2 dose ranging trial to be conducted • Co-development via a territorial 1 partnership with Abpro Bio • Abpro retains U.S. and European Union Five commercial rights 1. Abpro Bio Co. Ltd (KOSDAQ: 195990), through its subsidiary Abpro Bio International, Inc., holds territory rights primarily in Asia and Middle East, and is an equity investor of Abpro Corporation.

ADDITIONAL T-CELL ENGAGERS ABP-150: Anti-Claudin 18.2/ CD3 against Gastric Cancer ABP-110: Anti-GPC3/CD3 against Liver Cancer
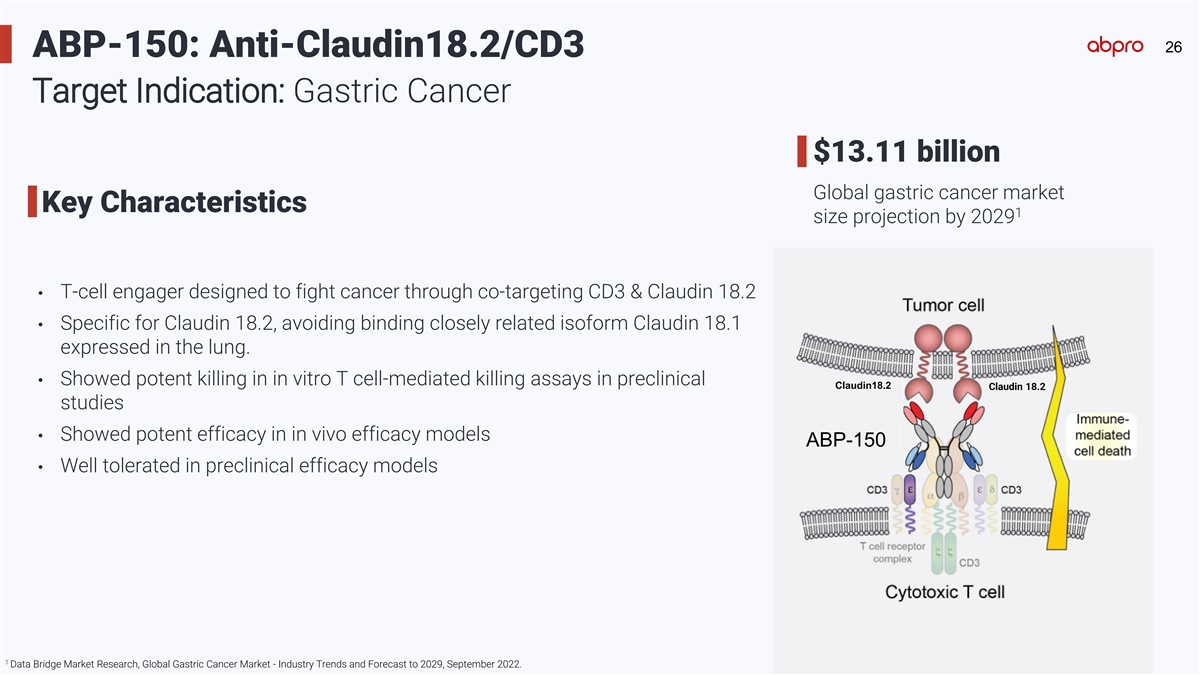
26 ABP-150: Anti-Claudin18.2/CD3 Target Indication: Gastric Cancer $13.11 billion Global gastric cancer market Key Characteristics 1 size projection by 2029 • T-cell engager designed to fight cancer through co-targeting CD3 & Claudin 18.2 • Specific for Claudin 18.2, avoiding binding closely related isoform Claudin 18.1 expressed in the lung. • Showed potent killing in in vitro T cell-mediated killing assays in preclinical Claudin18.2 Claudin 18.2 Claudin 18.2 studies • Showed potent efficacy in in vivo efficacy models ABP-150 • Well tolerated in preclinical efficacy models 1 Data Bridge Market Research, Global Gastric Cancer Market - Industry Trends and Forecast to 2029, September 2022.
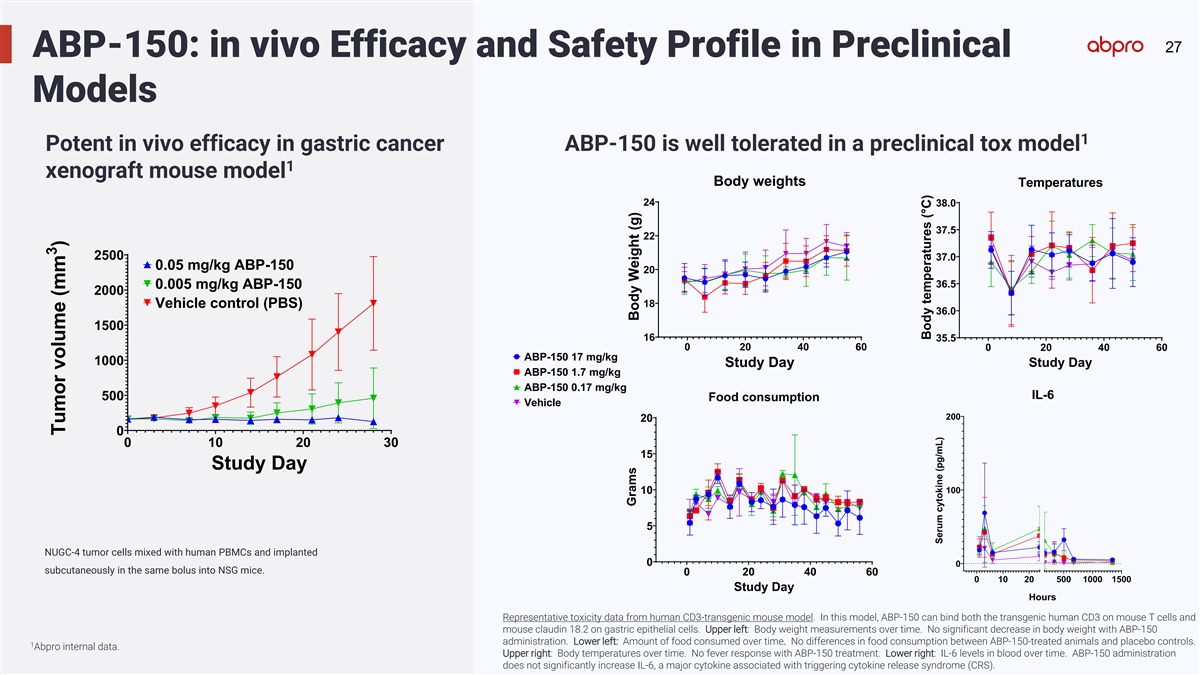
27 ABP-150: in vivo Efficacy and Safety Profile in Preclinical Models 1 Potent in vivo efficacy in gastric cancer ABP-150 is well tolerated in a preclinical tox model 1 xenograft mouse model Body weights Temperatures 24 38.0 ABP ABP 37.5 22 ABP Veh 2500 37.0 0.05 mg/kg ABP-150 20 36.5 0.005 mg/kg ABP-150 2000 18 Vehicle control (PBS) 36.0 1500 16 35.5 0 20 40 60 0 20 40 60 ABP-150 17 mg/kg 1000 Study Day Study Day ABP-150 1.7 mg/kg ABP-150 0.17 mg/kg IL-6 500 Food consumption Vehicle 200 20 ABP-15 0 0 10 20 30 ABP-15 15 ABP-15 Study Day Vehicle 100 10 5 NUGC-4 tumor cells mixed with human PBMCs and implanted 0 0 subcutaneously in the same bolus into NSG mice. 0 20 40 60 0 10 20 500 1000 1500 Study Day Hours Representative toxicity data from human CD3-transgenic mouse model. In this model, ABP-150 can bind both the transgenic human CD3 on mouse T cells and mouse claudin 18.2 on gastric epithelial cells. Upper left: Body weight measurements over time. No significant decrease in body weight with ABP-150 administration. Lower left: Amount of food consumed over time. No differences in food consumption between ABP-150-treated animals and placebo controls. 1 Abpro internal data. Upper right: Body temperatures over time. No fever response with ABP-150 treatment. Lower right: IL-6 levels in blood over time. ABP-150 administration does not significantly increase IL-6, a major cytokine associated with triggering cytokine release syndrome (CRS). 3 Tumor volume (mm ) Grams Body Weight (g) Body temperatures (°C) Serum cytokine (pg/mL)
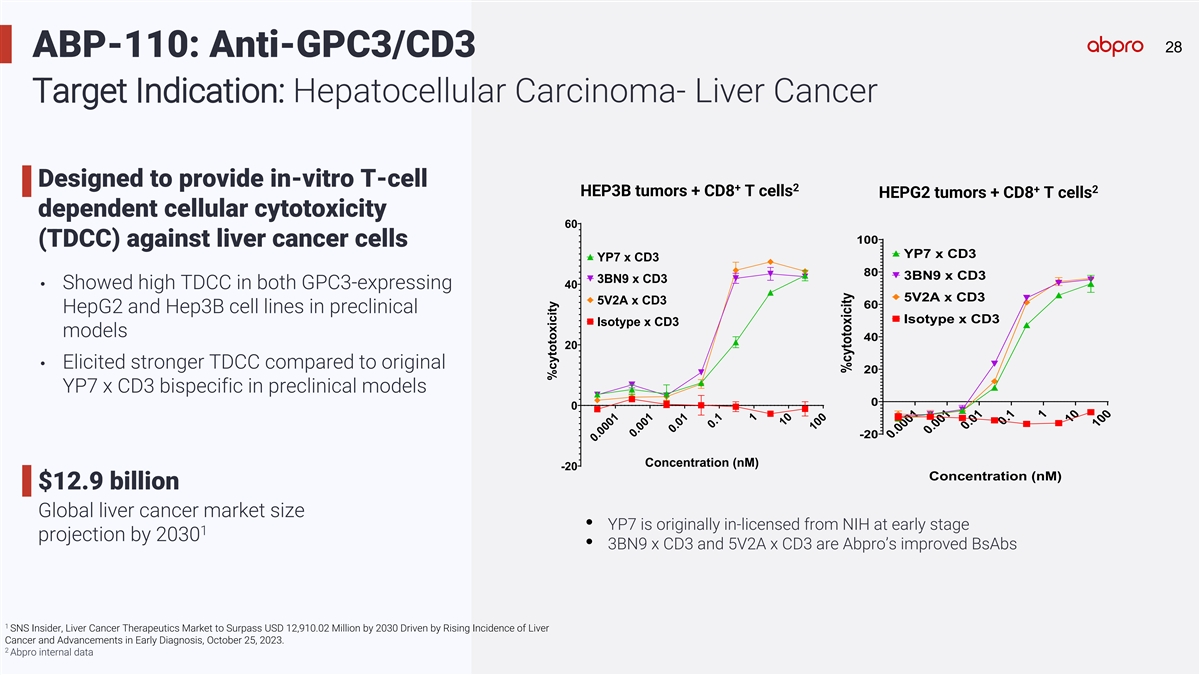
28 28 ABP-110: Anti-GPC3/CD3 Target Indication: Hepatocellular Carcinoma- Liver Cancer Designed to provide in-vitro T-cell + 2 + 2 HEP3B tumors + CD8 T cells HEPG2 tumors + CD8 T cells dependent cellular cytotoxicity 60 100 (TDCC) against liver cancer cells YP7 x CD3 YP7 x CD3 80 3BN9 x CD3 3BN9 x CD3 40 • Showed high TDCC in both GPC3-expressing 5V2A x CD3 5V2A x CD3 60 HepG2 and Hep3B cell lines in preclinical Isotype x CD3 Isotype x CD3 models 40 20 • Elicited stronger TDCC compared to original 20 YP7 x CD3 bispecific in preclinical models 0 0 -20 Concentration (nM) -20 Concentration (nM) $12.9 billion Global liver cancer market size • YP7 is originally in-licensed from NIH at early stage 1 projection by 2030 • 3BN9 x CD3 and 5V2A x CD3 are Abpro’s improved BsAbs 1 SNS Insider, Liver Cancer Therapeutics Market to Surpass USD 12,910.02 Million by 2030 Driven by Rising Incidence of Liver Cancer and Advancements in Early Diagnosis, October 25, 2023. 2 Abpro internal data 0.0001 0.001 0.01 0.1 1 10 100 0.0001 0.001 0.01 0.1 1 10 100 %cytotoxicity %cytotoxicity
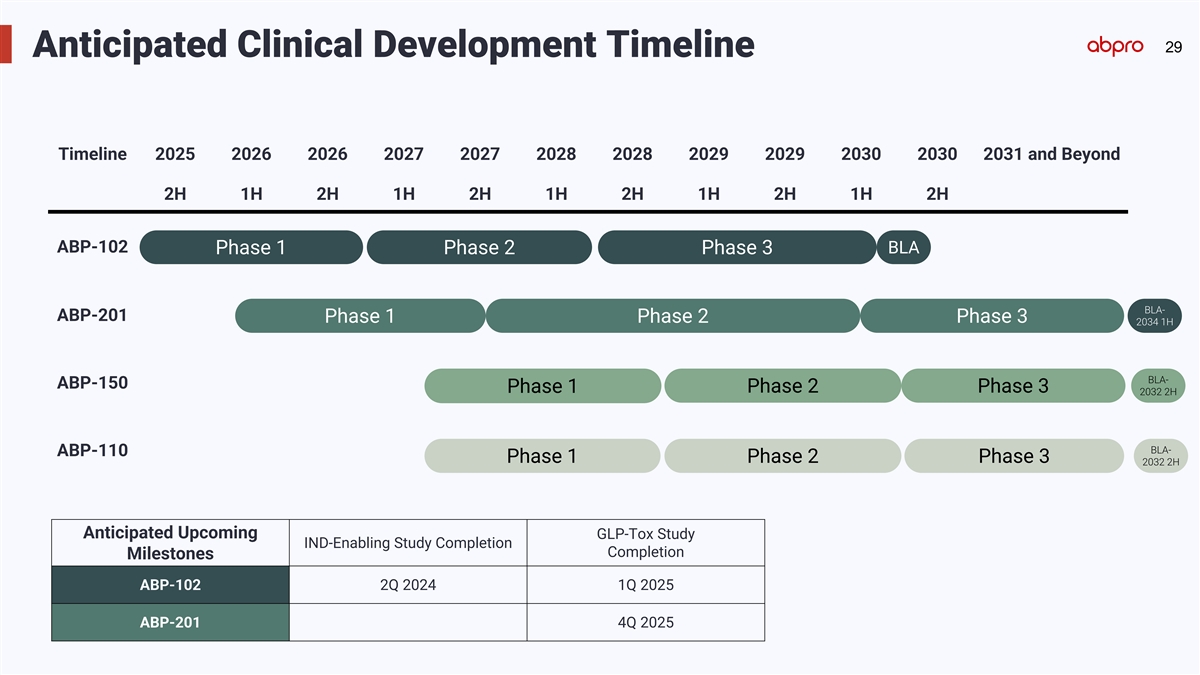
29 Anticipated Clinical Development Timeline Timeline 2025 2026 2026 2027 2027 2028 2028 2029 2029 2030 2030 2031 and Beyond 2H 1H 2H 1H 2H 1H 2H 1H 2H 1H 2H ABP-102 BLA Phase 1 Phase 2 Phase 3 BLA- ABP-201 Phase 1 Phase 2 Phase 3 2034 1H BLA- ABP-150 Phase 1 Phase 2 Phase 3 2032 2H BLA- ABP-110 Phase 1 Phase 2 Phase 3 2032 2H Anticipated Upcoming GLP-Tox Study IND-Enabling Study Completion Completion Milestones ABP-102 2Q 2024 1Q 2025 ABP-201 4Q 2025

• Additional Data for Abpro Technology Platform • Additional Key Team Members Appendix • Additional Data for ABP-102(HER2/CD3) • Additional Data for ABP-201(VEGF/ANG2)

Additional Data for Abpro Technology Platform 31

32 32 Diversimmune Platform Case study: Amyloid*: Preclinical results from functional therapeutic antibodies ® generated with DiversImmune platform, via a project for GSK, 1 published in Nature and The New England Journal of 2 Medicine Abpro generated a therapeutic mAb “Abp1” against Amyloid used by GSK, featuring high affinity and specificity in ways other approaches can not Conformational epitope recognized by Abp1 (highlighted in black) *Amyloid plaques, composed of misfolded proteins, are a hallmark feature in the brains of individuals with Alzheimer's disease, contributing to the neurodegenerative process 1 https://www.nature.com/articles/nature09494 2 https://www.nejm.org/doi/full/10.1056/NEJMoa1504942
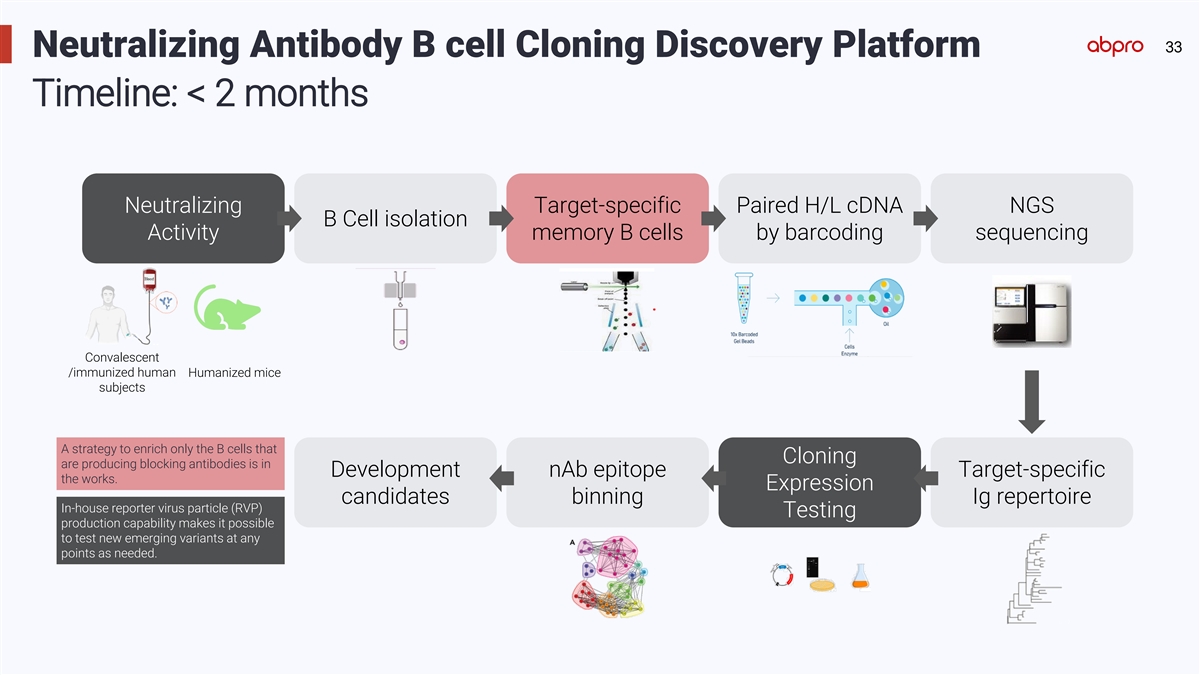
33 Neutralizing Antibody B cell Cloning Discovery Platform Timeline: < 2 months Neutralizing Target-specific Paired H/L cDNA NGS B Cell isolation Activity memory B cells by barcoding sequencing Convalescent /immunized human Humanized mice subjects A strategy to enrich only the B cells that Cloning are producing blocking antibodies is in Development nAb epitope Target-specific the works. Expression candidates binning Ig repertoire In-house reporter virus particle (RVP) Testing production capability makes it possible to test new emerging variants at any points as needed.

34 Anticipated Advantages of TetraBi Format Over First- and Second-Generation T-Cell Engagers nd st 1 Generation 2 Generation Abpro Antibody Bispecific Benefit Bispecific TetraBi Characteristics Stronger binding to the tumor cell, potentially leading Bivalent Binding to to increased efficacy and an expanded patient Tumor Antigen population Long Circulating Extends duration of therapeutic effect and reduces Half-life frequency of dosing Fc engineered to Decreases interaction with other immune cells, reduce CRS lowering risk of unwanted side effects Low Risk of Natural antibody sequences decrease risk of immune Immunogenicity response, which can lead to decreased efficacy Straightforward Symmetrical structure streamlines manufacturing by Manufacturing reducing risk of chain mispairing
Additional Key Team Members 35

36 Additional Key Team Members Mengsha Wang, MBA Askar Kuchumov, PhD Shaun Murphy, PhD Director of Corporate VP of Business VP of Immunology Development Development Clark U MSc. Finance, MBA Lomonosov Moscow State, BS Brown PhD, Wayne State U School of Medicine, PhD Research Harvard Medical School Joined Abpro in 2014 Lactocore (Interim CEO), Astrotide (Co- Joined Abpro in 2014 founder/CEO), Cleveland Biolabs Previously at Toxikon (Director of BD)
Additional Data for ABP-102 HER2/CD3 T-Cell Engager 37
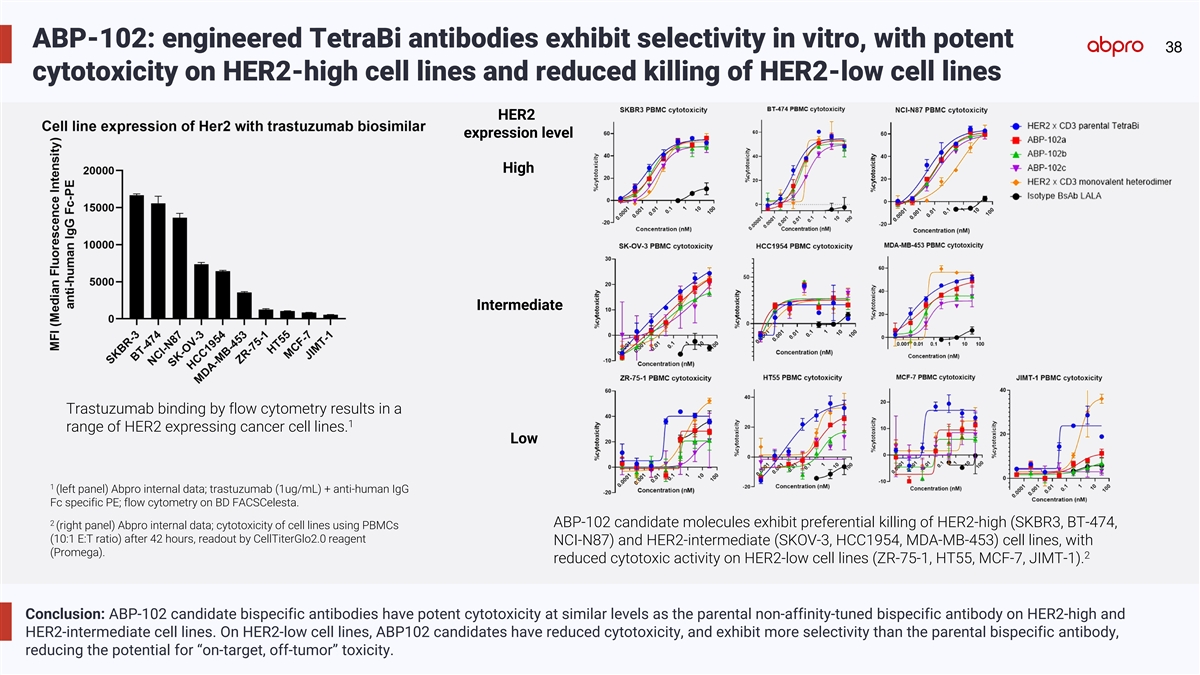
ABP-102: engineered TetraBi antibodies exhibit selectivity in vitro, with potent 38 cytotoxicity on HER2-high cell lines and reduced killing of HER2-low cell lines HER2 expression level High Intermediate Trastuzumab binding by flow cytometry results in a 1 range of HER2 expressing cancer cell lines. Low 1 (left panel) Abpro internal data; trastuzumab (1ug/mL) + anti-human IgG Fc specific PE; flow cytometry on BD FACSCelesta. 2 ABP-102 candidate molecules exhibit preferential killing of HER2-high (SKBR3, BT-474, (right panel) Abpro internal data; cytotoxicity of cell lines using PBMCs (10:1 E:T ratio) after 42 hours, readout by CellTiterGlo2.0 reagent NCI-N87) and HER2-intermediate (SKOV-3, HCC1954, MDA-MB-453) cell lines, with (Promega). 2 reduced cytotoxic activity on HER2-low cell lines (ZR-75-1, HT55, MCF-7, JIMT-1). Conclusion: ABP-102 candidate bispecific antibodies have potent cytotoxicity at similar levels as the parental non-affinity-tuned bispecific antibody on HER2-high and HER2-intermediate cell lines. On HER2-low cell lines, ABP102 candidates have reduced cytotoxicity, and exhibit more selectivity than the parental bispecific antibody, reducing the potential for “on-target, off-tumor” toxicity.
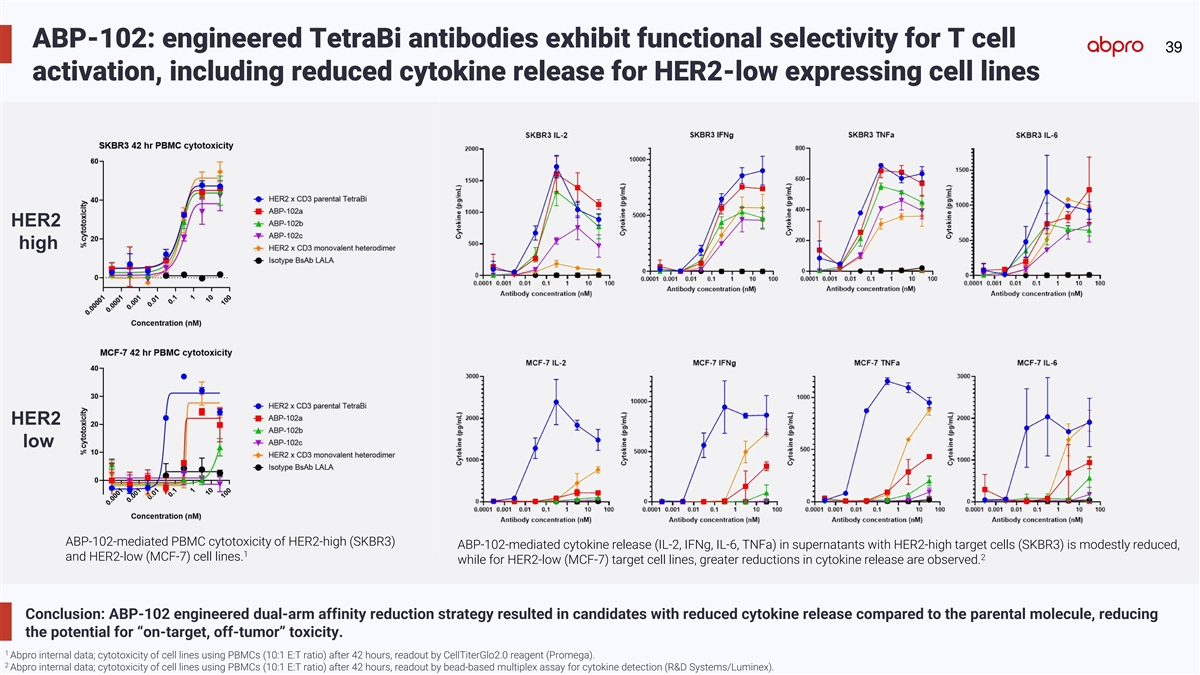
ABP-102: engineered TetraBi antibodies exhibit functional selectivity for T cell 39 activation, including reduced cytokine release for HER2-low expressing cell lines HER2 high HER2 low ABP-102-mediated PBMC cytotoxicity of HER2-high (SKBR3) ABP-102-mediated cytokine release (IL-2, IFNg, IL-6, TNFa) in supernatants with HER2-high target cells (SKBR3) is modestly reduced, 1 2 and HER2-low (MCF-7) cell lines. while for HER2-low (MCF-7) target cell lines, greater reductions in cytokine release are observed. Conclusion: ABP-102 engineered dual-arm affinity reduction strategy resulted in candidates with reduced cytokine release compared to the parental molecule, reducing the potential for “on-target, off-tumor” toxicity. 1 Abpro internal data; cytotoxicity of cell lines using PBMCs (10:1 E:T ratio) after 42 hours, readout by CellTiterGlo2.0 reagent (Promega). 2 Abpro internal data; cytotoxicity of cell lines using PBMCs (10:1 E:T ratio) after 42 hours, readout by bead-based multiplex assay for cytokine detection (R&D Systems/Luminex).
Additional Data for ABP-201 VEGF/ANG-2 BISPECIFIC ANTIBODIES 40
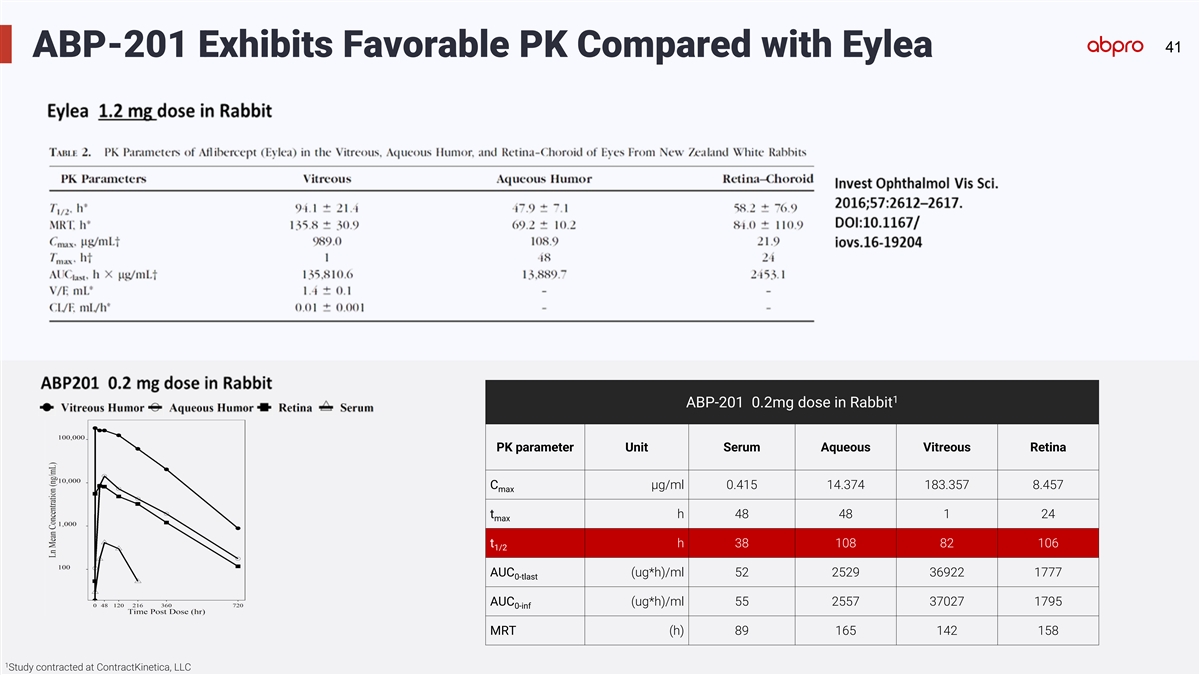
41 ABP-201 Exhibits Favorable PK Compared with Eylea 1 ABP-201 0.2mg dose in Rabbit PK parameter Unit Serum Aqueous Vitreous Retina C µg/ml 0.415 14.374 183.357 8.457 max t h 48 48 1 24 max t h 38 108 82 106 1/2 AUC (ug*h)/ml 52 2529 36922 1777 0-tlast AUC (ug*h)/ml 55 2557 37027 1795 0-inf MRT (h) 89 165 142 158 1 Study contracted at ContractKinetica, LLC

42 Certain Risk Related to ACAB, Abpro and the Business Combination All references to the “Company,” “we,” “us” or “our” refer to the business of Abpro Corporation. and its subsidiaries, taken as a whole, unless the context otherwise requires. The risks noted below are not exhaustive and are qualified in their entirety by disclosures contained in future documents filed or furnished by the Company, Atlantic Coastal Acquisition Corp. II. (“ACAB”), the newly formed company that will become the parent company of the Company and ACAB (the “combined company” or “NewCo”) after the proposed business combination and the related transactions contemplated among the parties (collectively, the “Business Combination”), or others, with the U.S. Securities and Exchange Commission (the “SEC”). The risks presented in such filings will include risks with respect to the business and securities of the Company, ACAB, and Newco, as well as risks related to the Business Combination and any related financing, and may differ significantly from and be more extensive than those presented below. Certain risks related to ACAB, Abpro, and the Business Combination include the following: • ACAB’s and Abpro’s ability to complete the Business Combination during the anticipated timeframe or at all, including as a result of any changes in SEC regulations or policies related to business combinations involving SPACs that could adversely affect ACAB’s and Abpro’s ability to negotiate and complete the Business Combination; • Abpro’s success in retaining or recruiting, or changes required in, officers, key employees, or directors following the Business Combination; • The funds in the trust account being available to ACAB or the combined company; • ACAB’s or the combined company’s ability to obtain additional financing to complete the Business Combination; • ACAB’s public securities’ liquidity and trading and those of the combined company; • The lack of a market for ACAB’s or the combined company’s securities; • The use of funds not held in the trust account or available to ACAB from interest income on the trust account balance and the trust account not being subject to claims of third parties; • The impact of macroeconomic conditions and geopolitical crises; • The number of ACAB shareholders voting against the business combination proposal; • The occurrence of any event, change or other circumstances that could give rise to the termination of the business combination agreement; • The ability to achieve and maintain the listing of the combined company’s shares on a national securities exchange following the Business Combination; • Changes adversely affecting the businesses in which Abpro is engaged, including the risk that the Business Combination disrupts current plans and operations of the Company as a result of the announcement or the consummation of the Business Combination; • Management of growth and Abpro’s ability to execute on its business strategy and plans; • The result of future financing efforts; • Risks related to regulatory matters, including regulatory approvals and laws and regulations related to anti-corruption, cyber security and privacy; • Risks related to regulatory approval of Abpro’s current or future products and therapies and Abpro’s ability to successfully commercialize any these products and therapies in a timely manner or at all, as well as Abpro’s ability to accurately anticipate demand and efficacy for its products and therapies; • Abpro’s future financial performance, including the risk that Abpro’s financial results and business metrics are likely to fluctuate on a quarterly and annual basis; • Market opportunity estimates and growth forecasts are subject to significant uncertainty and are based on assumptions and estimates that may not prove to be accurate; • Risks related to Abpro’s ability to retain and expand its development agreements, the lack of long-term and binding commitments with co-developers, and its ability to compete effectively; • Risks related to international operations and related regulatory risks; • Risks related to our intellectual property, including our ability to protect our IP portfolio and risks related potential claims by third parties; • Abpro’s failure to raise additional capital or generate the significant capital necessary to maintain and expand its operations, and risks related to Abpro’s ability to continue as a “going concern”; • Abpro’s ability implement and maintain sufficient internal controls over financial reporting and disclosure controls and procedures, and its ability to report its financial results in an accurate and timely manner; • Fluctuations in the stock price of the combined company’s securities; • Any projections will not have been prepared with a view toward compliance with published guidelines of the American Institute of Certified Public Accountants, and have not been compiled or examined by any registered public accountants nor any other independent expert or outside party; • Risks related to the limited public company experience among Abpro’s management team and risks related to Abpro’s ability to operate as a public company and comply with applicable law and regulations and corporate governance matters applicable to public companies, including those required by the SEC and applicable stock exchange; • Certain of ACAB’s and Abpro’s directors and officers and significant stakeholders may have interests in the Business Combination different from the interests of ACAB’s or Abpro’s shareholders; • The exercise of discretion by directors and officers ACAB or Abpro in agreeing to changes to the terms, or waivers of closing conditions, in the definitive agreements with respect to the Business Combination and potential conflicts of interest of SPAC’s sponsor, directors and officers; and • Costs related to the Business Combination and the increased costs of being a public company following the consummation of the Business Combination.
Mission: Developing antibody therapies to improve the lives of patients Thank you! facing severe and life- threatening diseases https://abpro.com/ ABPRO CORPORATION IR@abpro.com 68 Cummings Park, Woburn, MA 01801