
公司年度報告 2024年10月 開發治療性抗體 針對過敏、發炎和增生性疾病 附件99.1 展示

免責聲明 本演示文稿含有前瞻性陳述。 本演示文稿中除歷史事實外的所有陳述,包括有關Allakos Inc.(下稱“Allakos”、“公司”、“我們”或“我們的”)財務狀況;估計的lirentelimab清退、遣散和其他成本;重組支出支付時間;2024年資金結餘、現金和投資估計;估計現金進度;業務策略;未來業務運作的計劃和目標;我們對於我們產品候選者的潛在好處、活性、有效性和安全性的期望;我們對於開展、設計、時間表和臨床研究、基礎研究和研發計劃的期望,包括來自這些研究數據的時間表和可用性;我們產品候選者的基礎研究、臨床和監管發展計劃;以及我們預期的里程碑都是前瞻性陳述。 Allakos是基於其估計和假設,以及對未來事件的當前期望和預測制定了這些前瞻性陳述。 “預期”,“相信”,“繼續”,“可能”,“估計”,“期望”,“打算”,“潛在”,“預測”,“項目”,“目標”,“應該”等表達意圖識別前瞻性陳述,雖然並非所有前瞻性陳述都包含這些識別詞。 公司實際上可能無法實現這些前瞻性陳述中披露的計劃、意向或期望,您不應對這些前瞻性陳述給予過度依賴。 本演示文稿中包含的前瞻性陳述僅截至本演示文檔日期,並且受到多項風險、不確定性和假設的影響,包括但不限於:公司臨床藥物開發階段;公司及時開展和完成AK006臨床試驗的能力;公司為其臨床試驗獲得所需的監管批准的能力;與其臨床試驗中的患者招募有關的不確定性;公司在其臨床試驗中展示其產品候選者的安全性和有效性足夠;儘管在基礎研究和先前臨床試驗結果不明確的情況下,臨床試驗成功的不確定性;公司推進AK006以外的其他產品候選者的能力;公司獲得額外資金以為其業務提供資金的能力;一般經濟和市場環境;以及我們已經和將向證券交易委員會(“SEC” )提交的定期申報文件中描述的其他風險。此外,Allakos運作在一個競爭激烈且快速變化的環境中。 新風險不時出現。 Allakos的管理層無法預測所有風險,也無法評估所有因素對其業務的影響,或任何因素或多個因素可能導致實際結果與Allakos可能提出的任何前瞻性陳述有實質差異的程度。 鑒於這些風險、不確定性和假設,本演示文稿中討論的前瞻事件和情況天然是不確定的,可能不會發生,實際結果可能與Allakos預期或暗示的結果有實質和不利的差異。 因此,您不應依賴前瞻性陳述來預測未來事件。 Allakos不承擔任何更新或修改任何前瞻性陳述的義務,使這些陳述符合實際結果或更改Allakos的期望,除非法律要求。 數據準確性 本演示文稿包含基於獨立行業發布物或其他公開信息的統計數據,以及基於Allakos內部來源的其他信息。 我們尚未獨立核實這些行業出版物和其他公開信息中包含的數據的準確性或完整性。 因此,Allakos對這些行業出版物和其他公開信息中包含數據的準確性或完整性不作任何陳述。 額外信息 公司已經並將向SEC提交“8-K”表格的更新報告,“10-Q”季度報告和“10-K”年度報告以及其他文件。 您應閱讀這些文件,以了解有關公司的更完整信息。 您可以通過訪問SEC網站www.sec.gov免費獲取這些文件。 本演示文稿涉及正在進行臨床調查並尚未獲得美國食品和藥物管理局批准上市的產品。 根據聯邦法,它目前僅限於研究使用,對於其正在研究的目的的安全性或有效性不作保證。 Allakos和3個圓圈設計是Allakos Inc.擁有的聯邦註冊商標,任何未經授權的使用均嚴格禁止。

allakos機會新目標里程碑早期Q1’25 – 報告在CSU患者中AK006的頂層第1期數據 AK006(抗Siglec-6單株抗體)選擇性抑制多種肥大細胞活化模式 抑制IgE依賴和IgE獨立的肥大細胞活化途徑,包括IgE、KIt和MRGPRX2 通過活化巨噬細胞存在下的ADCP來消耗肥大細胞 未來數據催化劑和預期里程碑 AK006有潛力治療廣泛範圍的肥大細胞驅動疾病 AK006的靜脈和皮下製劑在皮膚肥大細胞上實現高Siglec-6佔有率 SC製劑的AK006具有高生物利用度且耐受性良好 AK006正在慢性特異性蕁麻疹(CSU)中進行測試 對新劑劑的重要需求
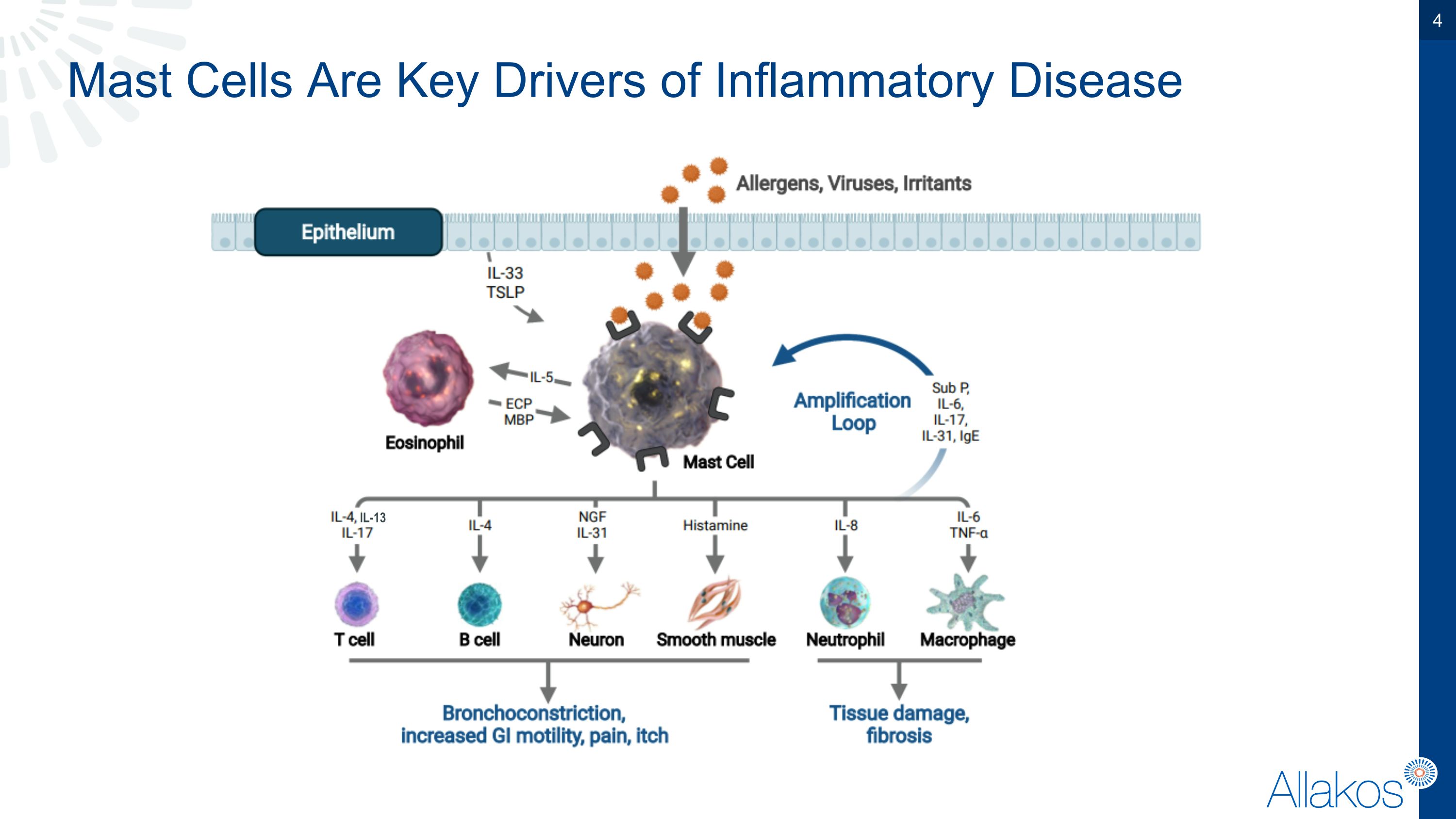
肥大細胞是炎症性疾病IL-13的關鍵推動因素
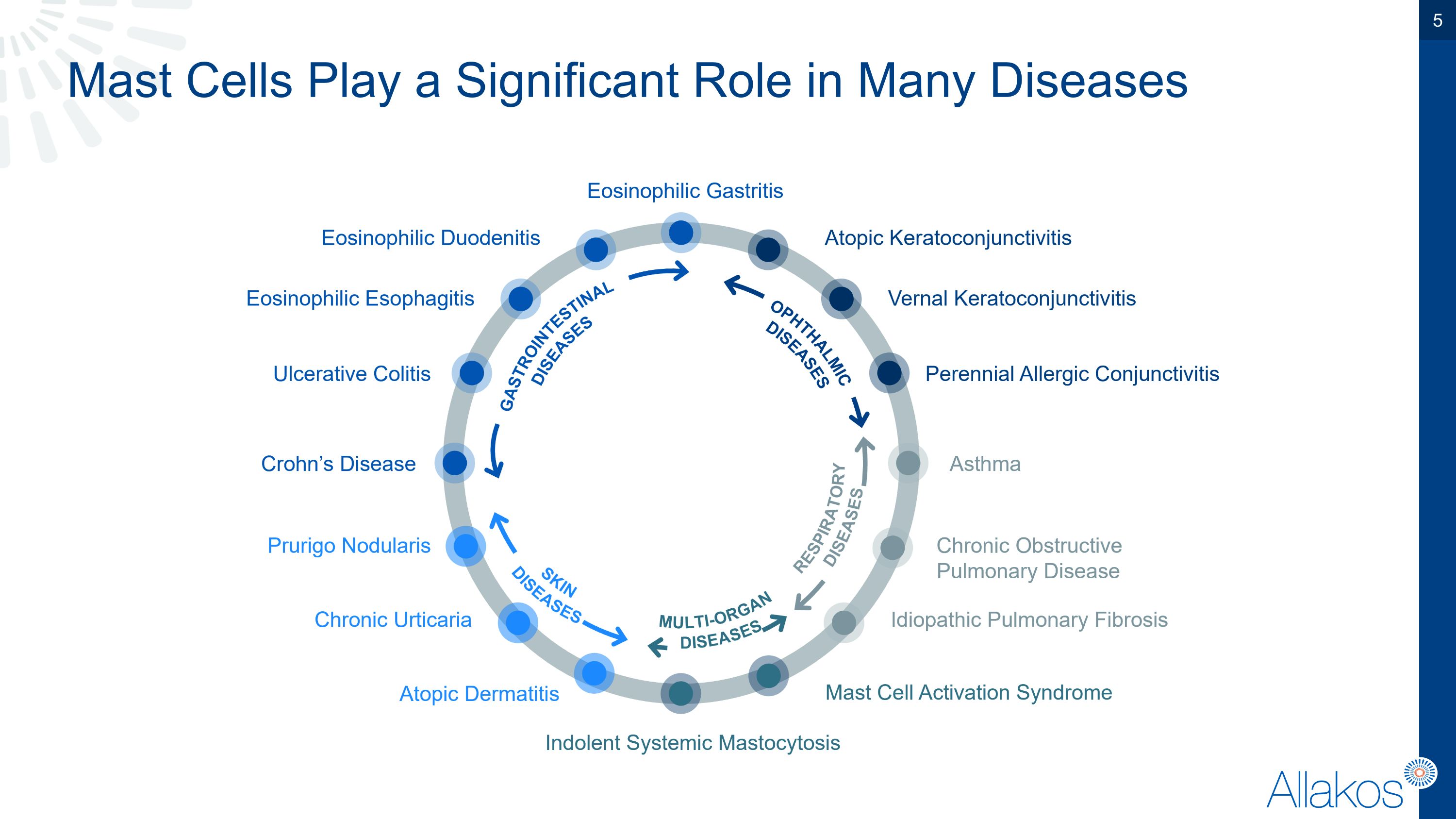
肥大細胞在許多疾病中扮演重要角色
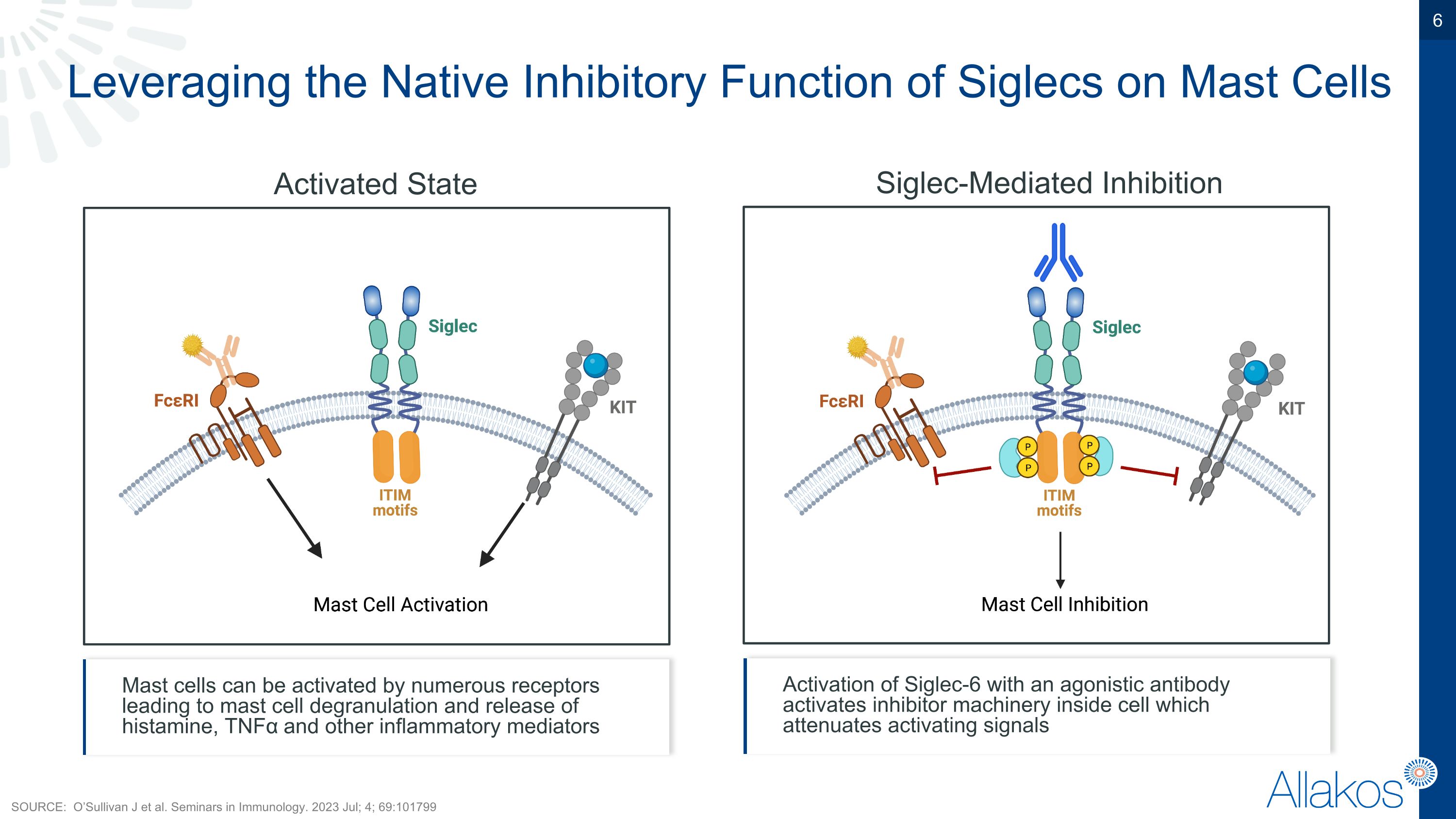
利用Siglecs對肥大細胞天然的抑制功能 來抑制肥大細胞被激活的狀態 Siglec介導的抑制 肥大細胞可以被多種受體激活,導致肥大細胞脫顆粒和釋放組織胺、TNFα和其他炎症介質 Siglec-6的激動性抗體激活會啟動細胞內的抑制機械,從而減弱激活信號 來源: O’Sullivan J等人。 免疫學研討會。 2023年7月; 4; 69:101799

節目指示發現前臨床第一階段第二階段第三階段里程碑AK006(抗Siglec-6)健康志願者 &CSU CSU 預計於2025年第一季度初獲結 果AK068(Siglec-6/Siglec-8 雙特異性)發炎性疾病進行中未公開的發炎性疾病正在進行allakos管線

AK006:Siglec-6 mAb 可選擇性和強效抑制肥大細胞
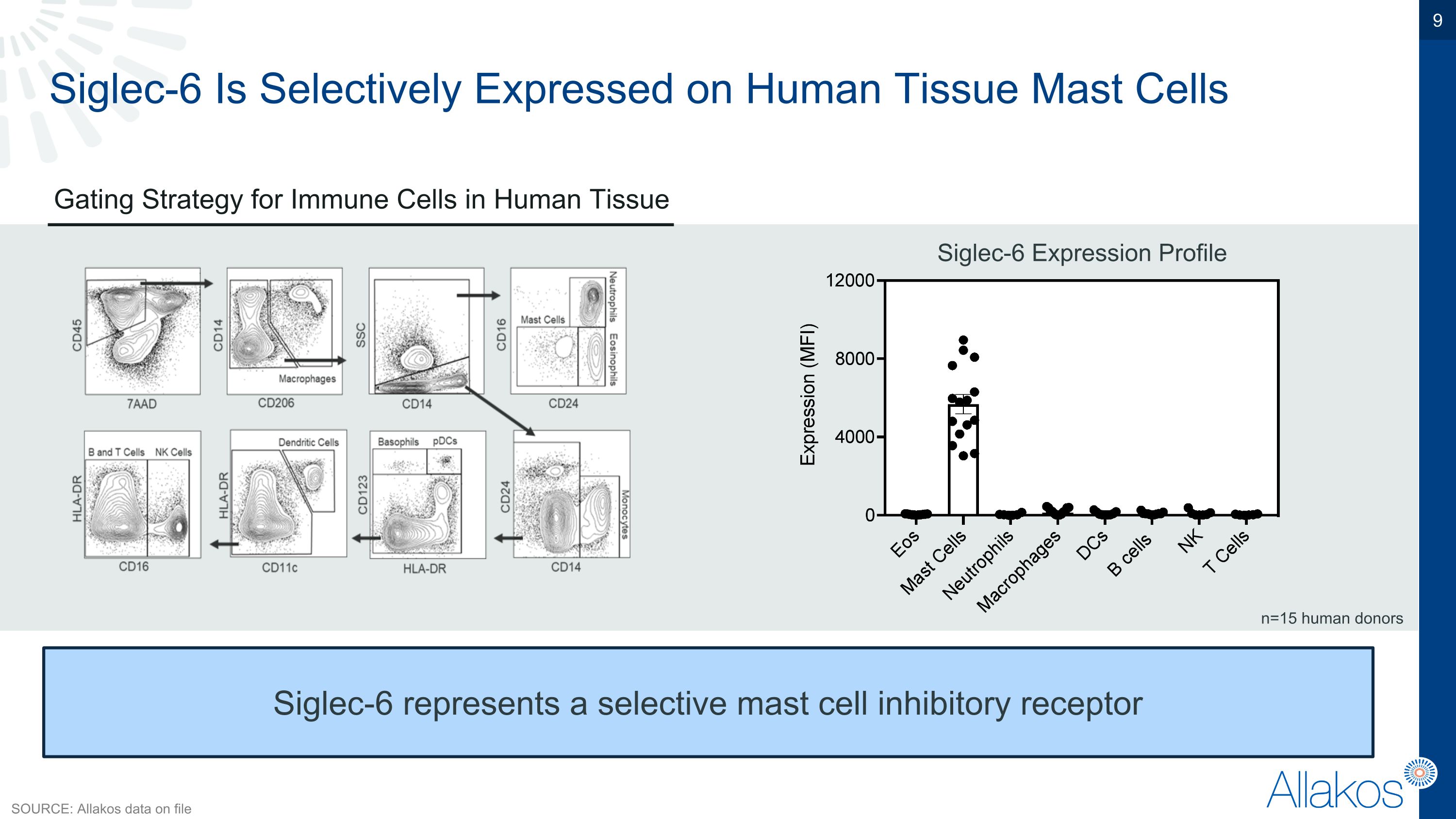
Siglec-6在人體組織中僅在肥大細胞上表達。在人體組織中對免疫細胞進行閘門策略。Siglec-6表達輪廓Siglec-6代表一種選擇性肥大細胞抑制性受體 n=15 人體供者 資料來源:allakos檔案內資料
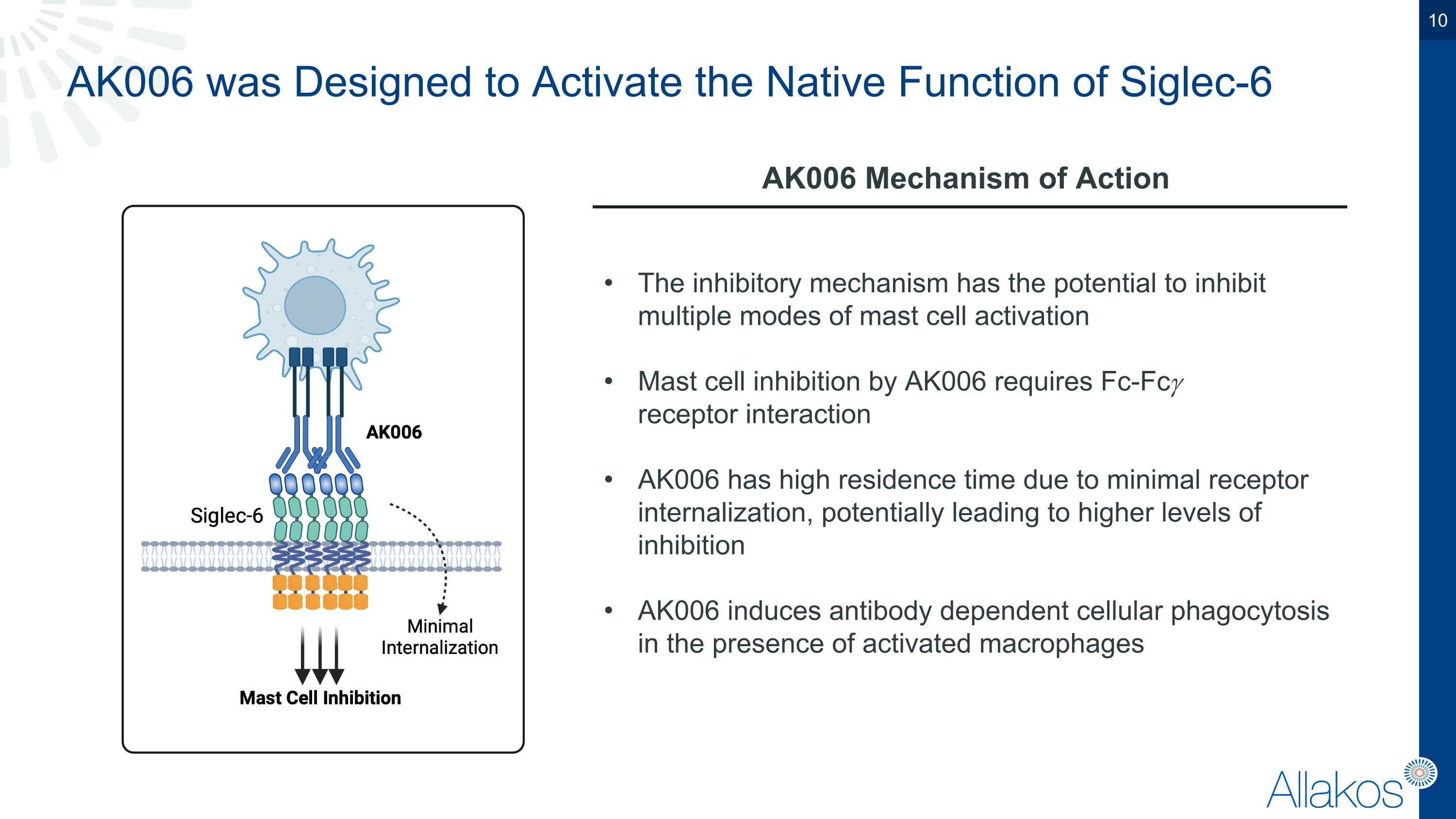
AK006的設計目的是啟動Siglec-6的內生功能。AK006的作用機制具有抑制作用,可以抑制多種肥大細胞活化模式。AK006通過Fc-Fc𝛾受體相互作用來抑制肥大細胞。由於最低的受體內化,AK006具有較長的住宅時間,可能導致更高水平的抑制。在活化的巨噬細胞存在時,AK006會引起抗體依賴性細胞吞噬作用。
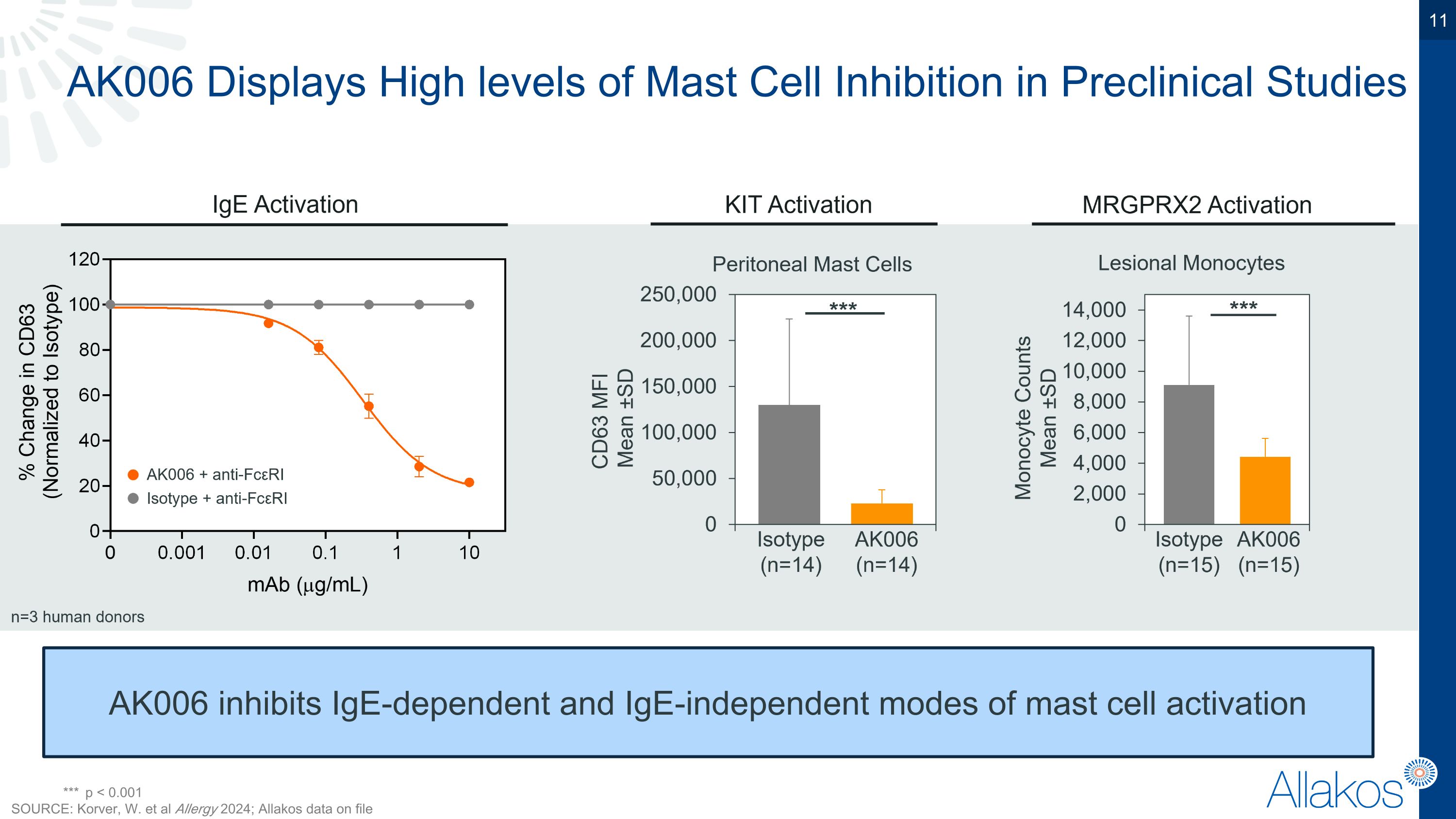
AK006在臨床前研究中顯示出高水平的電芯抑制作用,AK006抑制了電芯依賴和電芯非依賴的電芯活化方式 *** p < 0.001 來源:Korver, W. 等人 Allergy 2024; allakos檔案中的Allakos數據
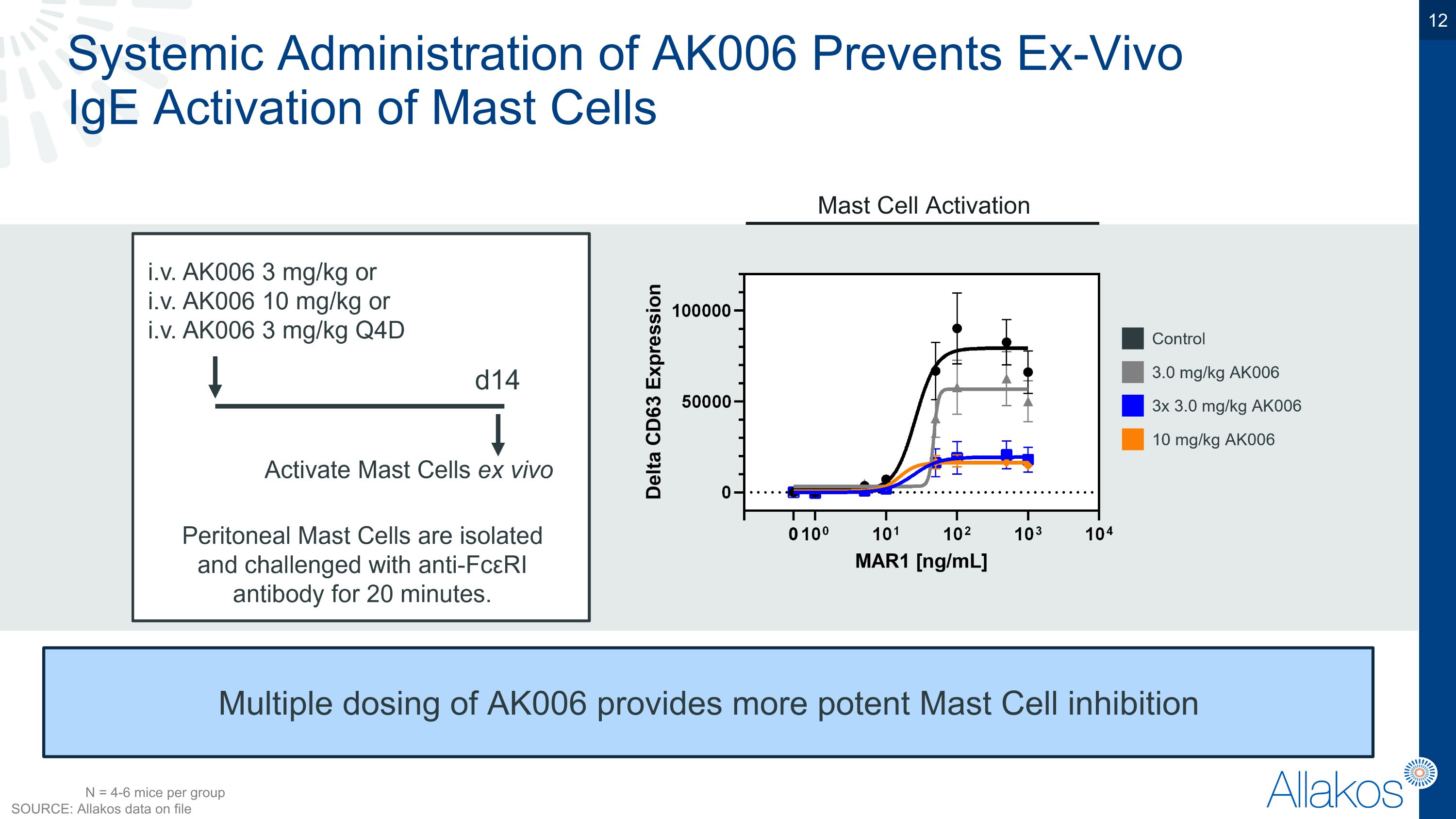
AK006系統給藥可防止體外IgE激活肥大細胞 AK006多次給藥提供更強力的肥大細胞抑制 肥大細胞活化 N = 每組4-6隻老鼠 來源:allakos檔案中的數據
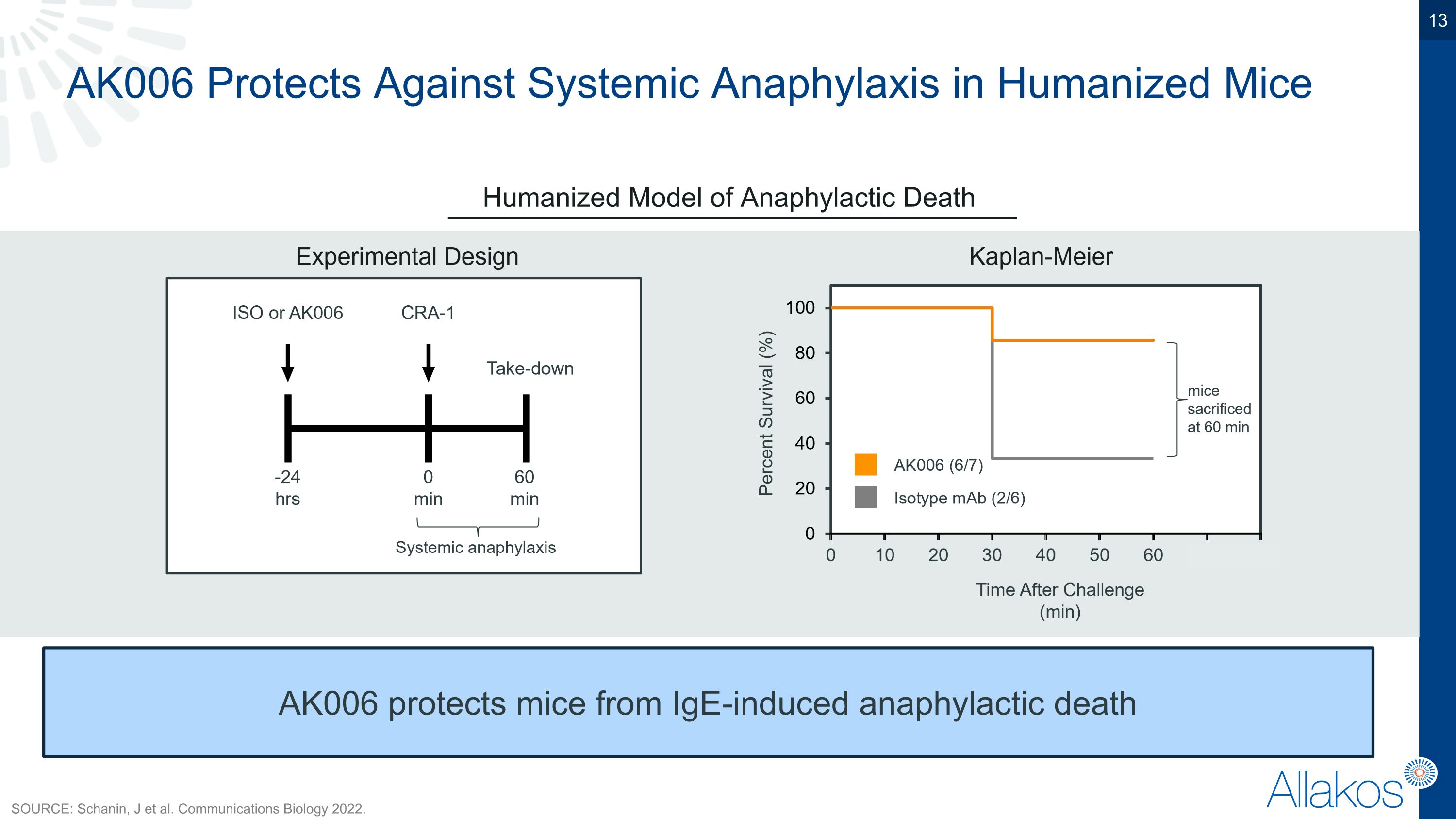
AK006在人類化小鼠系統性過敏反應中具有保護作用,人類化的過敏性死亡模型。AK006保護小鼠免受IgE誘導的過敏性死亡。來源:Schanin, J 等。通信生物學2022年。
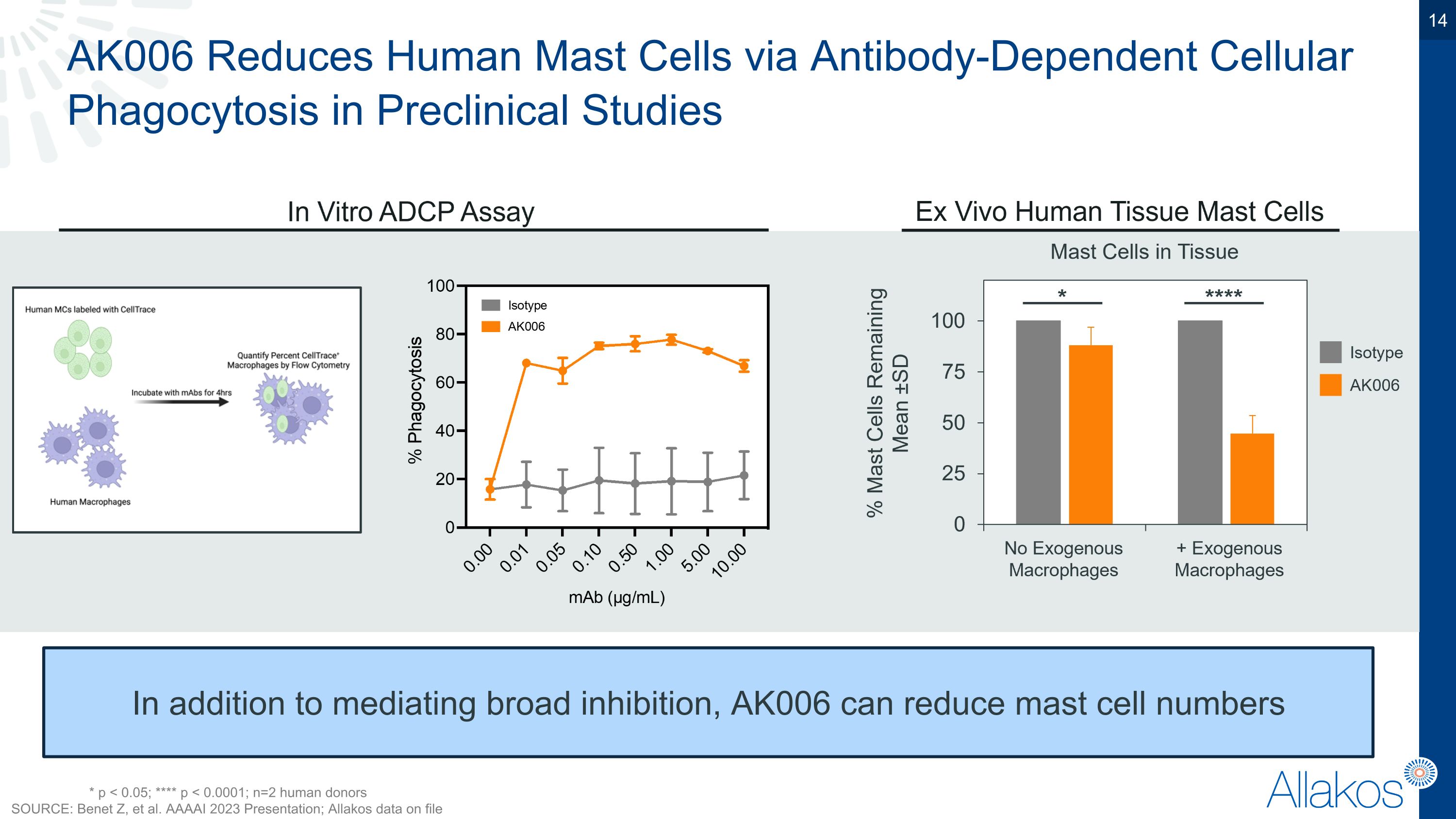
AK006透過抗體依賴性細胞吞噬作用在臨床前研究中減少人類肥大細胞。除了介導廣泛的抑制,AK006可以降低肥大細胞數目 * p < 0.05; **** p < 0.0001; n=2 名人類供者 來源: Benet Z, 等人 AAAAI 2023年研討會; Allakos公司檔案中的數據
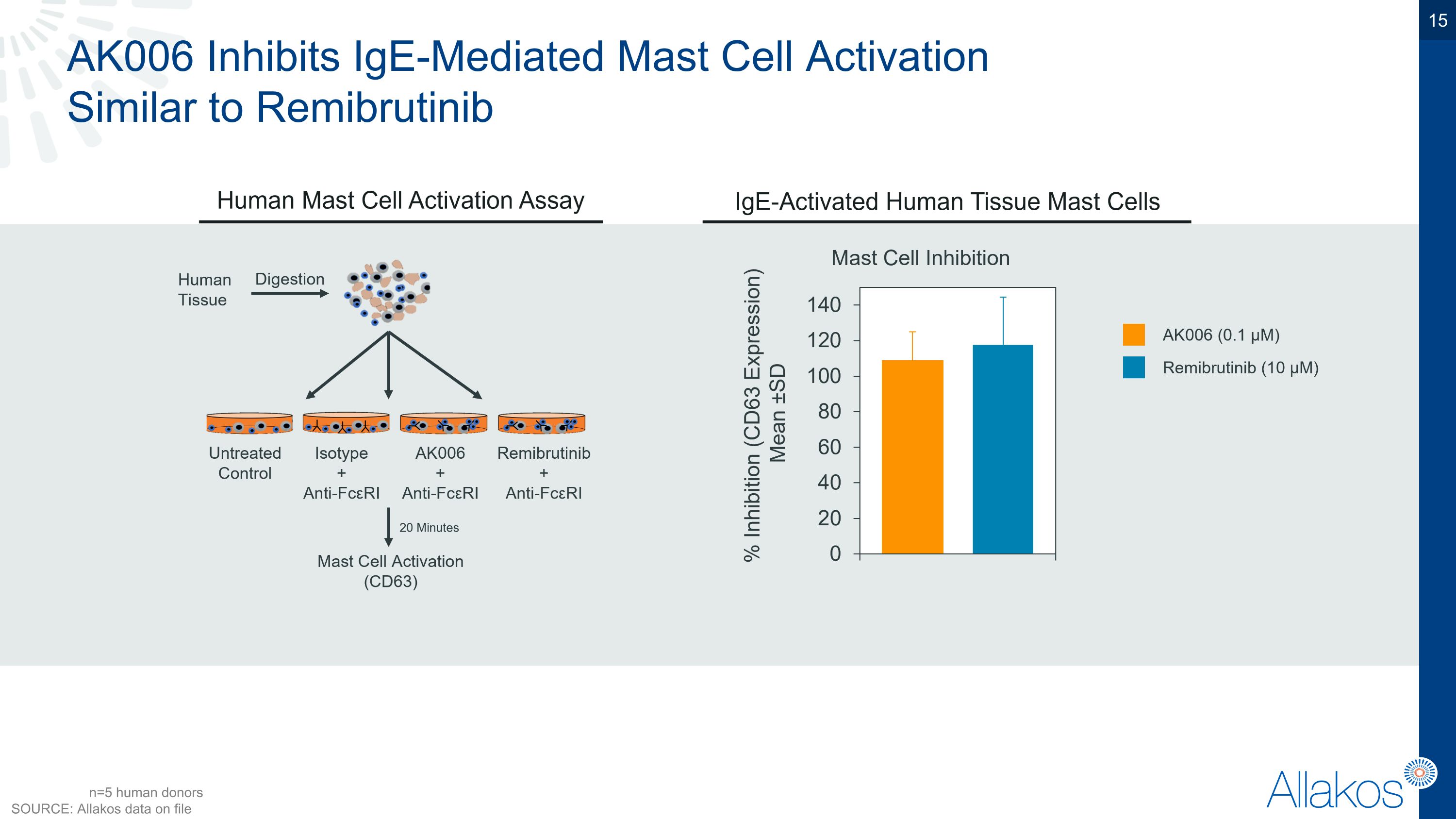
AK006 抑制IgE介导的肥大细胞激活 類似於Remibrutinib n=5名人體捐助者 來源: allakos內部資料

AK006正進行第1期臨床研究,對健康志願者和慢性自發性蕁麻疹進行研究。

AK006第1期研究設計單一升劑量(SAD)和多次升劑量(MAD)在健康志願者中隨機、雙盲、安慰劑控制 靜脈投注AK006 SAD:5、20、80、240、720毫克 MAD:80、240、720毫克,每月 皮下注射AK006 150和720毫克 計劃的CSU組隨機、雙盲、安慰劑控制 中等至重度抗組織胺難治性CSU 基線時UAS7分數≥16和HSS7分數≥8 AK006 IV每月給予4次劑量 SAD和MAD組安全性和耐受性 藥物動力學 藥物動力學 在皮膚活檢中的目標受體參與 SC生物利用度 CSU組通過在第14週的UAS7變化評估的治療活性 安全性和耐受性 試驗組终點
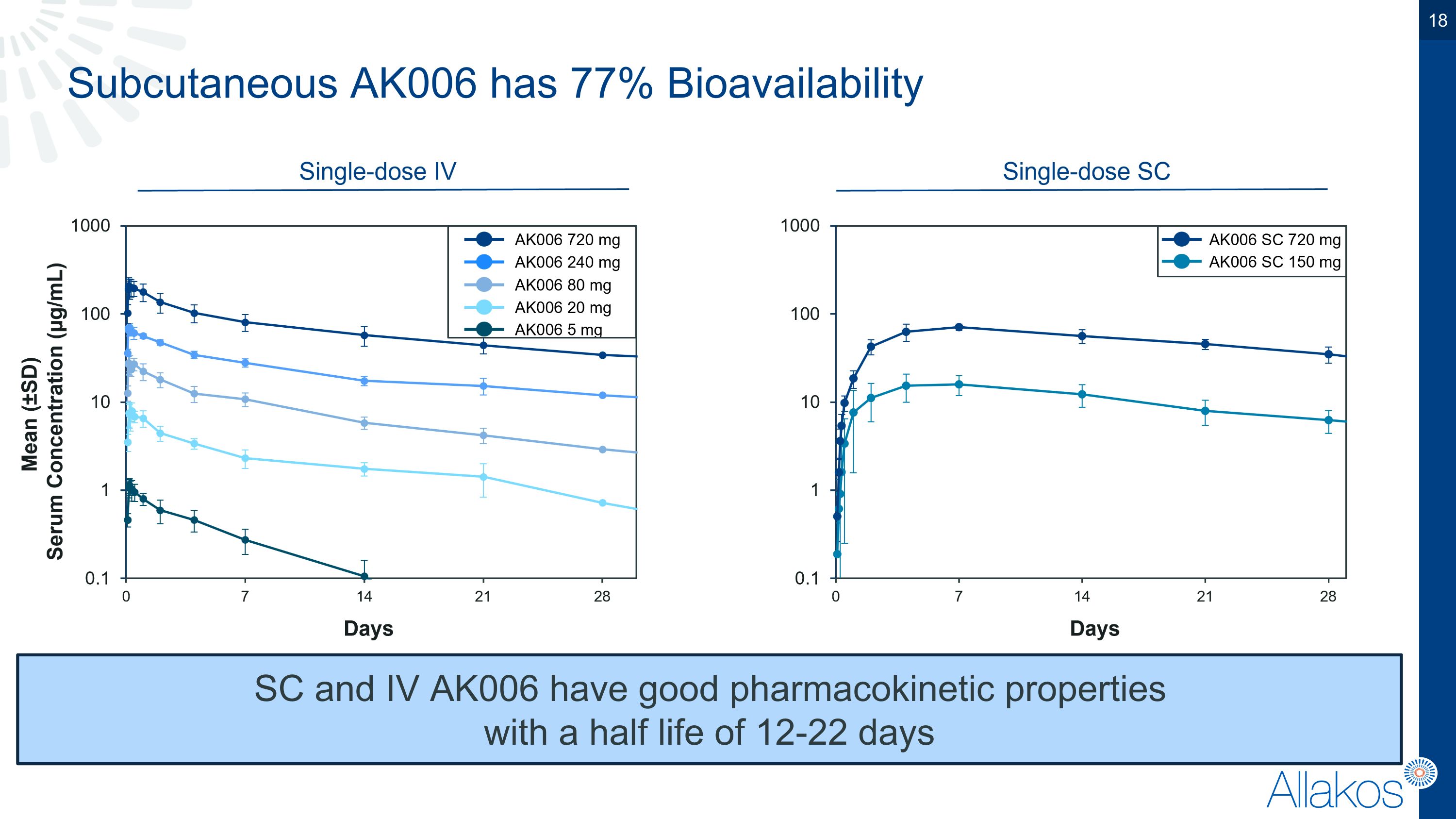
皮下注射的AK006具有77%的生物利用度,皮下和靜脈注射的AK006具有良好的藥代動力學性質,在12-22天的半衰期內
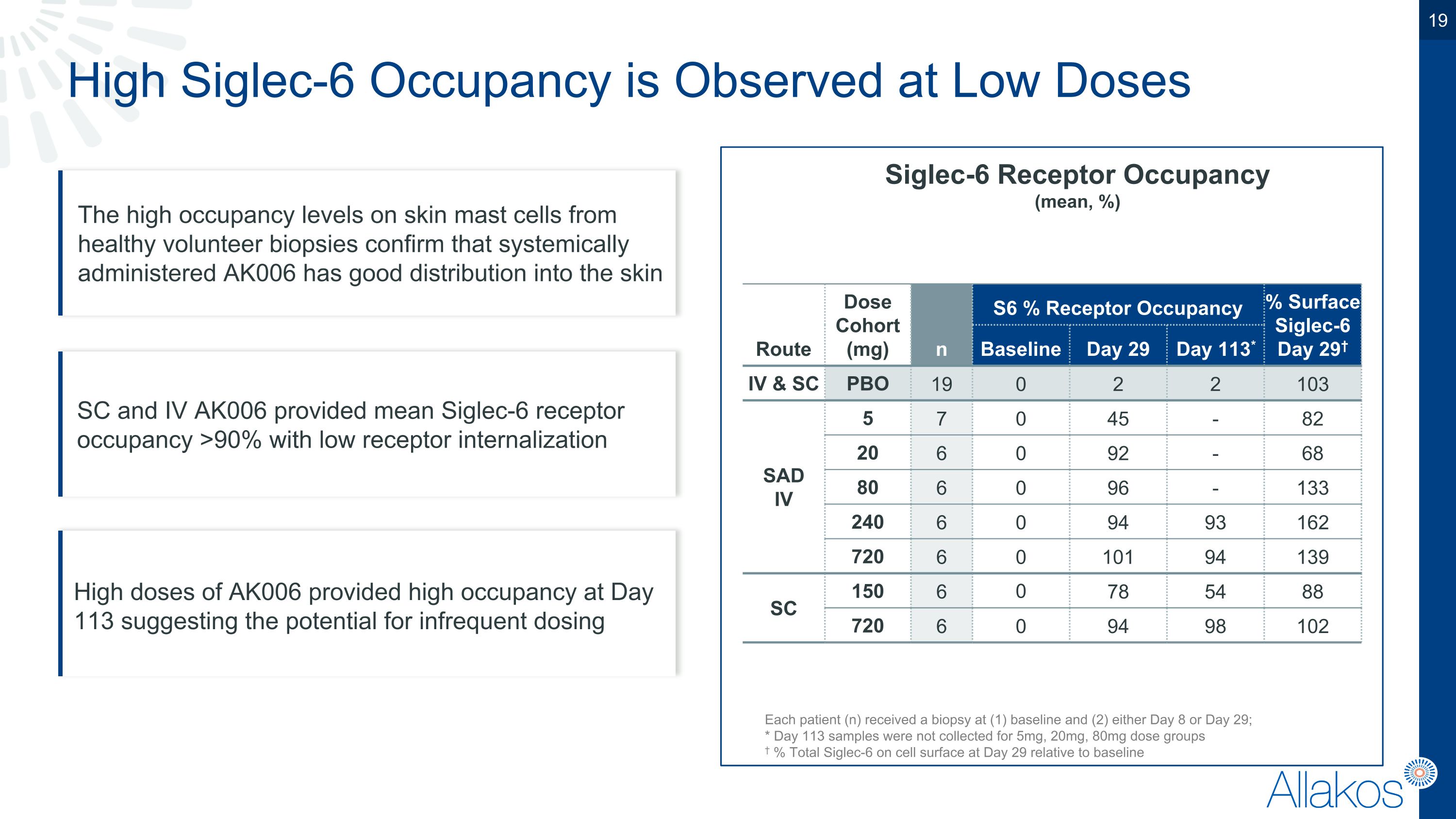
低劑量下觀察到高Siglec-6受體佔有率 (平均,%)路徑劑量組別(毫克)n S6%受體佔有率%表面Siglec-6第29天†基線第29天第113天* IV和SC PBO 19 0 2 2 103 SAD IV 5 7 0 45 - 82 20 6 0 92 - 68 80 6 0 96 - 133 240 6 0 94 93 162 720 6 0 101 94 139 SC 150 6 0 78 54 88 720 6 0 94 98 102 每位患者(n)在基線(1)和第8天或第29天進行活檢;* 未收集5mg,20mg,80mg劑量組別的第113天樣本†%相對細胞表面第29天的總Siglec-6 高佔有率的皮膚肥大細胞從健康志願者活檢中確認系統給藥的AK006在皮膚SC和IV中有良好的分佈SC和IV AK006提供的平均Siglec-6受體佔有率 > 90%,低受體內化高劑量的AK006在第113天提供高佔有率,暗示不經常使用的潛力。

AK006單一或多次靜脈注射和SC單一劑量至720毫克的藥物在安全上表現良好,具有良好的安全性檔案。截至目前的安全檔案中: AK006受試者中沒有出現治療相關的嚴重不良事件(SAEs) 沒有因AK006而導致停藥的治療相關不良事件 沒有劑量限制毒性 最常見的不良事件(≥10%)在接受AK006治療的受試者中更頻繁出現的是頭痛和經痛,全部為輕至中度的嚴重程度

AK006用於慢性自發性蕁麻疹
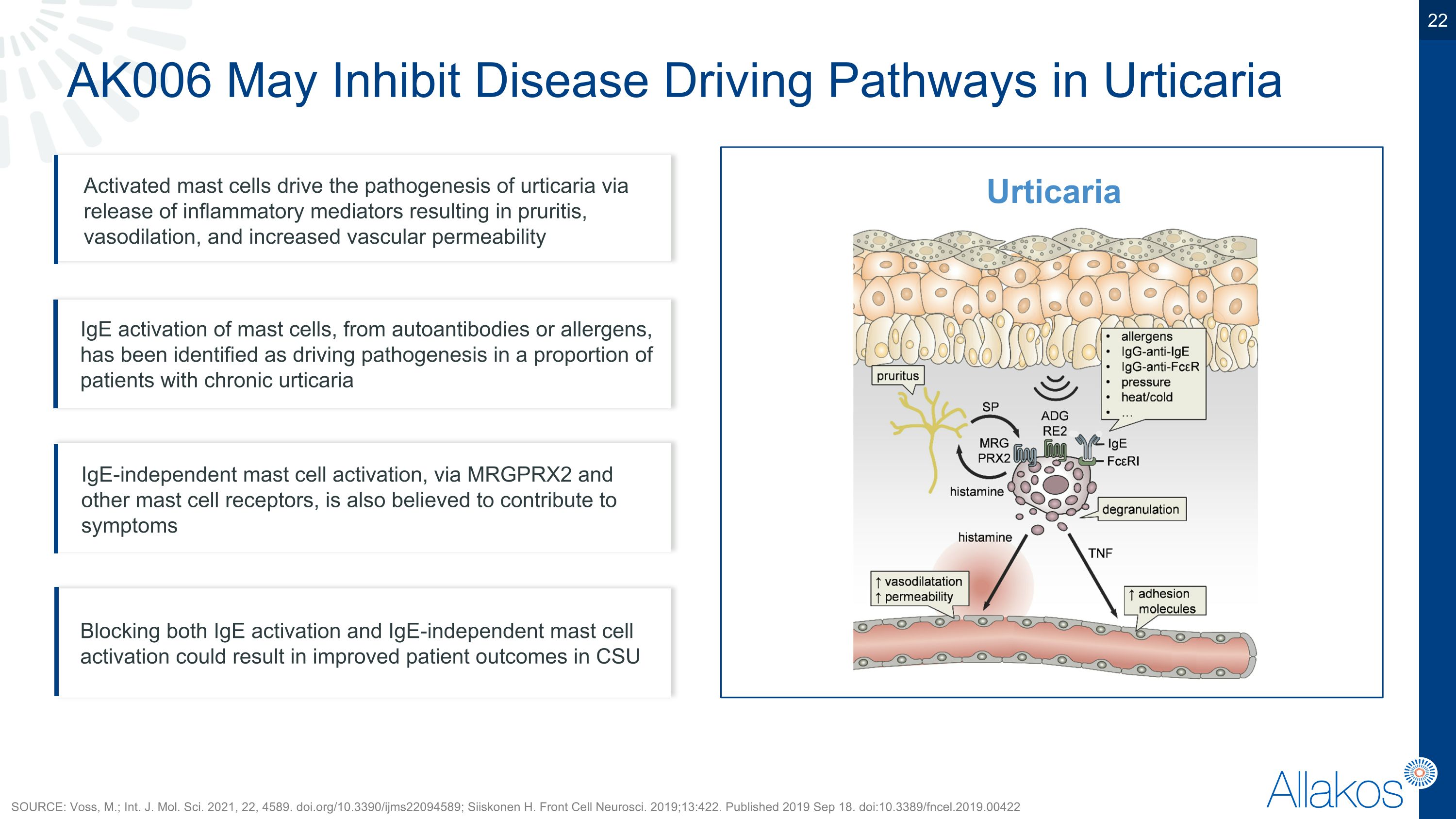
AK006可能抑制荨麻疹中的疾病驱动路径,活化的肥大细胞通过释放炎性介质驱动荨麻疹的发病机制,导致瘙痒、血管扩张和增加的血管通透性。同时阻断IgE激活和非IgE独立的肥大细胞激活有可能改善慢性先兆性荨麻疹患者的预后。已确认在一部分慢性荨麻疹患者中,IgE激活的肥大细胞,来自自身抗体或过敏原,被确认为荨麻疹发病的驱动因素。MRGPRX2和其他肥大细胞受体介导的非IgE独立的肥大细胞激活也被认为是症状的一个贡献因素。参考资料:Voss萬;Int. J. Mol. Sci. 2021, 22, 4589. doi.org/10.3390/ijms22094589;Siiskonen H. Front Cell Neurosci. 2019;13:422. 发表于2019年9月18日。 doi:10.3389/fncel.2019.00422 荨麻疹
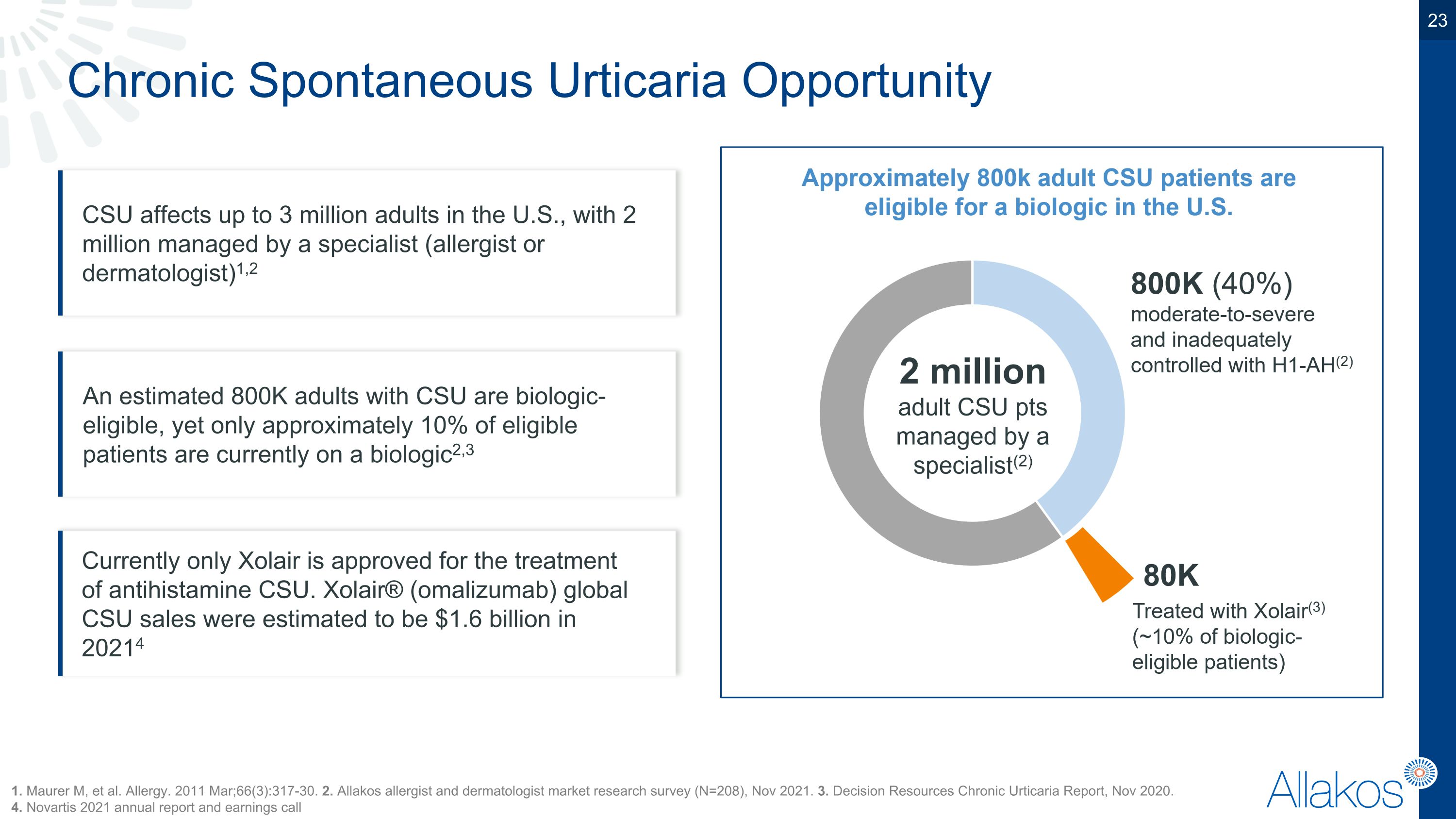
慢性自發性荨麻疹(CSU)在美國影響多達300萬名成年人,其中有200萬名由專科醫師(過敏科醫師或皮膚科醫師)管理1,2。1. Maurer m, et al. Allergy. 2011 Mar;66(3):317-30. 2. 全球貨幣過敏科醫師和皮膚科醫師市場調查(N=208),2021年11月。3. 決策資源慢性荨麻疹報告,2020年11月。 4. 諾華2021年度報告和業績會。估計有80萬名CSU患者適合生物製劑治療,但目前僅約有10%的合格患者接受生物製劑2,3。目前僅有Xolair獲批用於治療抗組織胺CSU。全球貨幣(omalizumab) CSU銷售額估計為20億美元於2021年4月。
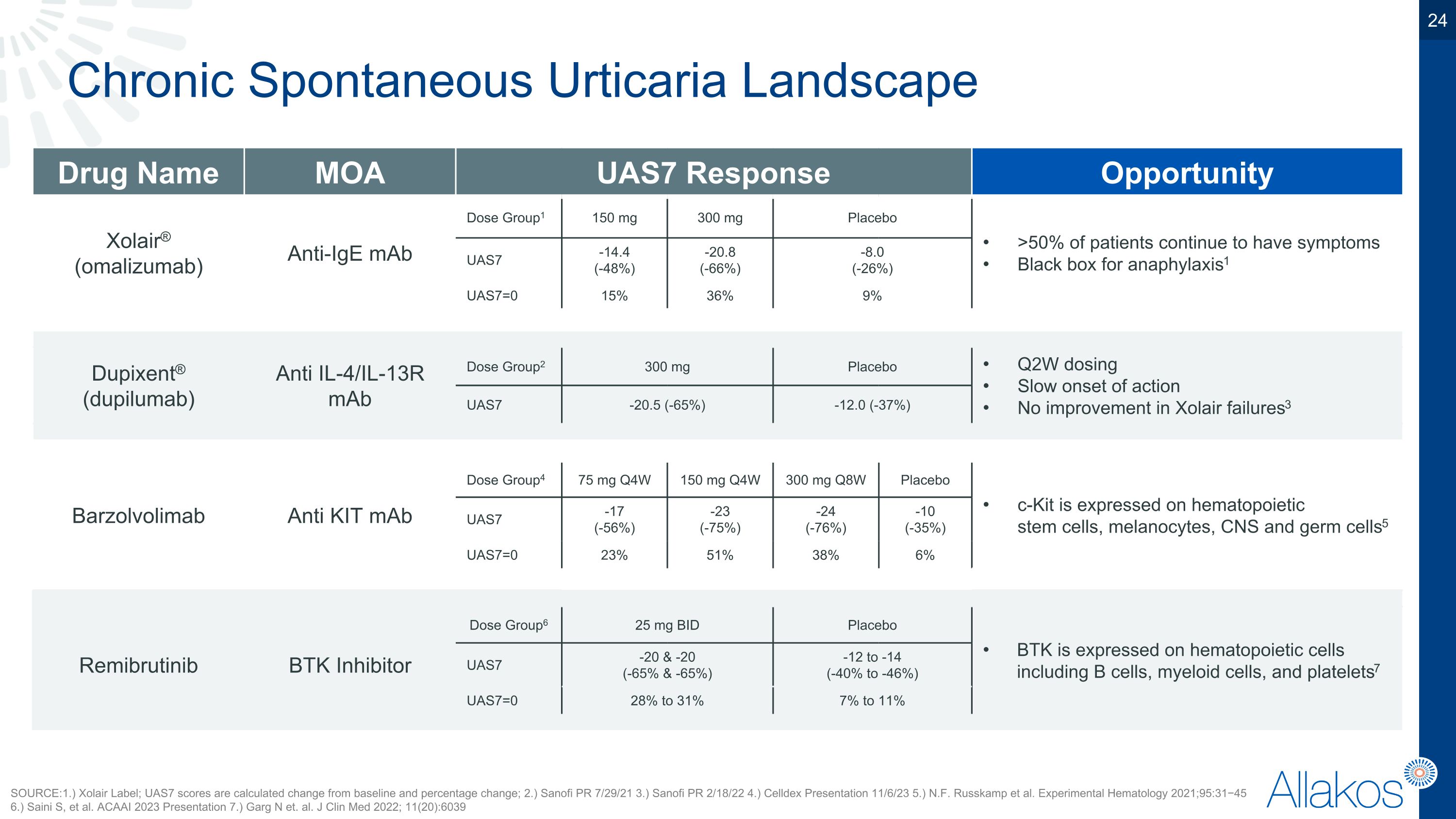
慢性特發性荨麻疹领域药物名称 MOA UAS7 反应机会 赛诺菲安万特® (omalizumab) 抗IgE 抗体 第1组 150 毫克 300 毫克 安慰剂 安慰剂 超过50%的患者持续出现症状 过敏性休克黑匣子1 UAS7 -14.4 (下降48%) -20.8 (-66%) -8.0 (-26%) -8.0 (-26%) UAS7=0 15% 36% 9% 9% 杜璞生® (dupilumab) 抗IL-4/IL-13R 抗体 第2组 300 毫克 300 毫克 安慰剂 安慰剂 Q2W用药 缓慢的起效作用 对赛诺菲安万特失败者无改善3 UAS7 -20.5 (-65%) -20.5 (-65%) -12.0 (-37%) -12.0 (-37%) Barzolvolimab 抗KIt 抗体 第4组 75 毫克 Q4W 150 毫克 Q4W 300 毫克 Q8W 安慰剂 c-Kit在造血干细胞、黑色素细胞、中枢神经系统和生殖细胞上表达5 UAS7 -17 (-56%) -23 (-75%) -24 (-76%) -10 (-35%) UAS7=0 23% 51% 38% 6% 第6组 25 毫克 购买盘 安慰剂 BTk在包括B细胞、髓系细胞和血小板在内的造血细胞上表达7 Remibrutinib BTk抑制剂 UAS7 -20 和 -20 (-65% 和 -65%) -12到-14 (-40%到-46%) 警告和注意事项:出血、感染、心律失常和衰竭、高血压、细胞减少症、恶性肿瘤8 UAS7=0 28%至31% 7%至11% 来源: 1.) 赛诺菲安万特说明书; UAS7评分按从基线的变化和百分比变化计算; 2.) 赛诺菲安万特公关 2021年7月29日 3.) 赛诺菲安万特公关 2022年2月18日 4.) Celldex演示 2023年11月6日 5.) N.F. Russkamp等。实验性血液学 2021;95:31-45 6.) Saini S等。ACAAI 2023年发表 7.) Garg N等。临床医学 2022; 11(20):6039

財務概況及關鍵里程碑

2024年第2季:向健康志願者報告IV AK006第1期試驗的SAD和MAD安全性、藥物動力學(PK)和藥效動力學(PD)結果,包括確認皮膚活檢樣本中Siglec-6受體佔有率的數據。2024年第2季:在患有慢性自發性荨麻疹(CSU)的患者中啟動IV AK006的隨機、雙盲、安慰劑對照的第1期試驗。2024年第3季:向健康志願者報告皮下(SC)AK006在第1期試驗中的安全性、PK和PD結果,包括確認皮膚活檢樣本中Siglec-6受體佔有率的數據。2025年初第1季:報告IV AK006在CSU患者中第1期試驗的頂線數據。

截至2023年12月31日現金、現金等價物及有價證券投資17080萬美元- 估計2024年進行重組使用現金(包括lirentelimab結算、離職及其他成本)3000萬美元- 估計2024年營業持續使用現金介於5,500至6,000萬美元- 預計2024年年底現金、現金等價物及有價證券投資介於8100至8600萬美元- 截至2023年12月31日普通股未來供應8780萬股- allakos預期重組活動將使現金的財務可持續性延長至2026年中期- AK006物質構成預計於2042年到期,不需延長- 計畫將皮下AK006用於第2期研究- 資產負債表和知識產權保護