Exhibit 99.2

© 2024 scholar rock公司。保留所有權利。Apitegromab在脊椎肌肉萎縮症(SMA)關鍵第3階段 SAPPHIRE 試驗中取得積極的頭條結果於2024年10月7日。

© 2024 scholar rock,Inc. 版權所有。議程 2 Jay Backstrom博士、MPH,總裁兼首席執行官 介紹 Jing Marantz 博士、Ph.D.,首席醫療官 盛世企業 結果 Jay Backstrom博士、MPH,總裁兼首席執行官 結語 問答環節

© 2024 scholar rock, Inc. 版權所有。前瞻性陳述本演示文稿中關於 Scholar Rock Holding Corporation 和 Scholar Rock, Inc.(以下統稱「Scholar Rock」)的未來期望、計劃和前景的各種聲明,包括但不限於 Scholar Rock 對其增長、策略、臨床試驗 apitegromab 的進展和時間安排以及適應症選擇和開發時間安排的期望,包括任何監管提交或商業推出的時間、任何產品候選藥物的治療潛力、臨床益處和安全性,以及關於進行中臨床前和臨床試驗的時間、成功和數據公告的期望,其現金運營時間、關鍵里程碑實現的期望,任何產品候選藥物是否能夠在人類中表現出與早期非臨床、臨床試驗數據一致的方式,以及其產品候選藥物和專有平台的潛力。使用「可能」、「或許」、「可能」,「將」、「應該」、「期望」,「計劃」,「預期」,「信任」,「估計」,「項目」,「打算」,「未來」,「潛力」或「繼續」,以及其他類似的表達,旨在識別此類前瞻性陳述。所有這些前瞻性陳述均基於管理層對未來事件的當前期望,並受到可能導致實際結果與此類前瞻性陳述中規定或暗示的結果大幅不同的一系列風險和不確定性的影響。這些風險和不確定性包括但不限於,Phase 3 SAPPHIRE 試驗結果是否足以支持監管批准,Phase 3 SAPPHIRE 試驗完整結果可能與概要數據不同,臨床前和臨床數據,包括 apitegromab 的 Phase 2 或 Phase 3 臨床試驗結果,這些數據是否預測未來或進行中的同一產品候選藥物的臨床試驗中生成的數據是否一致或更有利,Scholar Rock 的臨床前和臨床研究以及臨床試驗產生的數據;監管機構提供的信息或決定;從事爲類似用途開發產品的第三方的競爭;Scholar Rock 獲取、維護和保護其知識產權的能力;Scholar Rock 依賴第三方開發和製造產品候選藥物,包括但不限於爲任何臨床試驗提供供應;Scholar Rock 管理支出的能力以及在需要時獲得額外資金支持其業務活動並建立和維護戰略業務聯盟和新業務舉措的能力,以及我們繼續作爲一個持續經營的能力;以及在 Scholar Rock 的截至 2024 年 6 月 30 日的季度報告第「Risk Factors」 標題下更全面討論的那些風險,以及在 Scholar Rock 隨後與證監會的文件中討論的潛在風險、不確定性和其它重要因素。任何前瞻性陳述僅代表 Scholar Rock 今天的觀點,不應被依賴作爲任何後續日期的觀點。本演示文稿中的所有信息均截至演示日期,並且 Scholar rock 不承擔更新此信息的義務,除非法律要求。本演示文稿討論了處於臨床研究中且尚未獲得 FDA 或任何其他監管機構批准上市的產品候選藥物。不對這些產品候選藥物在正進行研究的用途的安全性或有效性作出明示或暗示的陳述或保證。本演示文稿還可能包含由獨立方和我們提供的關於市場規模、增長和我們行業的其他數據的估計和其他統計數據。這些數據涉及許多假設和侷限性,您應謹慎對待這些估計。此外,我們未來績效和我們競爭的市場未來績效的預測、假設和估計必然受到高度不確定性和風險的影響。Apitegromab 是一種正在評估的研究性藥物候選品。Apitegromab 尚未被 FDA 或任何其他監管機構批准用於任何用途,apitegromab 的安全性和有效性尚未得到確認。

© 2024 scholar rock, Inc. 版權所有。介紹Jay Backstrom博士,MPH總裁兼首席執行官 4

© 2024 學者岩石, Inc. 保留所有權利。我們的目標: 爲那些患有脊髓性肌肉萎縮症 (SMA) 的人創造可能性 5 肌肉是一切。我想要生活,知道我有足夠的力量照顧自己,即使獨自一人。- 麗莎
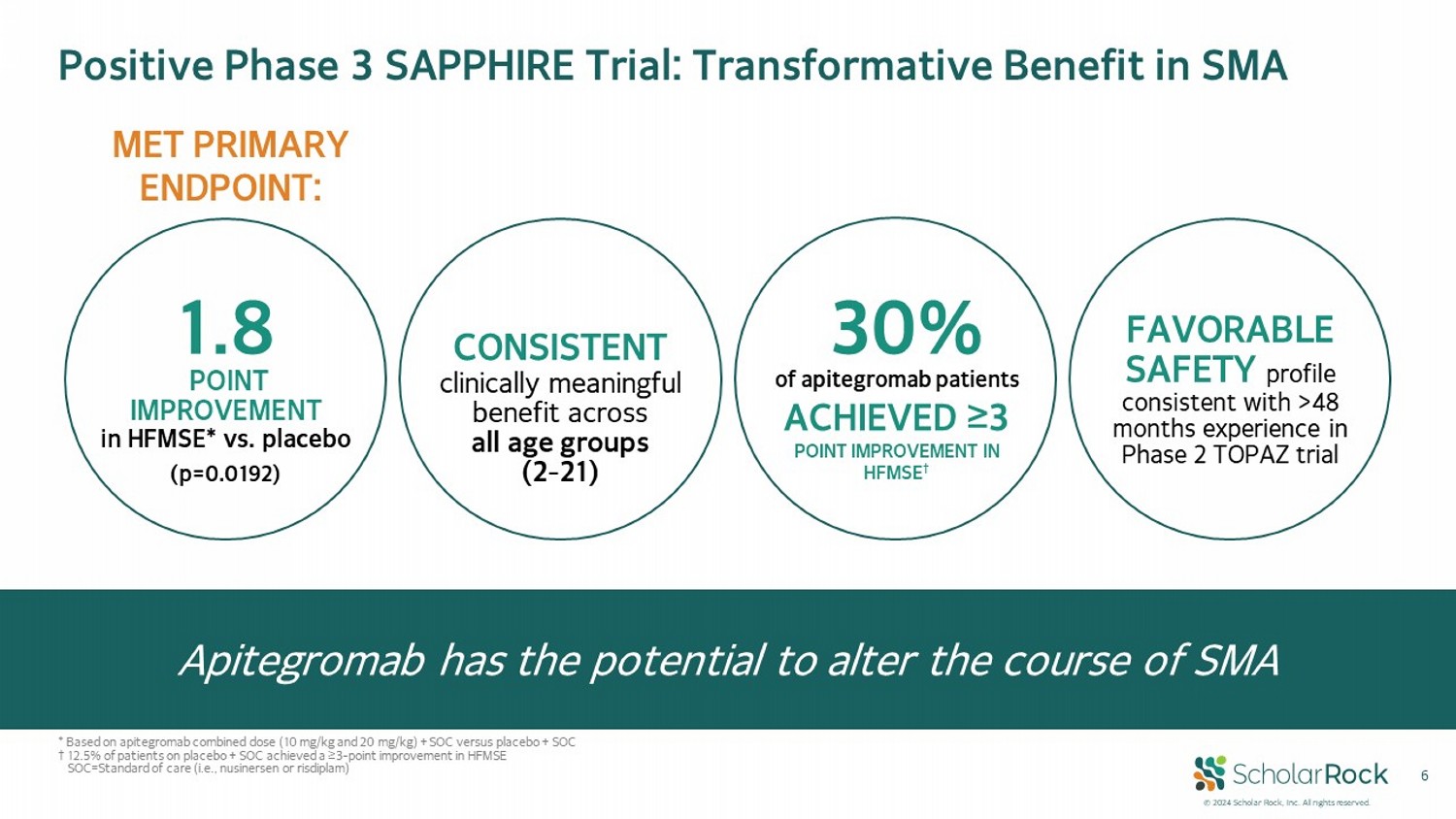
© 2024 scholar rock, Inc. 版權所有。在所有年齡段(2-21歲)中保持一致的臨床意義重大的益處,有利的安全性特徵與在 TOPAZ 試驗第 2 階段中 48 個月以上的經驗一致。30% 的 apitegromab 患者在 HFMSE 中獲得 ≥3 分的改善† 1.8(p=0.0192)。HFMSE* 中的改善比例 vs. 安慰劑 MEt 主要終點: 陽性的 SAPPHIRE 試驗第 3 階段: SMA 轉變性益處 apitegromab 有潛力改變 SMA 的病程* 基於 apitegromab 組合劑量 (10 毫克/公斤和 20 毫克/公斤) + SOC vs 安慰劑 + SOC† 12.5% 的患者在安慰劑 + SOC 上達到 ≥3 分改善 SOC = 標準治療(即 nusinersen 或 risdiplam)

© 2024 scholar rock, Inc. 所有權利保留。Jing Marantz博士, 醫學博士, 醫療主管第3階段 盛世企業 頂級成果
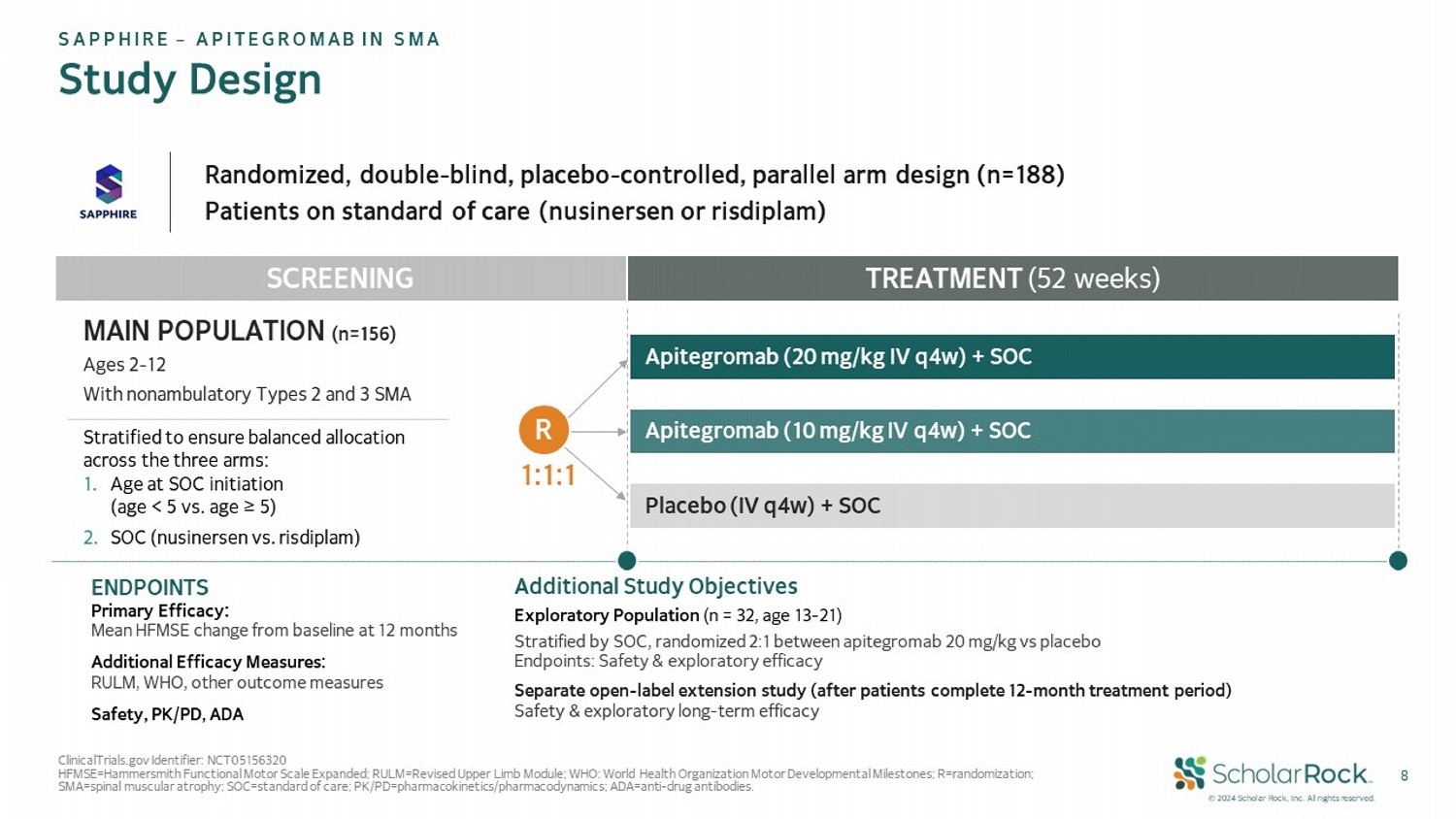
© 2024 scholar rock,Inc. 版權所有。 8隨機、雙盲、安慰劑對照、平行分組設計(n=188) 使用標準護理(努西耐生或林地普)的患者 C治療(52周) Apitegromab(20 mg/kg 靜脈注射,每4週一次)+ SOC Apitegromab(10 mg/kg 靜脈注射,每4週一次)+ SOC 安慰劑(每4週一次靜脈注射)+ SOC 篩查及終點 主要有效性:12個月時基線HFMSE的均值變化 附加有效性測量:RULm,WHO,其他結果測量 安全性、PK/PD、ADA 附加研究目標 探索性人口(n = 32,年齡13-21) 按SOC分層,隨機2:1分配到 apitegromab 20 mg/kg vs 安慰劑 終點:安全性和探索性有效性 單獨的開放式延伸研究(在患者完成12個月的治療期後) 安全性和探索性長期有效性 ClinicalTrials.gov 標識符:NCT05156320 HFMSE=漢默史密斯功能性運動量表擴展版;RULM=修訂上肢模塊;WHO: 世界衛生組織運動發展里程碑;R=隨機化;SMA=脊髓肌肉萎縮;SOC=標準護理;PK/PD=藥代動力學/藥效學;ADA=抗藥物抗體。 盛世企業 – Apitegromab 在SMA研究的設計 主要人口(n=156) 2-12歲的不會走路的2型和3型SMA 按以下方式分層以確保在三個分組之間平衡分配: 1. SOC啓動時的年齡(年齡<5 和 年齡≥5) 2. SOC(努西耐生 vs 林地普) 1:1:1

© 2024 scholar rock, inc. 版權所有。9 預先確定的統計分析計劃 盛世企業 – APITEGROMAb IN SMA Apitegromab (20 毫克/公斤) + 標準治療 Apitegromab (10 毫克/公斤) + 標準治療 安慰劑 + 標準治療 R 1:1:1 • 預先確定的分析以評估劑量: 組合 apitegromab 劑量 (10 毫克/公斤 + 20 毫克/公斤), 20 毫克/公斤 和 10 毫克/公斤; 根據 TOPAZ 的見解,預計 10 毫克/公斤 和 20 毫克/公斤 是類似 的 • 主要確證測試評估 HFMSE 在組合劑量和 20 毫克/公斤同時進行的 Hochberg,隨後是 RULm, HFMSE ≥ 3 比例,WHO 用於 20 毫克/公斤,然後是 HFMSE, RULm, HFMSE ≥ 3, WHO 用於 10 毫克/公斤的劑量,按照分層順序 主要目標 評估 apitegromab 與安慰劑在使用 HFMSE 上的療效 患者爲 2 到 12 歲 預先確定的分析 使用 Hochberg 過程(Hochberg 1988)進行測試: 1) apitegromab 組合劑量(10 毫克/公斤 和 20 毫克/公斤)與安慰劑相比,以及 2) apitegromab 20 毫克/公斤劑量與安慰劑同時用於主要終點作爲主要確證測試。 分層測試程序用於考慮主要終點和關鍵次要終點的多次確證測試。 測試程序首先評估主要確證測試,然後是 apitegromab 20 毫克/公斤的關鍵次要終點分析,然後是 apitegromab 10 毫克/公斤的主要終點和關鍵次要終點分析。 SOC=標準治療 邊界 贏得主要確證測試 apitegromab 組合劑量(10 毫克/公斤 和 20 毫克/公斤)+ 標準治療 vs. 安慰劑 + 標準治療 apitegromab 20 毫克/公斤 + 標準治療 vs. 安慰劑 + 標準治療 一個 p - 值 ≤ 0.025 其他 p - 值 > 0.05 或 兩個 p - 值 ≤ 0.05
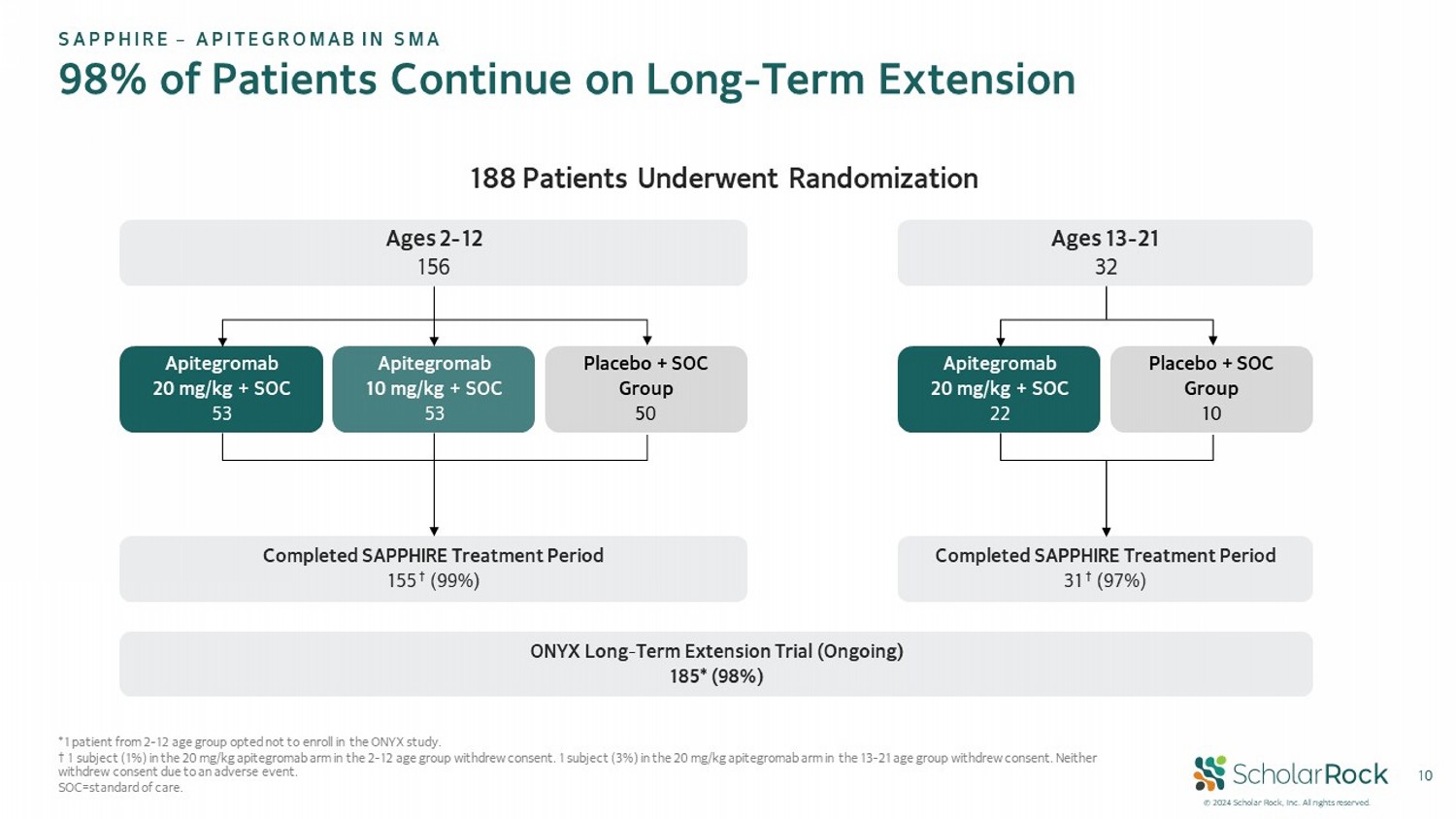
© 2024 scholar rock,Inc。保留所有權利。10 *1名年齡在2至12歲之間的患者選擇不參加ONYX研究。†在20毫克/千克apitegromab組中,年齡在2至12歲之間的1名受試者(1%)撤回同意。在13至21歲的20毫克/千克apitegromab組中,1名受試者(3%)撤回同意。兩者均不是由於不良事件而撤回同意。SOC=標準護理。188名年齡在2至12歲之間的患者接受了隨機分組,156名完成了SAPPHIRE治療期,155名†(99%)20毫克/千克apitegromab + SOC,53名10毫克/千克apitegromab + SOC,53名安慰劑 + SOC組,50名年齡在13至21歲之間,32名完成了SAPPHIRE治療期,31名†(97%)20毫克/千克apitegromab + SOC,22名安慰劑 + SOC組,10名SAPPHIRE – 鈎蛋白20在SMA中,98%的患者繼續進行長期延伸研究ONYX長期延伸試驗(進行中),185*(98%)
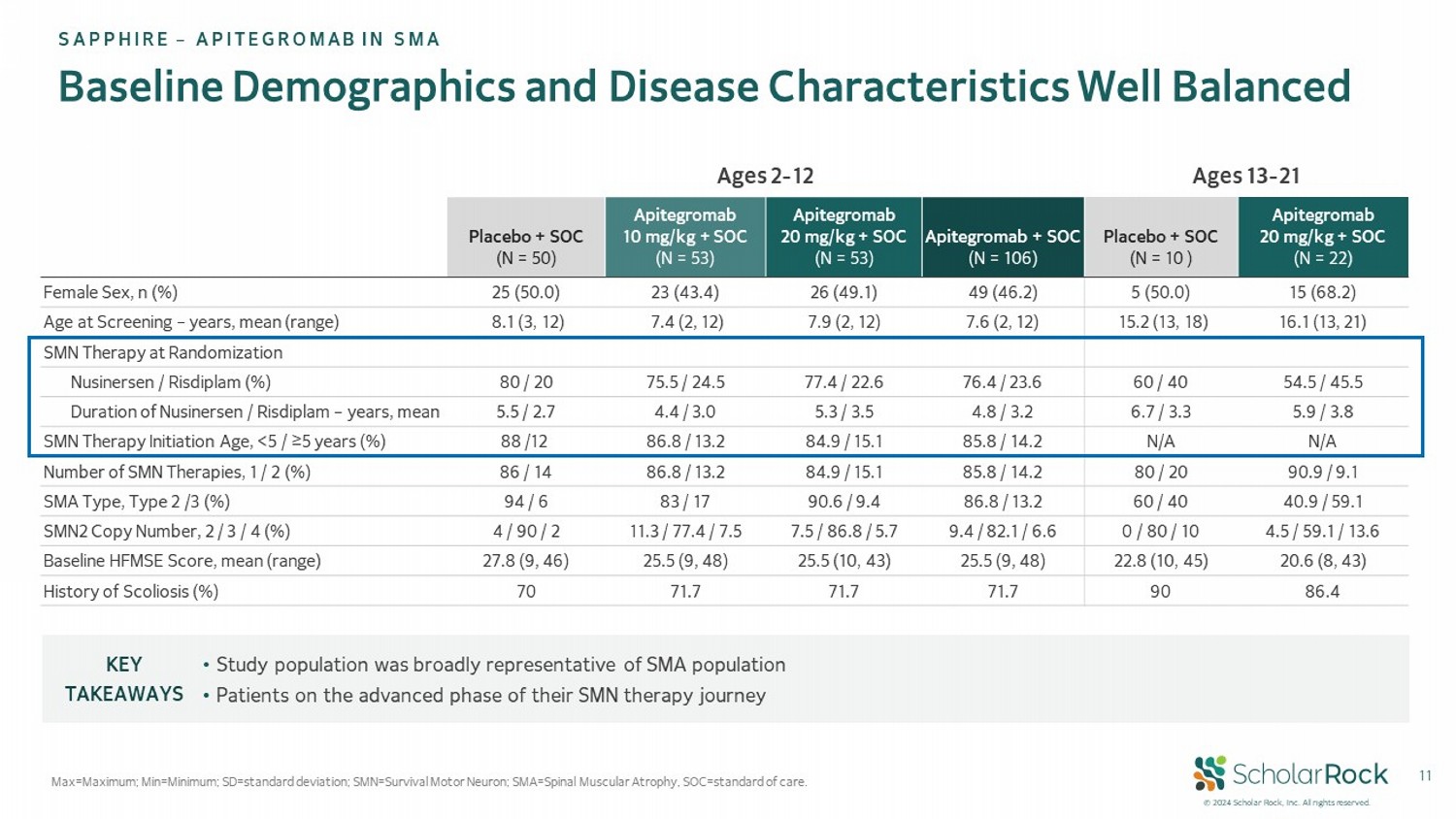
© 2024 scholar rock,Inc. 版權所有。11基線人口統計學和疾病特徵均衡 Max=最大值; Min=最小值; SD=標準偏差; SMN=存活運動神經元; SMA=脊髓肌肉萎縮,SOC=標準護理。盛世企業 - APITEGROMAb用於SMA年齡13-21年齡2-12 Apitegromab 20 mg/kg + SOC(N=22) 安慰劑+ SOC(N=10) Apitegromab + SOC(N=106) Apitegromab 20 mg/kg + SOC(N=53) Apitegromab 10 mg/kg + SOC(N=53) 安慰劑+ SOC(N=50) 15(68.2) 5(50.0) 49(46.2) 26(49.1) 23(43.4) 25(50.0) 女性,n(%) 16.1(13,21) 15.2(13,18) 7.6(2,12) 7.9(2,12) 7.4(2,12) 8.1(3,12) 年齡在檢驗時 - 平均年齡(區間) SMN療法隨機分配 54.5/45.5 60/40 76.4/23.6 77.4/22.6 75.5/24.5 80/20 Nusinersen / Risdiplam(%) 5.9/3.8 6.7/3.3 4.8/3.2 5.3/3.5 4.4/3.0 5.5/2.7 Nusinersen / Risdiplam持續時間 - 平均年數 N/A N/A 85.8/14.2 84.9/15.1 86.8/13.2 88/12 SMN療法開始年齡,<5 / ≥5歲(%) 90.9/9.1 80/20 85.8/14.2 84.9/15.1 86.8/13.2 86/14 SMN治療次數,1/2(%) 40.9/59.1 60/40 86.8/13.2 90.6/9.4 83/17 94/6 SMA類型,類型2/3(%) 4.5/59.1/13.6 0/80/10 9.4/82.1/6.6 7.5/86.8/5.7 11.3/77.4/7.5 4/90/2 SMN2拷貝數,2/3/4(%) 20.6(8,43) 22.8(10,45) 25.5(9,48) 25.5(10,43) 25.5(9,48) 27.8(9,46) 基線HFMSE得分,平均值(範圍) 86.4 90 71.7 71.7 71.7 70 脊柱側彎史(%) • 研究人群在SMA人群中具有廣泛代表性 • 處於其SMN療程高級階段的患者主要觀察內容
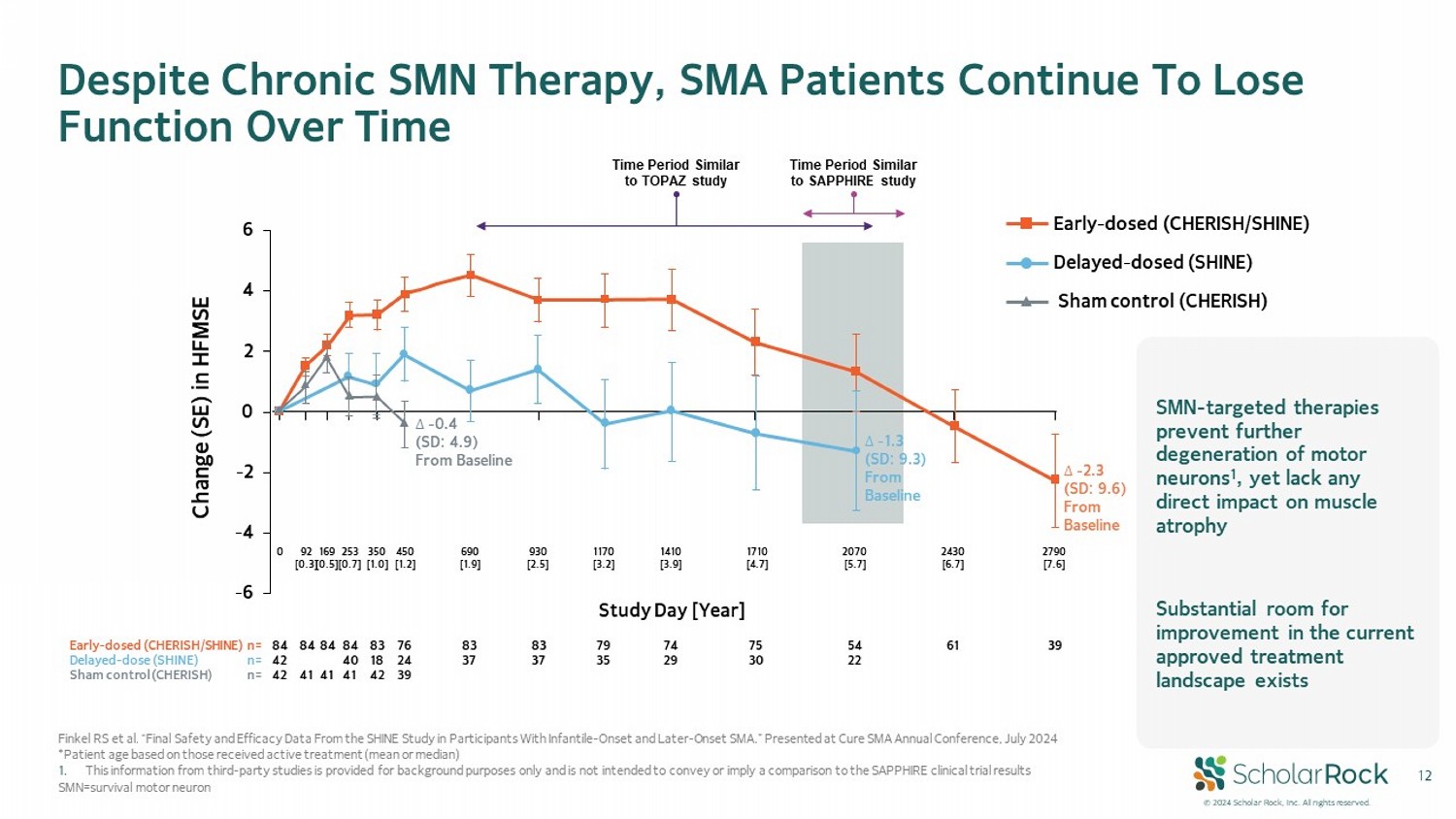
© 2024 scholar rock公司。保留所有權利。Finkel RS等人「來自SHINE研究的最終安全性和有效性數據,針對早發和晚髮型SMA患者」,於2024年7月在治癒SMA年會上展示。*患者年齡基於接受積極治療的人群(均值或中位數)1. 這些來自第三方研究的信息僅供背景參考,不旨在傳達或暗示與SAPPHIRE臨床試驗結果的比較。SMN=存活運動神經元雖然進行了慢性SMN治療,SMA患者仍然隨着時間的推移失去功能。早期劑量(CHERISH/SHINE)延遲劑量(SHINE)安慰對照(CHERISH)-6 -4 -2 0 2 4 6 ο - 1.3(標準差:9.3)從基線 ο - 2.3(標準差:9.6)從基線 ο - 0.4(標準差:4.9)從基線 研究日[年] HFMSE變化(SE) 早期劑量(CHERISH/SHINE)n= 延遲劑量(SHINE)n= 安慰對照(CHERISH)n= 84 42 42 84 41 84 41 84 40 41 83 18 42 76 24 39 83 37 83 37 79 35 74 29 75 30 54 22 61 39 0 92 [0.3] 169 [0.5] 253 [0.7] 350 [1.0] 450 [1.2] 690 [1.9] 930 [2.5] 1170 [3.2] 1410 [3.9] 1710 [4.7] 2070 [5.7] 2430 [6.7] 2790 [7.6] 時間段類似於TOPAZ研究 時間段類似於SAPPHIRE研究 SMN靶向治療可以阻止運動神經元的進一步退化,但對肌肉萎縮沒有直接影響。當前已批准治療領域仍有很大的改進空間。
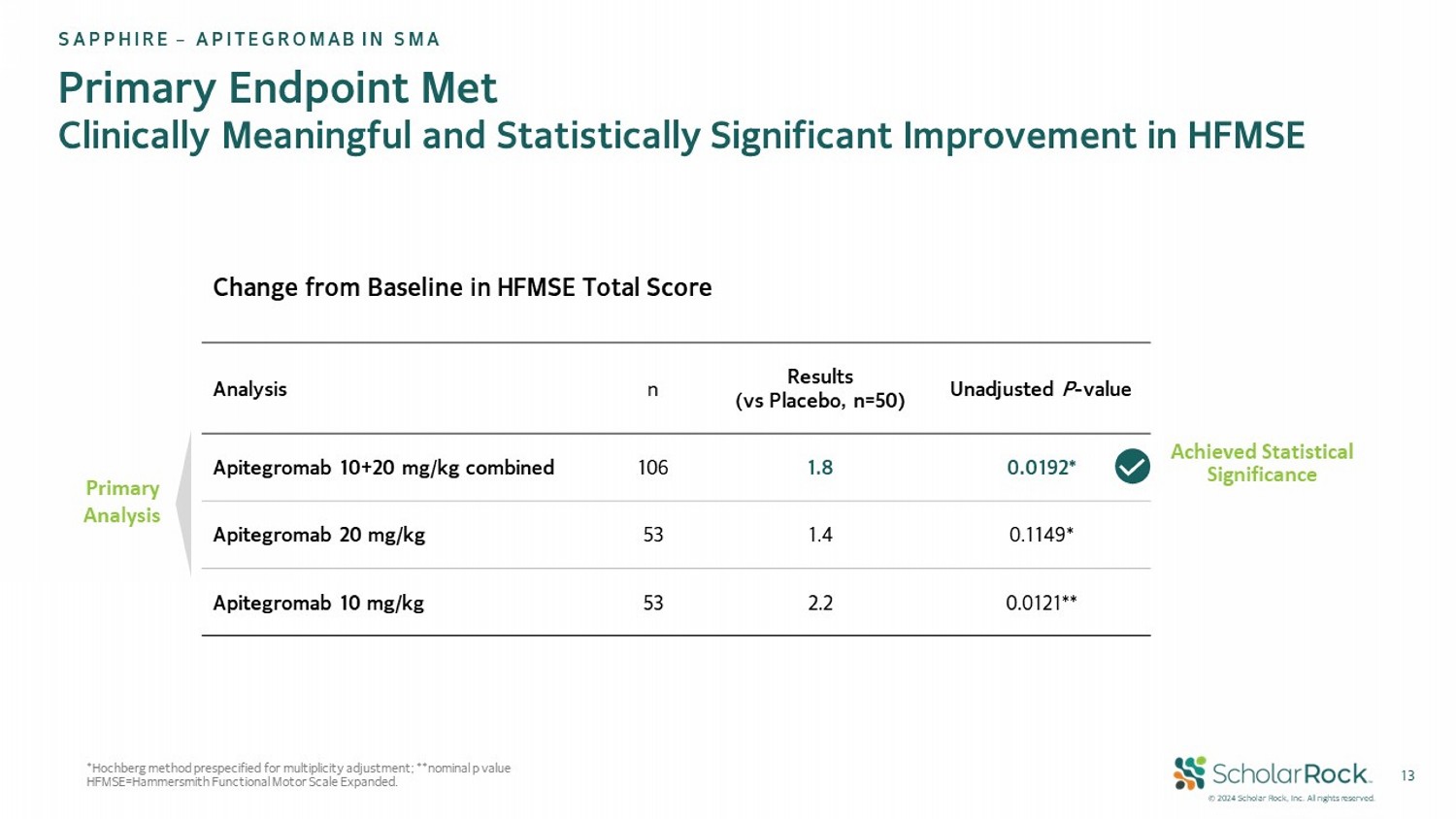
Ⓒ2024 scholar rock, Inc. 版權所有。 13 * Hochberg 方法預先指定用於多重性調整; ** 零假設 p值 HFMSE=哈默史密斯功能性運動量表擴展。 未調整 P - 值結果(對照組,n=50)n 分析 0.0192 * 1.8 106 apitegromab 10+20 毫克/公斤聯合 0.1149 * 1.4 53 apitegromab 20 毫克/公斤 0.0121 ** 2.2 53 apitegromab 10 毫克/公斤 HFMSE 總分終點的基線變化 主要終點 在HFMSE盛世企業-APITEGROMAb治療SMA方面在一級分析達到了統計學意義的臨床意義和統計學意義的改善
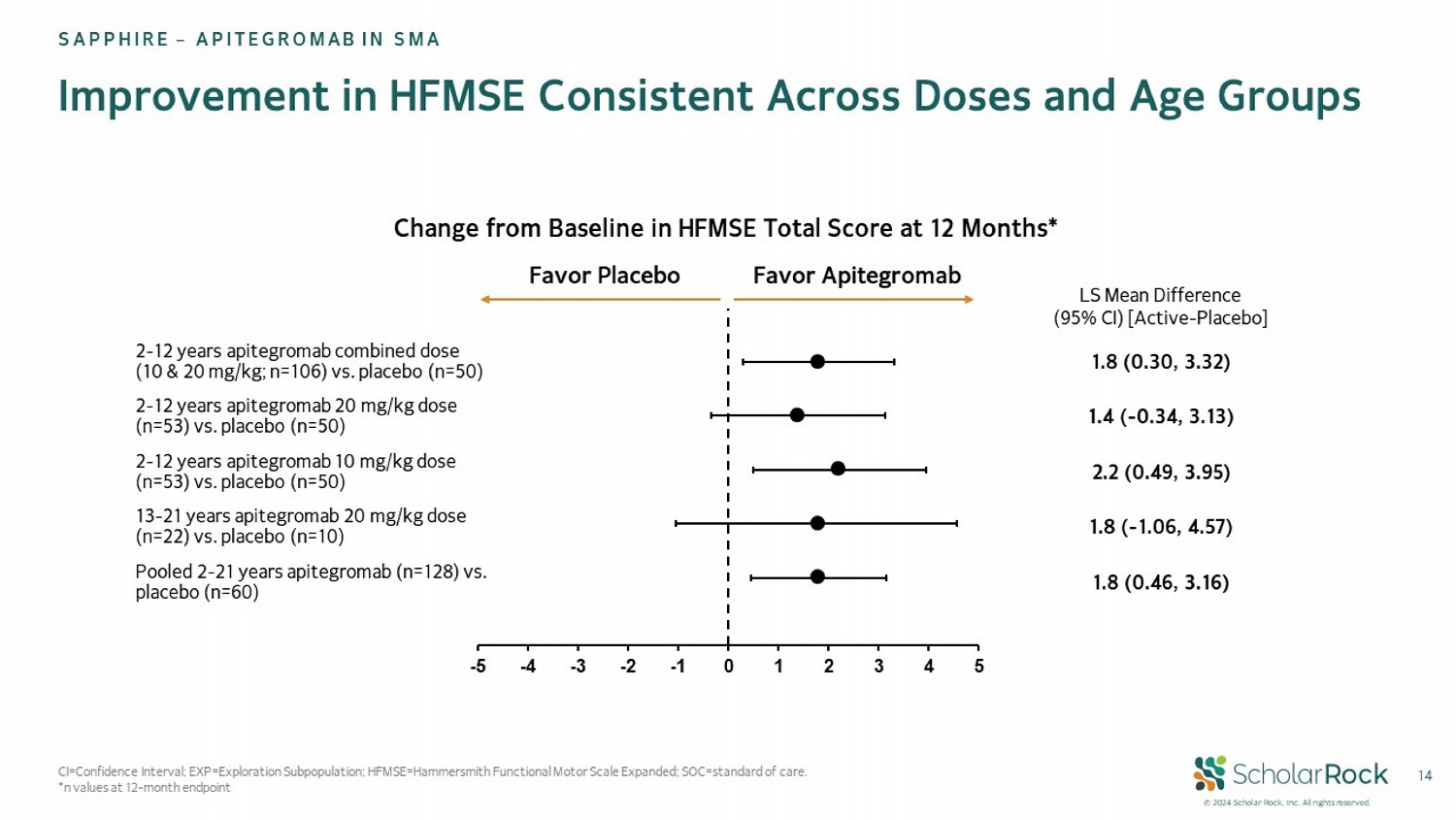
©2024Scholar Rock, Inc.保留所有權利。-5 -4 -3 -2 -1 0 1 2 3 4 5 14年HFMSE改善在劑量和年齡組間保持一致盛世企業 – SMA中APITEGROMAb LS均值差異(95% CI) [活性藥物 - 安慰劑] 1.8 (0.30, 3.32) 2 - 12歲apitegromab聯合劑量 (10 & 20 mg/kg; n=106) vs. 安慰劑 (n=50) 1.4 ( - 0.34, 3.13) 2 - 12歲apitegromab 20 mg/kg劑量 (n=53) vs. 安慰劑 (n=50) 2.2 (0.49, 3.95) 2 - 12歲apitegromab 10 mg/kg劑量 (n=53) vs. 安慰劑 (n=50) 1.8 ( - 1.06, 4.57) 13 - 21歲apitegromab 20 mg/kg劑量 (n=22) vs. 安慰劑 (n=10) 1.8 (0.46, 3.16) 合併 2 - 21歲apitegromab (n=128) vs. 安慰劑 (n=60) 贊成Apitegromab 贊成安慰劑12個月HFMSE總分的基線變化* CI=置信區間; EXP=探索子群; HFMSE=哈默史密斯功能運動量表擴展; SOC=標準護理。*12個月終點n值
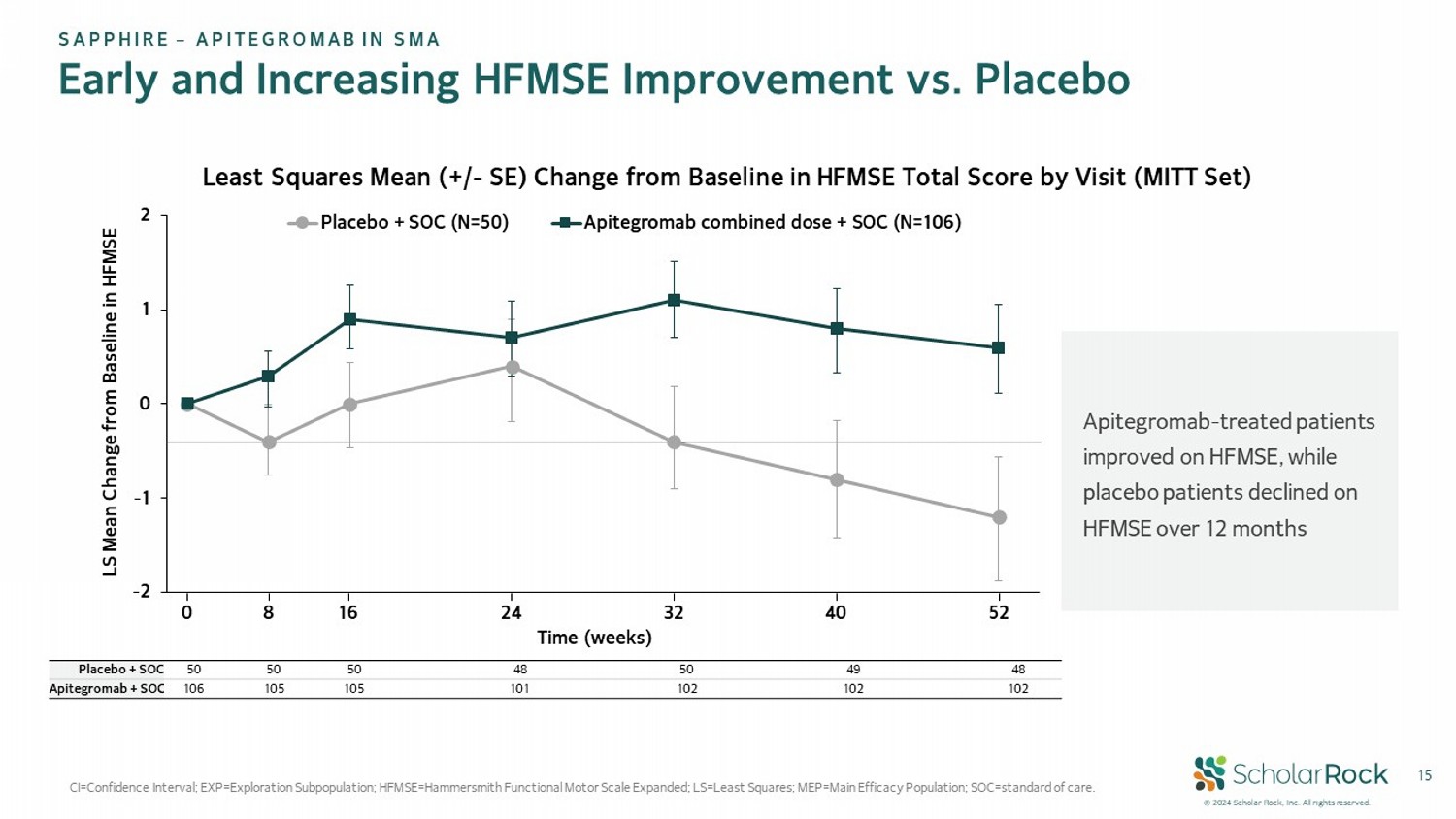
© 2024 scholar rock, Inc. 版權所有。15 CI=置信區間;EXP=探索亞群;HFMSE=哈默史密斯功能性運動量表擴展版;LS=最小二乘;中單 EP= 主要功效人群;SOC=常規護理。盛世企業 – APITEGROMAb在SMA早期及逐漸增加的HFMSE改善vs.安慰劑最小二乘均值(+/ - SE)訪問基線HFMSE總分變化(MITt設定) Apitegromab治療患者 在HFMSE上有所改善,而 安慰劑患者在 HFMSE上在12個月內下降-2 -1 0 1 2 安慰劑 + SOC(N=50) Apitegromab聯合劑量+SOC(N=106) 0 8 16 24 32 40 時間(周)52 LS均值與基線HFMSE的變化48 49 50 48 50 50 50 安慰劑+SOC 102 102 102 101 105 105 106 Apitegromab+SOC
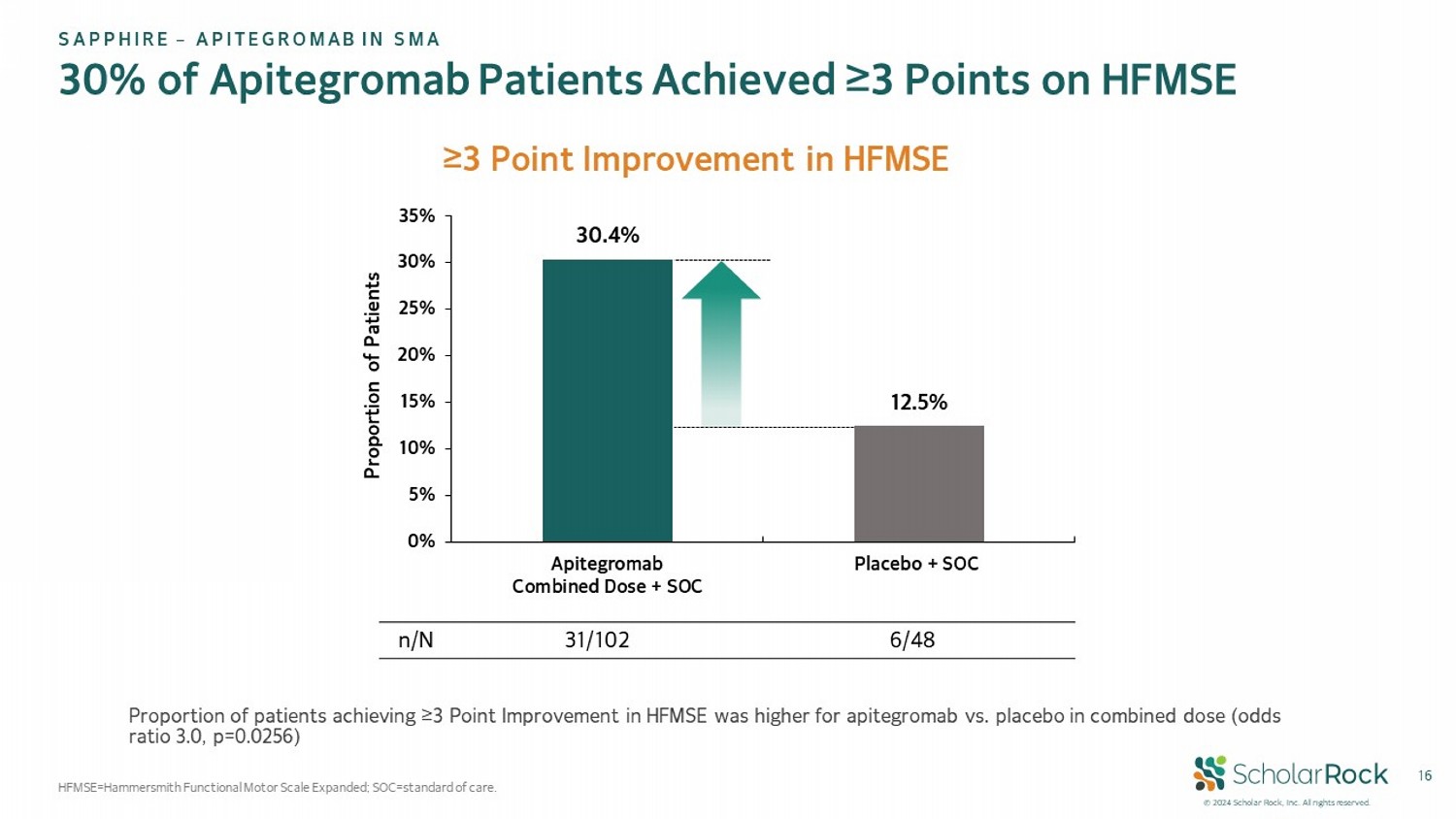
© 2024 scholar rock,Inc. 版權所有。 Apitegromab患者中有16/30%的人在HFMSE上達到≥3分 HFMSE=漢默史密斯功能運動量表擴展; SOC = 保健標準。 盛世企業 – 在SMA中的APITEGROMAb HFMSE上≥3分改善30.4% 12.5% 0% 5% 10% 15% 20% 25% 30% 35% Apitegromab聯合劑量 + SOC 安慰劑 + SOC 患者比例 6/48 31/102 n/N 在聯合用藥中,Apitegromab的患者達到≥3分HFMSE的概率比安慰劑更高(比值比3.0,p=0.0256)
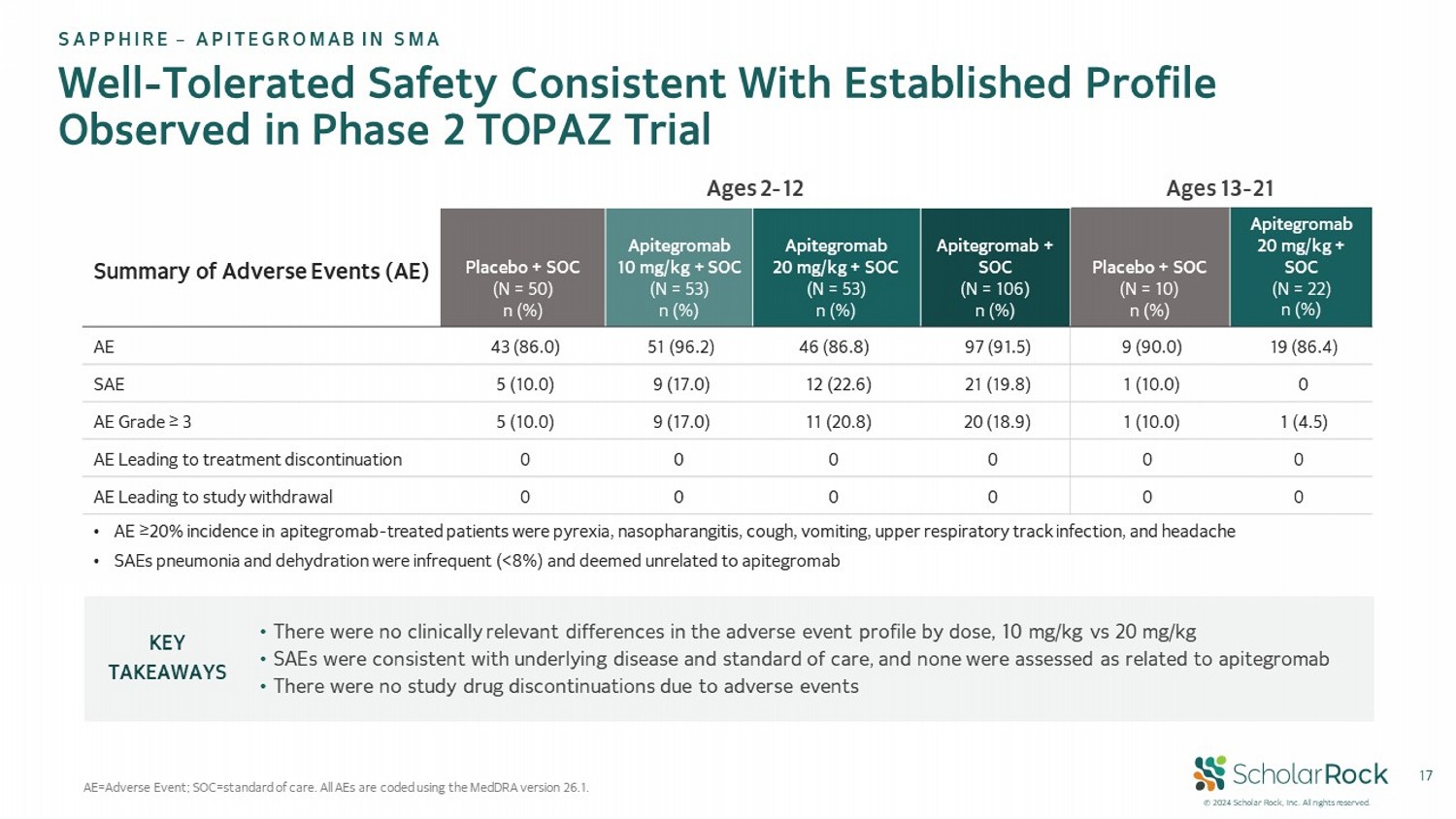
© 2024 學者石草公司。版權所有。 17 完全耐受,安全性與已建立的概況一致 觀察到的第2期TOPAZ試驗中的AE=不良事件;SOC =標準治療。 所有不良事件均使用MedDRA版本26.1編碼。 年齡爲13-21 歲年齡在2-12 歲不良事件(AE)摘要 Apitegromab 20 毫克/千克+SOC(N = 22)n (%) 安慰劑+SOC(N = 10)n (%) Apitegromab + SOC(N = 106)n (%) Apitegromab 20 毫克/千克+SOC(N = 53)n (%) Apitegromab 10 毫克/千克+SOC(N = 53)n (%) 安慰劑+SOC(N = 50)n (%) 19(86.4)9(90.0)97(91.5)46(86.8)51(96.2)43(86.0) AE 0 1(10.0)21(19.8)12(22.6)9(17.0)5(10.0) SAE 1(4.5)1(10.0)20(18.9)11(20.8)9(17.0)5(10.0) AE 等級≥3 0 0 0 0 0 0 AE 導致治療終止 0 0 0 0 0 0 AE 導致研究退出 • 在劑量方面,10 毫克/千克與 20 毫克/千克之間的不良事件概況沒有臨床相關差異• SAE與基礎疾病和標準治療一致,沒有一個被評估爲與 apitegromab 相關• 由於不良事件,沒有研究藥物終止關鍵要點 SAPPHIRE – 用於SMA的APITEGROMAb • 在 apitegromab 治療患者中發生率≥20% 的不良事件包括髮熱、鼻咽、咳嗽、嘔吐、上呼吸道感染和頭痛 • SAE 肺炎和脫水不太常見(<8%),與 apitegromab 無關
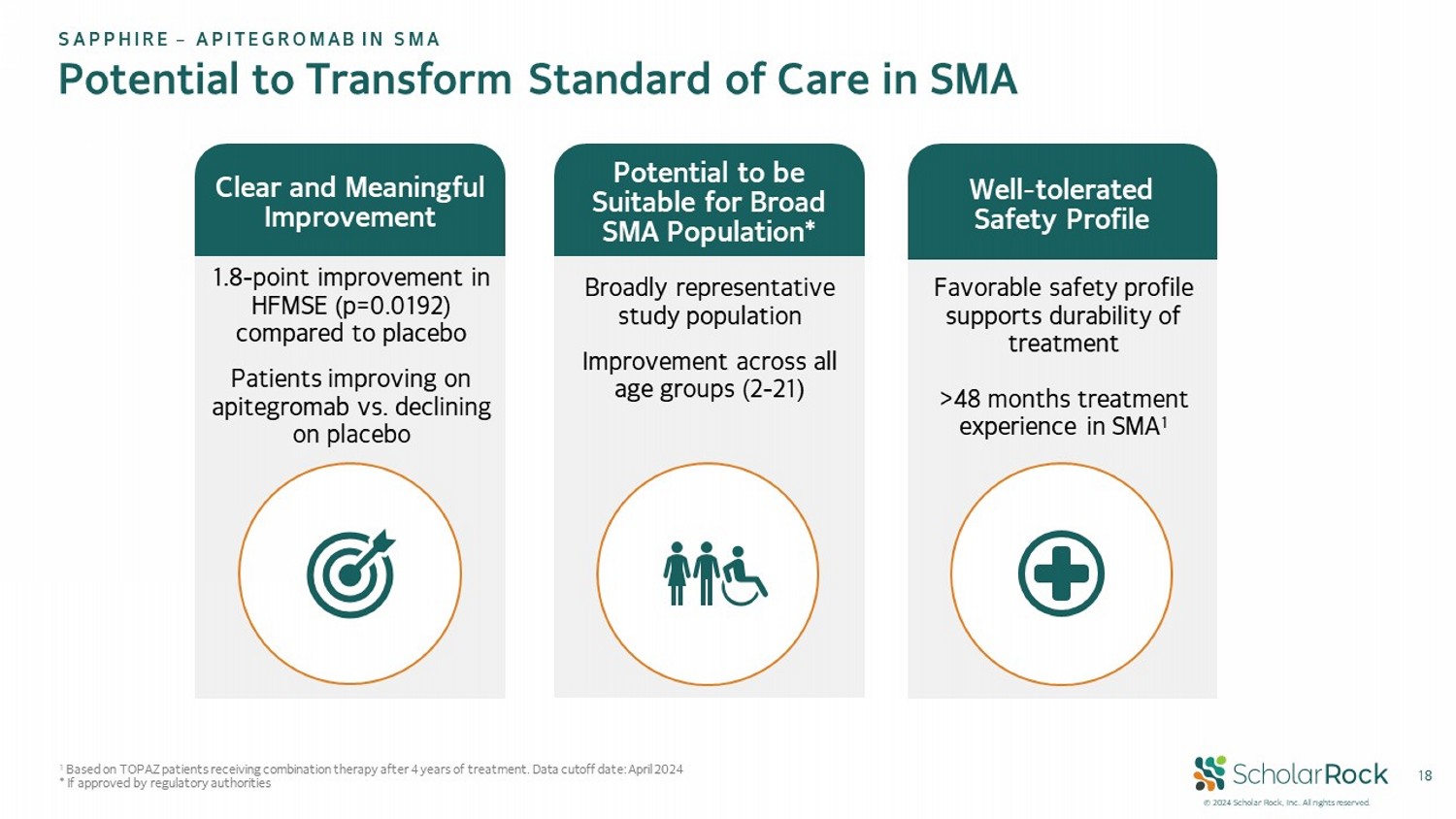
© 2024 scholar rock,Inc. 版權所有。18潛力改變SMA護理標準1.8 - HFMSE中的點改善(p=0.0192),與安慰劑相比,接受apitegromab治療的患者改善明顯,而安慰劑組患者惡化。有利的安全性概況支持治療效果的持久性超過48個月的SMA治療經驗。在所有年齡段(2 - 21歲)的研究人群中改善,具有明顯意義的改善,耐受性良好的安全性概況,潛在適用於廣泛的SMA人群*1。基於TOPAZ患者經過4年治療後接受聯合療法的數據截止日期:2024年4月*如果獲得監管機構批准,盛世企業-APITEGROMAb在SMA中

© 2024 scholar rock公司。 版權所有。Conclusion Jay Backstrom博士, MPH 總裁兼首席執行官

© 2024 學者石科技公司。保留所有權利。TGFβ=轉化生長因子 - 貝塔。我們的使命是通過利用前沿科學發現、開發和提供改變生命的治療方法,爲患有嚴重疾病的人們創造新的可能性。我們是在利用TGFβ超家族的改變生命潛力方面的全球領導者。

© 2024 學者岩石,Inc. 版權所有。學者岩石擁有業界領先、高度選擇性的抗體工程平台,取得了他人未能取得的成功。Apitegromab 是首個也是唯一一個在SMA中顯示臨床上有意義和統計學上顯著功能改善的肌肉靶向療法。Apitegromab 也是第一個也是唯一一個在關鍵第3階段研究中展示功能改善的抗肌肉生成素療法。21 創新治療脊髓肌肉萎縮症的新時代

© 2024 學者石藥,保留所有權利。在所有年齡段(2-21歲)中表現出一致且具有臨床意義的22%持續的益處,有利的安全性概況與在Phase 2 TOPAZ試驗中超過48個月的經驗一致,apitegromab患者中有30%在HFMSE中獲得≥3點改進(p=0.0192),與安慰劑相比在HFMSE中有1.8點的改進*。滿足主要終點:Apitegromab有潛力改變SMA的標準治療。學者石藥正急速努力將apitegromab帶給SMA患者。*基於apitegromab聯合劑量(10mg/kg和20mg/kg)+ SOC與安慰劑+ SOC對照†12.5%接受安慰劑+ SOC的患者獲得HFMSE中≥3點改善。SOC=標準治療(即nusinersen或risdiplam)

© 2024 scholar rock, Inc. 版權所有。23個即將到來的關鍵里程碑計劃 • 如果得到相關衛生管理機構批准 • 在2025年第一季度提交FDA和EMA申請 • 申請優先審查(FDA)和加速評估(EMA)Apitegromab監管提交 • 美國於2025年第四季度推出,歐盟隨後推出Apitegromab商業上市SMA*。 • 肥胖:預計2025年第二季度EMBRAZE結果出爐 • SMA:計劃於2025年中期啓動對2歲以下兒童的研究。肌骨細胞生長抑素臨床動力

© 2024 學者之石股份有限公司。保留所有權利。問答環節 24

© 2024 學者石, 公司。保留所有權利。 25 謝謝!

© 2024 scholar rock, Inc. 版權所有。26 附錄
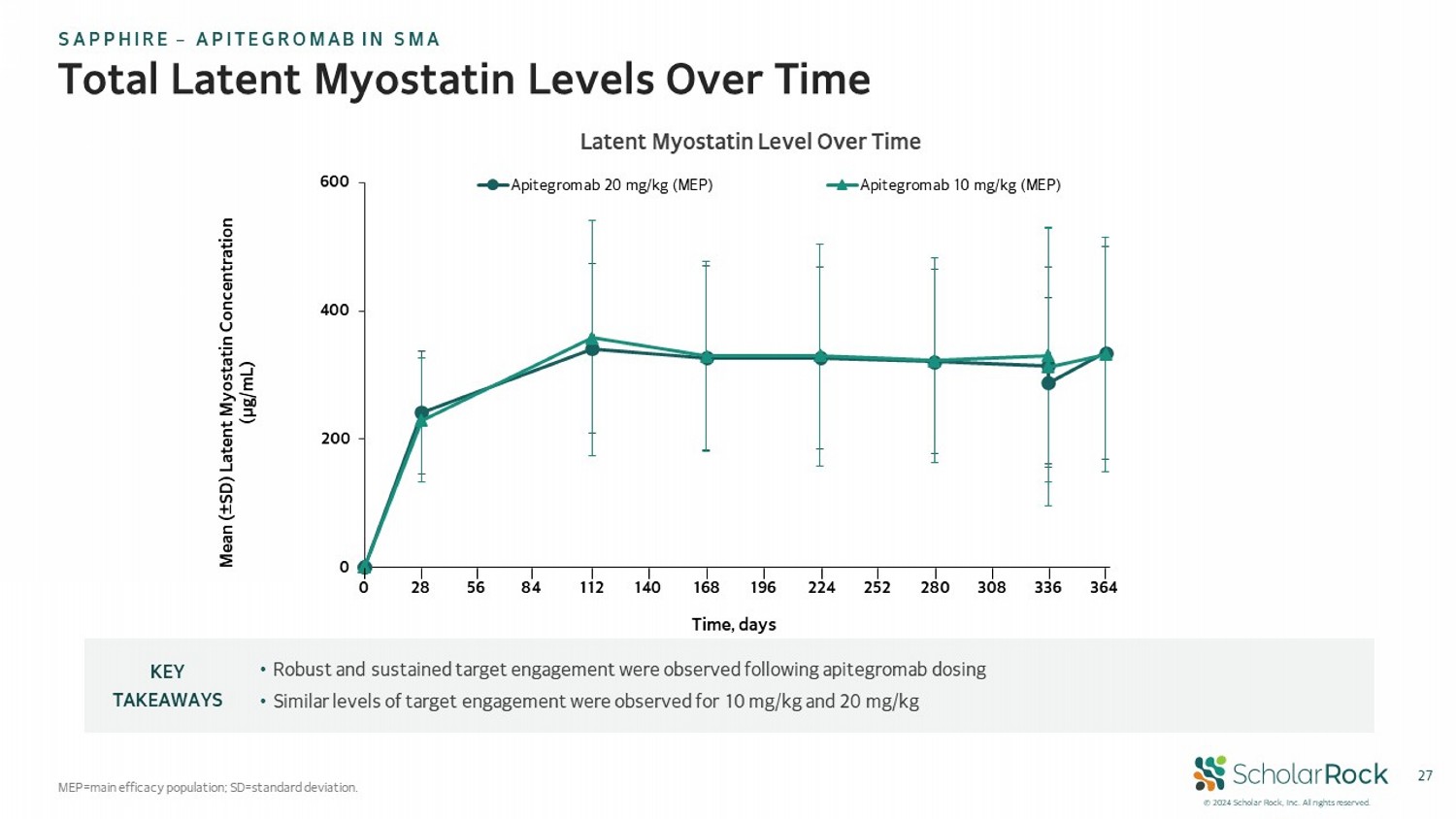
© 2024 scholar rock,Inc。保留所有權利。27總潛在肌肉生成素水平隨時間變化 MEP=主要有效人群;SD=標準差。• 在應用apitegromab後觀察到強大且持續的靶點結合• 觀察到10 mg/kg和20 mg/kg的類似水平的靶點結合關鍵要點隨時間變化的潛在肌肉生成素水平 0 200 400 600 Apitegromab 20 mg/kg(MEP) Apitegromab 10 mg/kg(MEP) 均值(±標準差)肌肉生成素濃度(µg/mL) 時間,天 0 28 168 308 336 364 56 84 112 140 196 224 252 280 盛世企業 - SMA中的APITEGROMAb
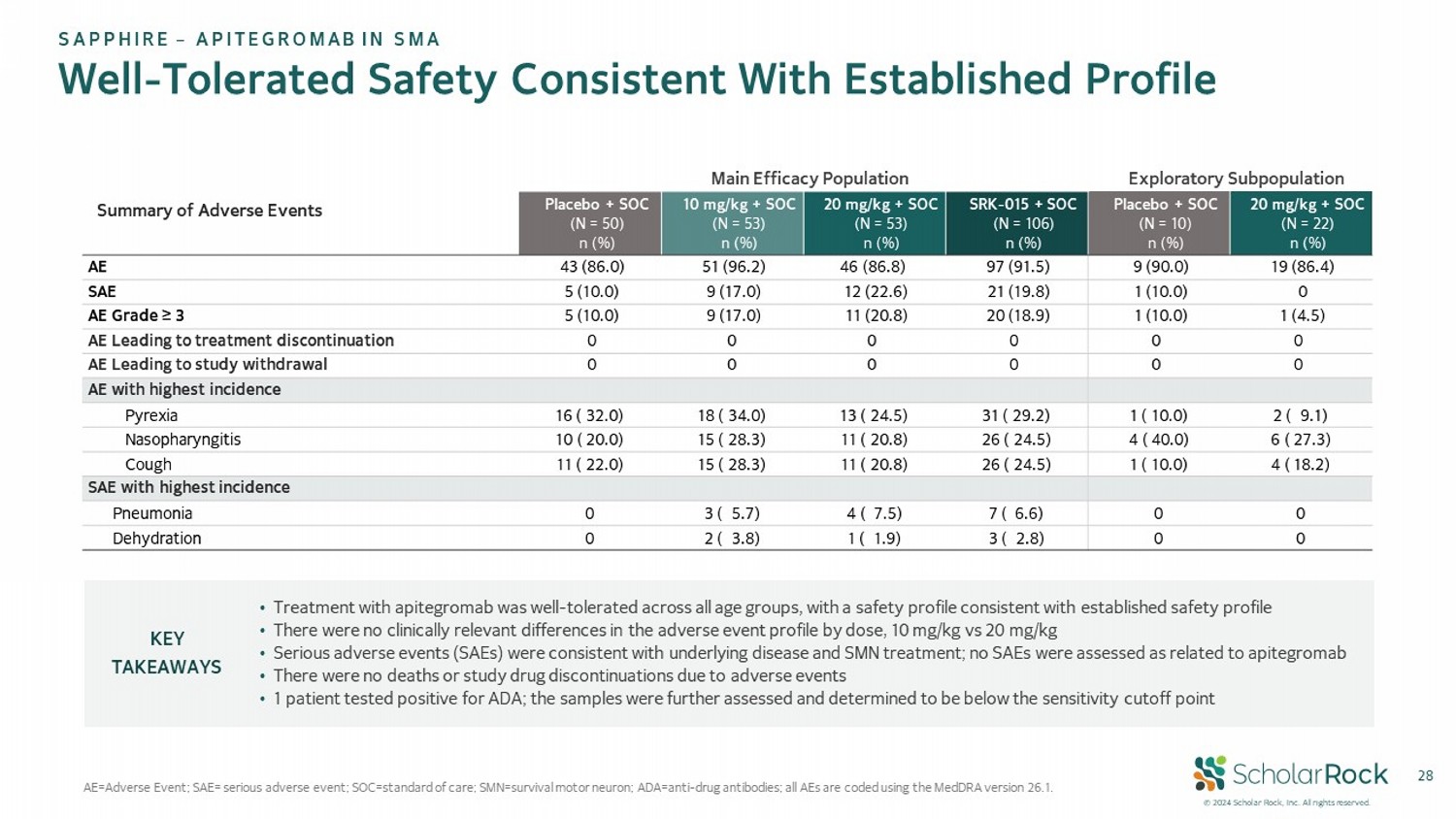
© 2024 scholar rock,Inc。保留所有權利。28劑量耐受性符合已建立的安全性剖面 AE = 不良事件; SAE= 嚴重不良事件; SOC=治療標準; SMN= 生存運動神經元; ADA= 抗藥物抗體; 所有不良事件 使用 MedDRA 版本 26.1 編碼 探索亞群體主要療效人口不良事件總結 20毫克/千克 + SOC(N = 22) n (%) 安慰劑 + SOC(N = 10) n (%) SRk - 015 + SOC(N = 106) n (%) 20毫克/千克 + SOC(N = 53) n (%) 10毫克/千克 + SOC(N = 53) n (%) 安慰劑 + SOC(N = 50) n (%) 19( 86.4) 9( 90.0) 97( 91.5) 46( 86.8) 51( 96.2) 43( 86.0) 不良事件 0 1( 10.0) 21( 19.8) 12( 22.6) 9( 17.0) 5( 10.0) 嚴重不良事件 1( 4.5) 1( 10.0) 20( 18.9) 11( 20.8) 9( 17.0) 5( 10.0) 不良事件等級 ≥ 3 0 0 0 0 0 0 導致治療中斷的不良事件 0 0 0 0 0 0 導致研究退出的不良事件 發生率最高的不良事件 2( 9.1) 1( 10.0) 31( 29.2) 13( 24.5) 18( 34.0) 16( 32.0) 發熱 6( 27.3) 4( 40.0) 26( 24.5) 11( 20.8) 15( 28.3) 10( 20.0) 鼻咽炎 4( 18.2) 1( 10.0) 26( 24.5) 11( 20.8) 15( 28.3) 11( 22.0) 咳嗽 發生率最高的嚴重不良事件 0 0 7( 6.6) 4( 7.5) 3( 5.7) 0 肺炎 0 0 3( 2.8) 1( 1.9) 2( 3.8) 0 脫水 • 對所有年齡組使用apitegromab的治療是耐受的,安全剖面符合已確立的安全剖面 • 不同劑量,10毫克/千克與20毫克/千克的不良事件剖面沒有臨床相關差異 • 嚴重不良事件(SAEs )與潛在疾病和SMN治療一致;未評估爲與apitegromab有關的SAEs • 沒有死亡或由於不良事件而停用研究藥物 • 有1名患者檢測出ADA陽性;進一步評估樣本後確定低於靈敏度截斷點 主要要點 盛世企業 – APITEGROMAb在脊髓性肌萎縮症中的應用