
展示文件 99.1 SER-155 第10期成果報告 日期:2024年9月12日

免責聲明前瞻性陳述此通訊包含根據1995年《私人證券訴訟改革法案》的前瞻性陳述。本通訊中的所有陳述,若與歷史事實無關則應視為前瞻性陳述,包括關於我們任何產品或產品候選藥的潛在益處;SER-155的最終安全性和有效性數據;研究結果;尋求FDA反饋的計劃;臨床數據和臨床試驗;我們開發SER-155的意向;我們尋求突破性療法認定的意圖;活性生物治療劑防止或減少感染的能力;以及前述事項的時間安排和其他非歷史事實的陳述。這些前瞻性陳述基於管理層目前的預期。這些陳述既非承諾也非保證,而涉及已知和未知的風險、不確定性和其他重要因素,可能導致我們的實際成果、表現或成就與前瞻性陳述中明示或暗示的任何未來成果、表現或成就有實質不同,包括但不限於以下內容:(1)我們遭受了重大損失,目前沒有盈利並且可能永遠無法盈利;(2)我們需要額外的資金;(3)我們的經營虧損歷史;(4)我們對債務協議的限制;(5)我們的新穎治療介入方法;(6)我們依靠第三方進行臨床試驗和製造我們的產品候選藥;(7)我們將面臨的競爭;(8)與我們的臨床試驗相關的風險;(9)FDA是否授予突破性療法認定;(10)我們保護知識產權的能力;(11)我們保留關鍵人員和管理增長能力的能力;以及(12)與出售VOWSt業務給SPN的購買協議下的提議交易相關的風險。我們在2024年8月13日提交給美國證券交易委員會(SEC)的季度報告表格10-Q中“風險因素”標題下討論的這些和其他重要因素可能導致實際成果與通訊中的前瞻性陳述所示結果有實質不同。此類前瞻性陳述代表管理層截至本通訊日期的估計。儘管我們可能選擇在未來某個時候更新此類前瞻性陳述,但我們不承擔任何此類義務,即使隨後發生的事件導致我們的觀點發生變化。不應過度依賴這些前瞻性陳述作為代表我們思想截至本通訊日期的觀點。Seres Therapeutics, Inc. © 2024 2 2

免責聲明 交易的重要資訊和相關資料在Seres Therapeutics, Inc.(“Seres”)和Société des Produits Nestlé S.A.(“SPN”)之間的交易中,Seres向證券交易委員會(“SEC”)提交了一份決定性代理聲明。Seres也可能向SEC提交其他相關材料以關於此次交易。從2024年8月26日開始,Seres向股東發送了決定性代理聲明。建議Seres的投資者和股東在這些材料可用時,仔細閱讀完整的決定性代理聲明和相關材料,因為它們包含或將包含有關Seres和所提議交易的重要資訊。投資者可以從SEC的網站www.sec.gov或Seres的網站ir.serestherapeutics.com免費獲取這些材料(當它們可用時),以及Seres與SEC提交的其他文件。徵求意見的參與者Seres和其某些董事、高級主管和其他管理員和員工可能被認為是在與所提議的交易有關的股東徵詢中徵求委託書的參與者。根據SEC的規定,可能被認為是在所提議交易中向Seres股東徵詢委託書的人的相關信息在Seres的股東大會的決定性代理聲明中有列出,該決定性代理聲明在2024年8月26日向SEC提交,此次交易將提交給Seres的股東以供審批。您還可以在Seres於2023年12月31日向SEC提交的年度10-k報告,於2024年3月5日向SEC提交的2024年股東大會的決定性代理聲明,以及隨後提交的8-k表和10-Q表中找到有關Seres董事和高管的附加信息。Seres Therapeutics, Inc. © 2024 33
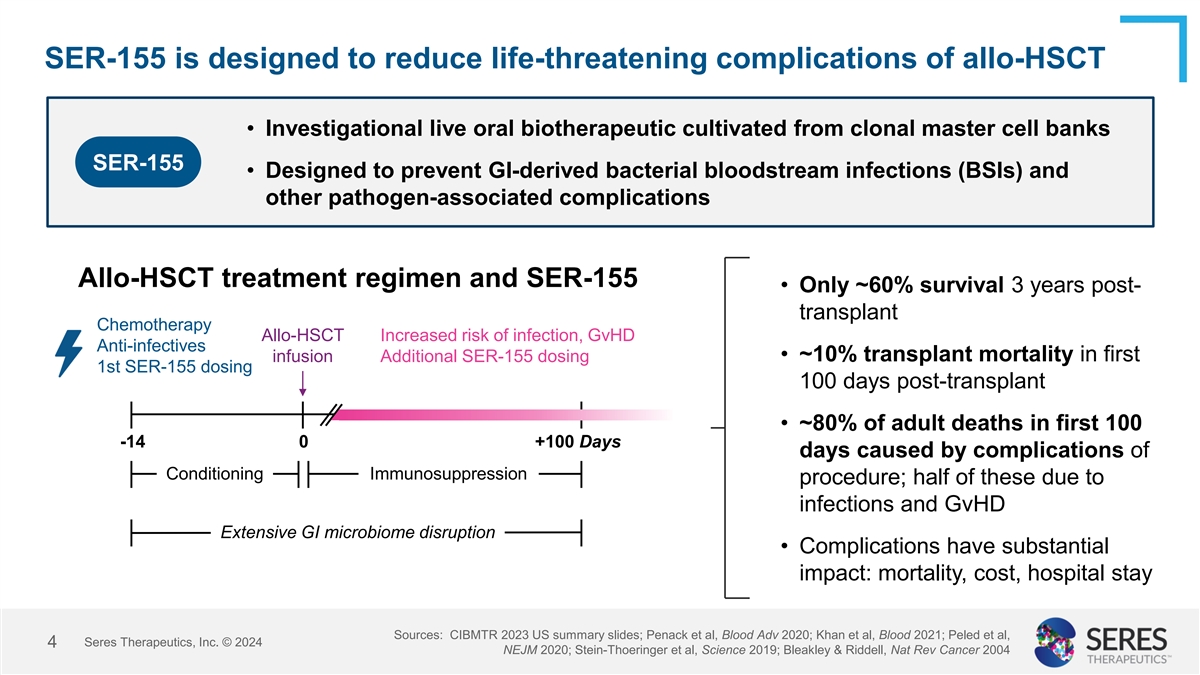
SER-155旨在減少同胞造血幹細胞移植後生命威脅性併發症 • SER-155是從克隆主細胞庫中培養而來的研究型口服生物治療品 • 旨在防止由消化道細菌引起的血源性感染(BSI)和其他病原體相關併發症 同胞造血幹細胞移植是一種治療方案,而SER-155是其一部分 • 移植後3年的存活率僅約60% 化療同胞造血幹細胞移植 • 感染和移植後干擾免疫反應風險增加 抗感染劑 • 第一次輸注中有約10%的移植死亡率 額外的SER-155劑量 • 移植後100天給予SER-155第一次劑量 • 大約80%的成年死亡病例發生在移植後的前100天,其中一半是由於併發症和移植後免疫壓制治療(GvHD)引起的感染 廣泛的消化道微生物群干擾 • 併發症對生命、成本和住院時間有重大影響 來源:CIBMTR 2023美國簡報摘要;Penack等人,Blood Adv 2020;Khan等人,Blood 2021;Peled等人,Seres Therapeutics, Inc.©2024;NEJm 2020;Stein-Thoeringer等人,Science 2019;Bleakley和Riddell,Nat Rev Cancer 2004

SER-155第10億階段研究評估了成人非配型造血幹細胞移植(allo-HSCt)受者的安全性、藥理學和療效。 COHORt 1 和 COHORt 2:開放標籤(n=15入組);安慰劑對照 1:1(n=45入組)。 SER-155和安慰劑的結果於2023年5月報告,2024年9月宣布。 主要終點:HSCt Day 100的關鍵次要終點: • 安全性和耐受性 • 臨床評估的血流感染(BSI)、胃腸道感染和≥2級急性移植物抗宿主病(aGvHD)的發生率 • SER-155細菌株著生 • 低中性粒細胞燒熱的發生率和持續時間 • 細菌病原體豐度 於2023年12月獲得美國FDA的快速通道設計,打算追求突破性療法設計。Seres Therapeutics, Inc. © 2024 5
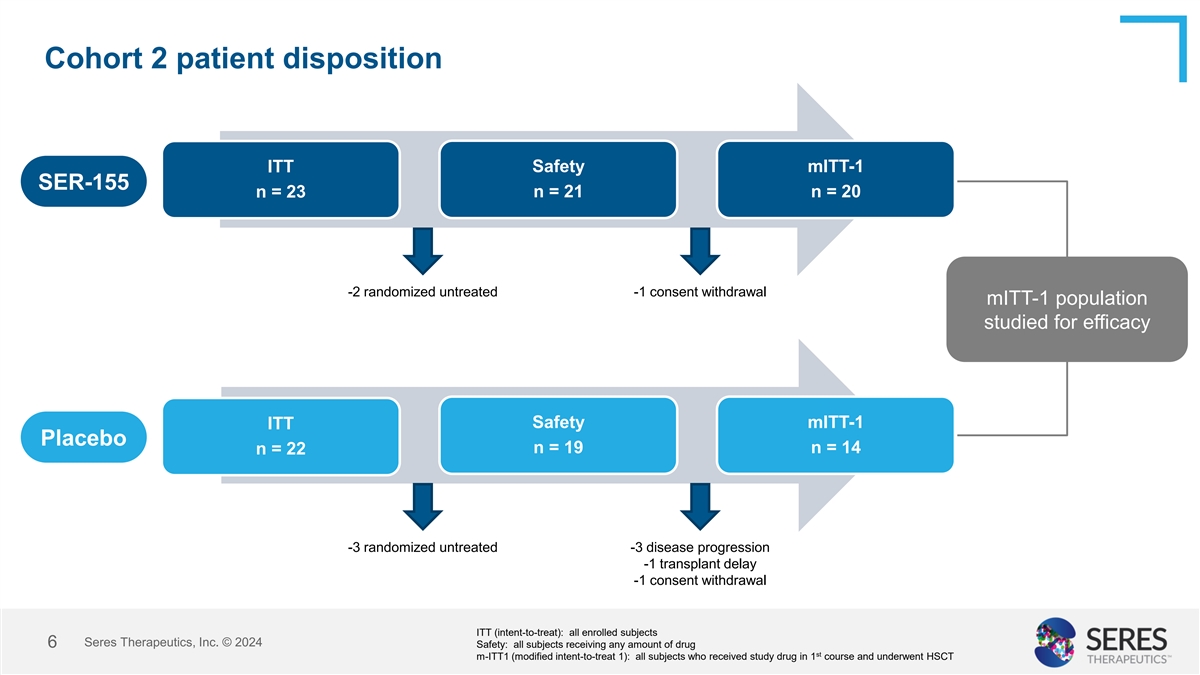
Cohort 2患者排遣 ITt安全性mITt-1 SER-155 n = 23 n = 21 n = 20 -2 隨機未經治療 -1 同意撤回 mITt-1人口研究患效安全mITt-1 ITt 安慰劑 n = 19 n = 14 n = 22 -3 隨機未經治療 -3 疾病進展 -1 移植延遲 -1 同意撤回 ITt(意圖治療):所有入編的受試者 Seres Therapeutics, Inc. © 2024 6 安全性:所有接受任何劑量藥物的受試者 st m-ITT1(修正意圖治療1):在1個課程中接受研究藥物並進行HSCT的所有受試者
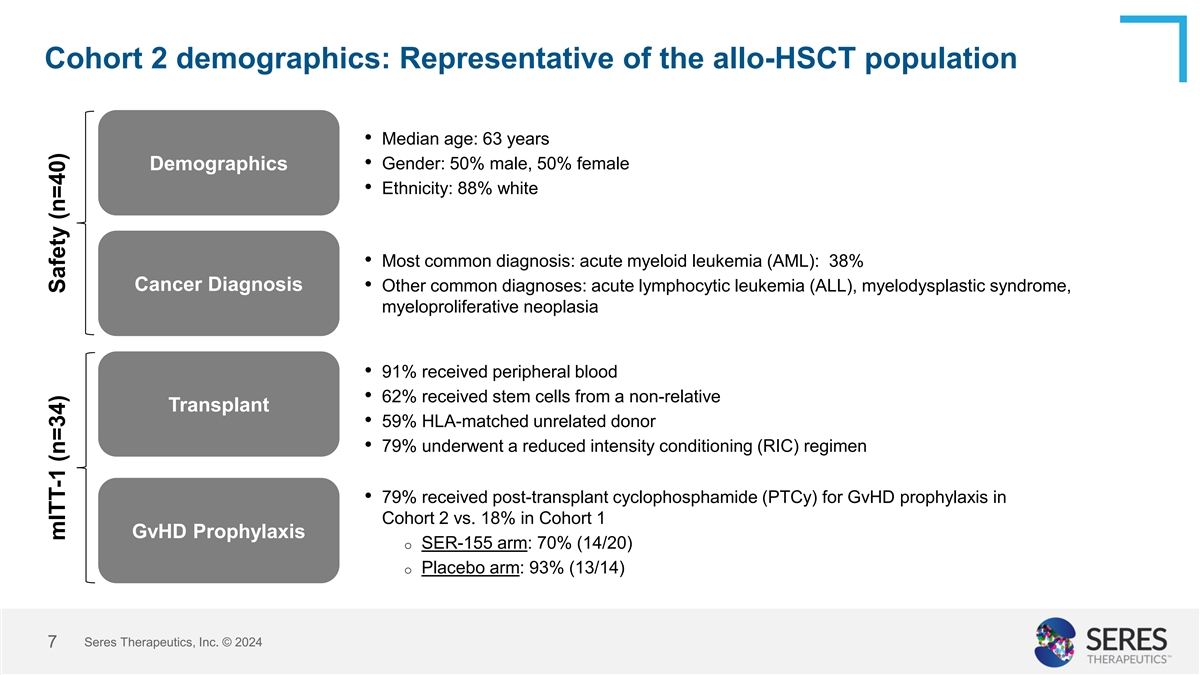
第2組人口統計:代表allo-HSCt人口 • 年齡中位數:63歲 人口統計 • 男女比例:男性50%,女性50% • 種族:白人88% • 最常見診斷:急性骨髓性白血病(AML):38% 致癌診斷 • 其他常見診斷:急性淋巴性白血病 (ALL),髓母細胞增生症,骨髓增生性腫瘤 • 91%接受外周血 • 62%接受非親屬幹細胞 移植 • 59%HLA相配的非親屬供髓者 • 79%接受減弱強度 調理(RIC)方案 • 79%在第2組使用移植後的環磷酸酰胺(PTCy)用於GvHD預防,而第1組只有18% GvHD預防 o SER-155組:70%(14/20) o 安慰劑組:93%(13/14) Seres Therapeutics, Inc. © 2024 7 mITt-1(n=34)安全性(n=40)
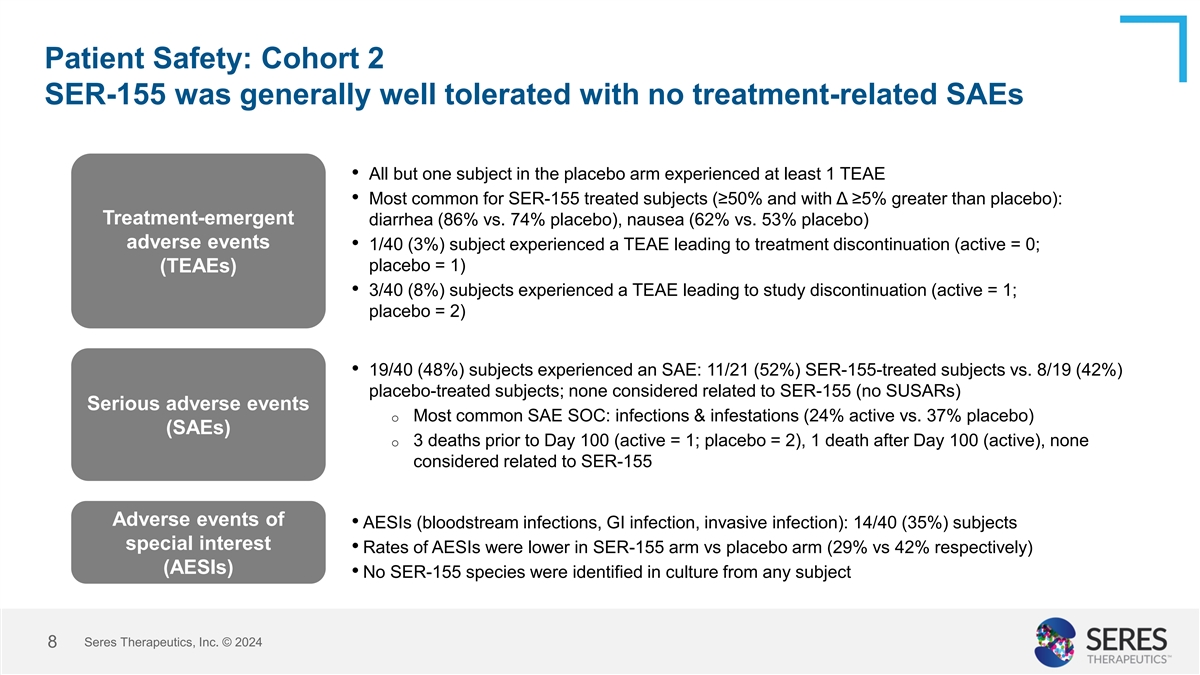
患者安全性:Cohort 2 SER-155在一般情况下耐受性良好,没有与治疗有关的不良事件。•除了一个受试者,安慰剂组的所有受试者至少出现了一个与治疗有关的不良事件。• SER-155治疗组中最常见的不良事件(≥50%且与安慰剂相比Δ≥5%):治疗中出现的腹泻(86%对74%安慰剂),恶心(62%对53%安慰剂)。• 至少1/40(3%)的受试者出现因治疗而终止的不良事件(活性=0;安慰剂=1)(TEAE)。•3/40(8%)的受试者发生了导致该研究终止的不良事件(活性=1;安慰剂=2)。•19/40(48%)的受试者出现了严重不良事件:11/21(52%)的SER-155治疗组受试者与8/19(42%)的安慰剂治疗组受试者;没有一个与SER-155有关(没有SUSAR)。严重不良事件 o 最常见的SAE SOC:感染和寄生虫感染(活性24% 对安慰剂37%)(SAEs)。o 100天之前有3例死亡(活性=1;安慰剂=2),100天之后有1例死亡(活性),没有一个与SER-155有关。• AESIs(血流感染,胃肠感染,侵袭性感染)的不良事件:14/40(35%)的受试者特殊关注• SER-155组中AESIs的发生率低于安慰剂组(分别为29%与42%)(AESIs)。• 没有发现任何受试者培养中出现SER-155株。Seres Therapeutics, Inc. © 2024 8

效力:SER-155的使用有利於顯著減少細菌性血流感染和全身性抗生素暴露;SER-155治療組血流感染受試者較安慰劑組有較低發生率的發熱性中性粒細胞減少症;所有的胃腸道感染都是CDI**;SER-155治療組有4例受試者(20%)和安慰劑組有2例胃腸道感染受試者(14.3%)在HSCt的第0-100天之間患上胃腸道感染。兩組均無受試者發生≥3 严重度急性GvHD;兩組各有2例受試者出現2级严重度急性GvHD;SER-155治療組患者對系統性抗菌藥物/抗黴菌藥物的平均累積暴露(日)顯著低於安慰劑組;SER-155治療組患者對系统性抗菌藥物/抗黴菌藥物的累積曝光率顯著低於安慰劑組;*未進行多重性調整;Seres Therapeutics, Inc. © 2024 9;**CDI:C. difficile感染;探索性次要效力
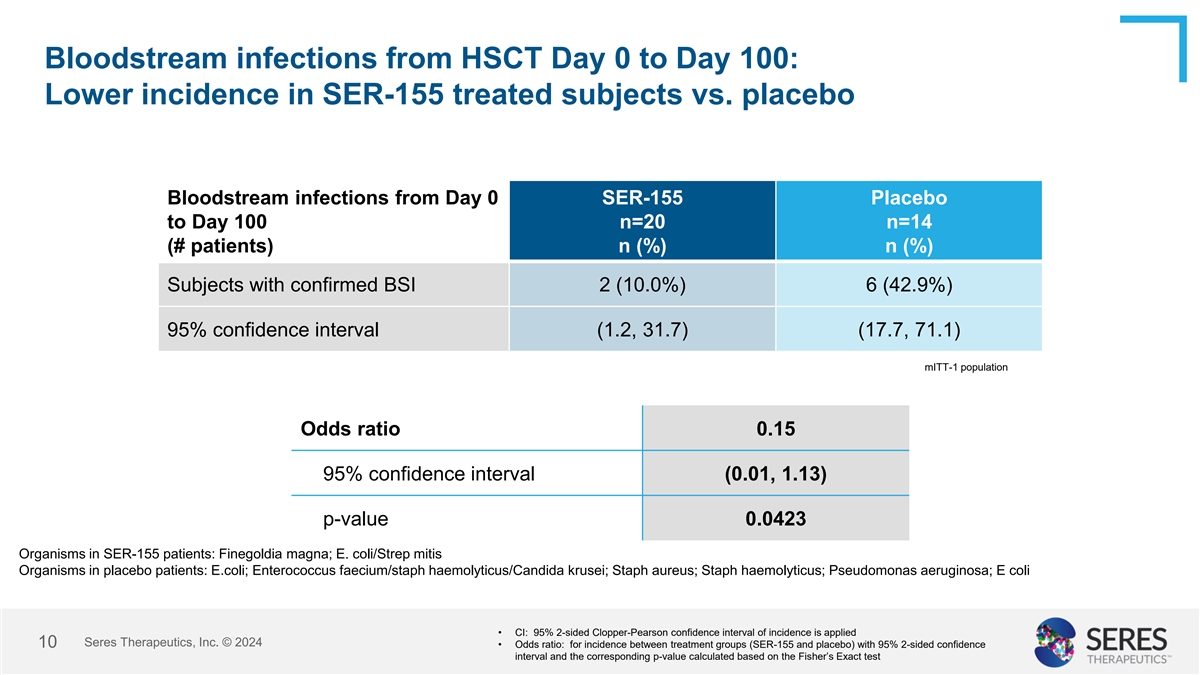
HSCt第0天到第100天的血液感染:SER-155組與安慰劑組相比,發生率較低。SER-155組第0天至第100天的血液感染,確診患者數為20例(佔受試者總數20人的百分比為10%),安慰劑組為14例(佔受試者總數14人的百分比為42.9%)。95%信賴區間(1.2,31.7)(17.7,71.1)。mITt-1人口 勝算比0.15,95%信賴區間(0.01,1.13),P值0.0423。SER-155患者中的菌株有:Finegoldia magna;大腸桿菌/Strep mitis。安慰劑組患者中的菌株有:大腸桿菌;鏈球菌輕度溶血/Candida krusei;金黃色葡萄球菌;輕度溶血球菌;綠膿桿菌;大腸桿菌。• CI:95%雙側Clopper-Pearson信賴區間,適用於發生率。Seres Therapeutics, Inc. © 2024 10 • 勝算比:(SER-155組和 安慰劑組)治療組之間的發生率,使用95%雙側信賴區間和相應的P值,根據費歇爾精確檢驗計算。
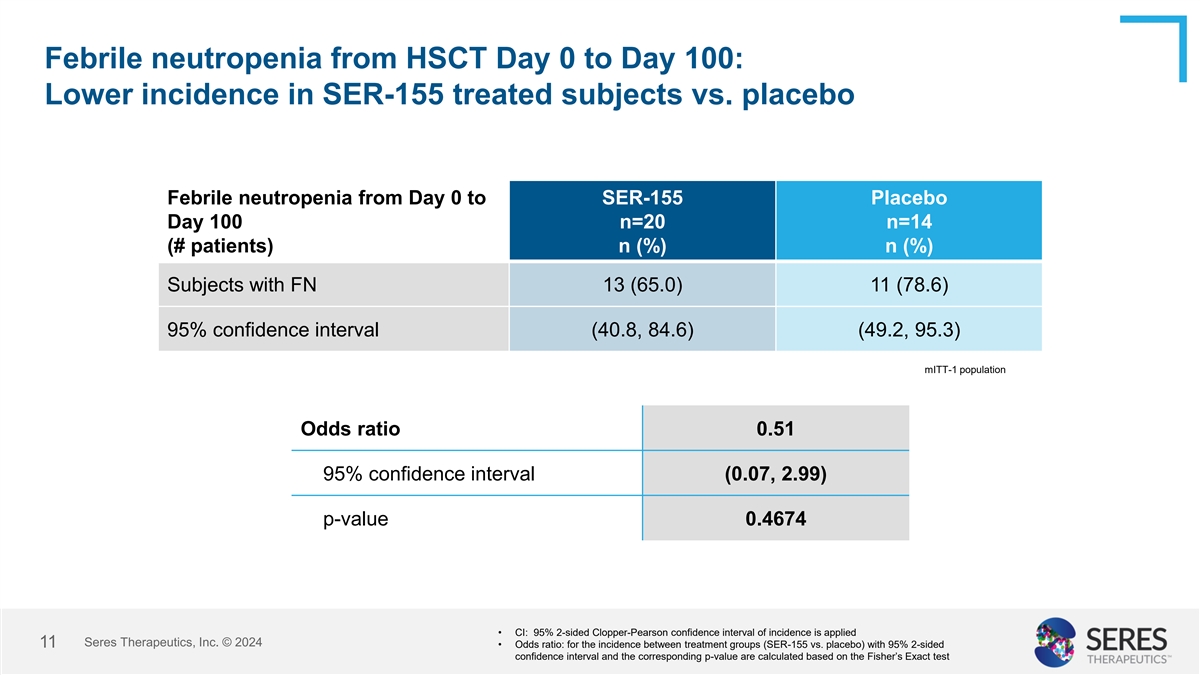
幹細胞移植後從第0天到第100天的發熱性中性粒細胞減少症:與安慰劑相比,接受SER-155治療的受試者發生率較低 第0天到第100天的發熱性中性粒細胞減少症 SER-155 安慰劑 n=20 n=14(#患者) n (%) n (%) 發生FN的受試者 13(65.0) 11(78.6) 95% 信賴區間(40.8, 84.6)(49.2, 95.3) mITt-1人群 比值比 0.51 95% 信賴區間(0.07, 2.99) p值 0.4674 • CI:95% 2側 Clopper-Pearson方法的信賴區間應用於發生率 Seres Therapeutics, Inc. © 2024 11 • 比值比:兩個治療組(SER-155 vs. 安慰劑)之間發生率的95% 2側信賴區間和相應的p值是基於費雪精確檢定計算的

SER-155處理組受試者在HSCt Day 100的總體抗生素/抗真菌劑累積曝光:與安慰劑組相比,發病率較低。抗生素或SER-155安慰劑的累積曝光 n=20 n=14(HSCt天數) n(%) n(%) 平均(標準差)9.2(5.44)21.1(20.31)中位數9.0 14.0 最小值、最大值0、19 0、74 mITt-1族群平均差異(95%CI)-11.9(-23.85,-0.04)p值0.0494 • 累積曝光是指在HSCt Day 0到Day 100之間,受試者接受系統性抗生素和/或抗真菌劑的所有天數之和;每天計算一次,不論服用的藥物數量是多少Seres Therapeutics, Inc. ©2024 12 • 基於SER-155和安慰劑之間平均天數差異的獨立樣本t檢驗的95%置信區間和p值
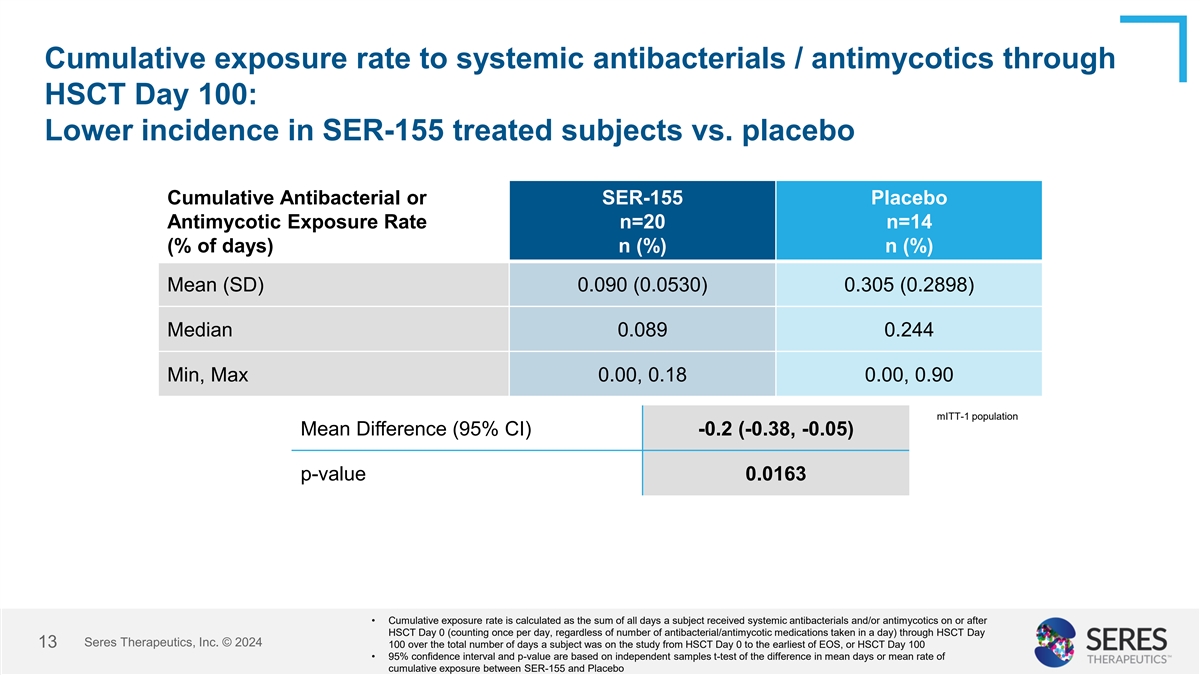
經HSCt第100天而言,對於系統抗菌藥物/抗真菌藥物的累積暴露率:SER-155治療組與安慰劑組相比,發生率較低的狀況 Antibacterial或SER-155 Placebo Antimycotic Exposure Rate n=20 n=14(% of days) n(%) n(%) Mean (SD) 0.090(0.0530) 0.305(0.2898) Median 0.089 0.244 Min, Max 0.00, 0.18 0.00, 0.90 mITt-1 population Mean Difference (95% CI) -0.2 (-0.38, -0.05) p-value 0.0163 • 累積暴露率是根據受試者在HSCT後或在HSCt Day 0之後(每天計算一次,不論一天內服用的抗菌藥物/抗真菌藥物的數量)接受系統抗菌藥物和/或抗真菌藥物的天數總和來計算的 研究期間內該受試者服用該研究的天數總數為HSCt Day 0至最早的柚子或HSCt Day 100 • 95%信心區間和p值是基於SER-155和安慰劑之間累積暴露天數或平均暴露率的差異的獨立樣本t檢驗而得的
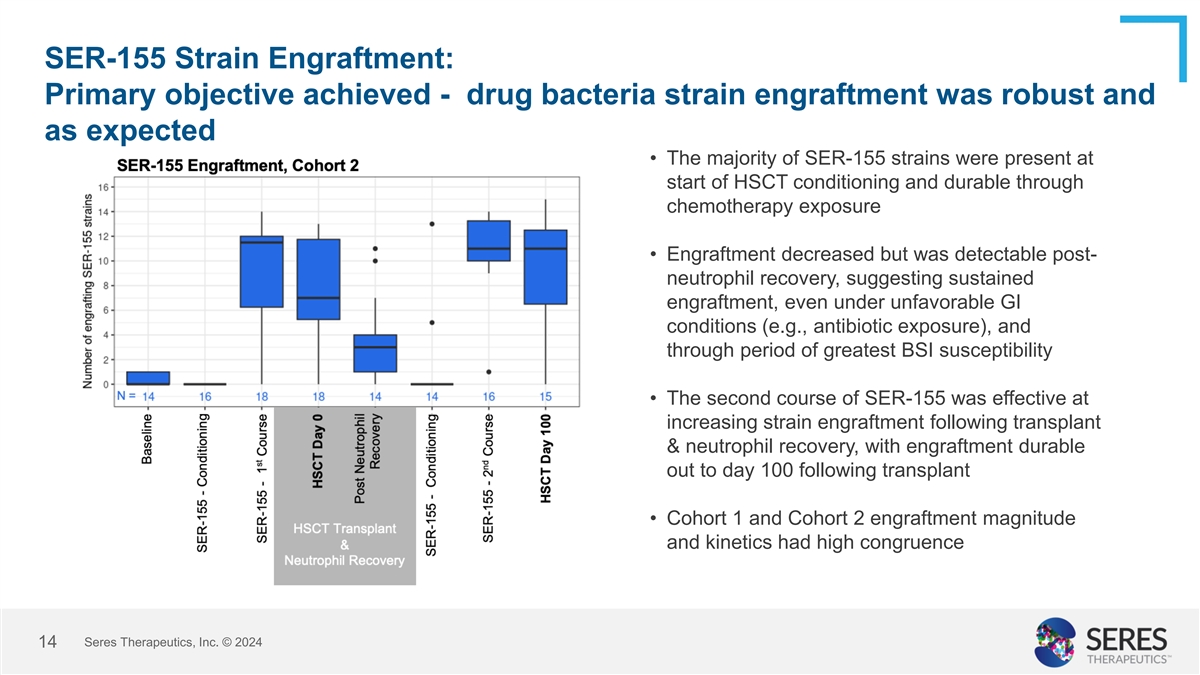
SER-155 菌株植入:主要目標達成- 增加菌株植入效果明顯,符合預期 。• SER-155 菌株在造血幹細胞移植前存在,且在化療暴露中持久存在 。• 植入減少,但在中性白血球恢復後仍可檢測到,表明在不利的腸道條件下(例如抗生素曝露),植入是持續的,並且在最易患血流感染的時期 。• SER-155 的第二療程在移植 & 中性白血球恢復後,能有效增加菌株的植入,且植入效果持久到移植後的第100天 。• Cohort 1 和 Cohort 2 的植入大小和動力學具有高度一致性。Seres Therapeutics, Inc. © 2024 14
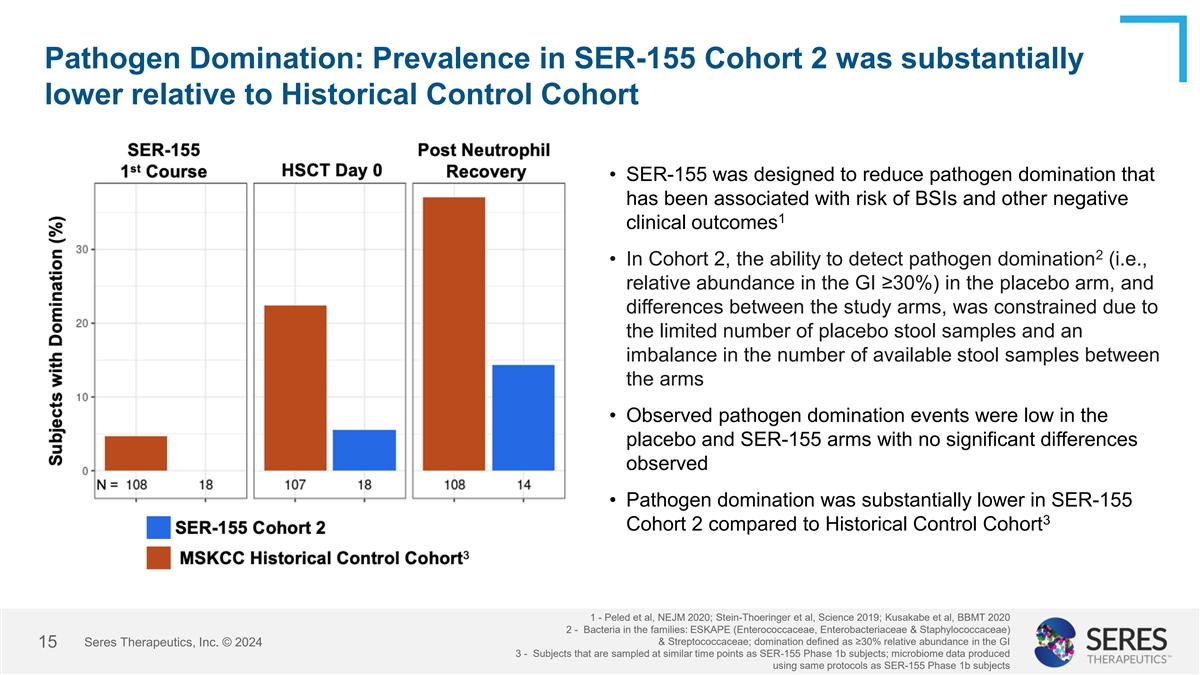
SER-155第2階段的病原體占優勢情況相對於歷史對照組明顯降低 • SER-155旨在減少與BSI和其他不良臨床結果風險相關的病原體占優勢 • 在第2階段中,由於安慰劑粪便樣本有限且兩組之間可用粪便樣本數量不平衡,故檢測病原體占優勢的能力(即腸道中≥ 30%的相對豐度)受到限制 • 觀察到的病原體占優勢事件在安慰劑組和SER-155組中均較低,且無顯著差異 • SER-155第2階段的病原體占優勢情況相對於歷史對照組1明顯降低- Peled等人,NEJm 2020; Stein-Thoeringer等人,Science 2019; Kusakabe等人,BBMt 2020 - 屬於ESKAPE(Enterococcaceae,Enterobacteriaceae和Staphylococcaceae)和Streptococcaceae家族的細菌;占優勢定義為GI中≥30%的相對豐度 Seres Therapeutics, Inc. © 2024 15 3 - 採樣時間點與SER-155 Phase 10億subjects相同的受試者;使用與SER-155 Phase 10億subjects相同的益生菌數據處理方案

總結與下一步行動 Seres 與 FDA 就推進 1 期結果進行接觸 壓力位 Seres 策略支持 SER-155 allo-HSCt 節目追求 SER-155 和其他活生物治療,以預防嚴重細菌感染 • 打算評估 SER-155 在其他患者身上 • 尋求突破性治療指定給具有嚴重細菌高風險人群,與血流感染相關的高未滿足醫療需求 • 機會去應對多個醫療上脆弱的患者群體,並滿足 SER-155 和額外流水管節目的表述 (孤兒藥品指定,合格傳染病產品)