
爲患者選擇開創性的科學企業展示2024年9月陳列品99.4

免責聲明 本報告包含一定的「前瞻性陳述」,這些陳述涉及重大風險和不確定性。本報告中所有與歷史事實無關的陳述均應被視爲前瞻性陳述,包括但不限於含有「相信」、「預計」、「期望」、「估計」、「可能」、「可以」、「應該」、「將」、「意圖」等字樣的陳述。我們在很大程度上基於我們對未來事件和趨勢的當前預期和預測,認爲這些事件和趨勢可能對我們的財務狀況、經營業績、業務策略和財務需求產生影響。此類前瞻性陳述涉及未知風險、不確定性和其他因素,可能導致我們的實際結果、財務狀況、業績、成就或行業結果與任何未來結果、業績或成就以及由此類前瞻性陳述所隱含的結果顯著不同。可能導致此類差異的因素包括但不限於我們與監管機構(包括FDA)的互動結果不確定、我們臨床開發計劃(尤其是deucrictibant)的預期時間、進展或成功,這些計劃目前處於全球晚期臨床試驗階段,我們能否在進行中和將來的非臨床研究和臨床試驗中複製RAPIDe-1、RAPIDe-2和CHAPTER-1 Phase 2研究所展示的療效和安全性引起的風險,流行病(如COVID-19大流行)可能對我們的業務、非臨床研究和臨床試驗產生不利影響,監管批准的結果和時間、普通股股票價格、獲得我們產品候選人或任何我們將來可能開發的產品候選人的監管批准的時間、成本及其他限制,我們能否建立商業能力或與第三方達成市場、銷售和分銷我們的產品候選人的協議,我們在藥品行業中的競爭能力,包括現有療法、新興潛在有競爭性的療法和有競爭性的非專利產品的競爭能力,我們能否爲我們的產品候選人進行市場營銷、商業化並獲得市場接受,我們能否在需要時以可接受的條件籌集資金,美國、歐盟和其他司法管轄區的監管發展,我們能否保護我們的知識產權和專有技術,並在不侵犯他人知識產權或監管專屬權的情況下運營我們的業務,適用法律和法規(包括稅法)變化所帶來的負面影響的管理能力,一般市場、政治和經濟條件的變化和不確定性(包括由通貨膨脹和俄羅斯與烏克蘭之間的衝突以及哈馬斯對以色列的攻擊及隨之而來的戰爭引起的變化),以及在我們年度20-F表中「關於前瞻性陳述的小心聲明」和「項目3.關鍵信息--D.風險因素」標題下描述的其他因素。新的風險和不確定性可能會不時出現,無法預測所有風險和不確定性。除非法律另有規定,否則我們無義務公開更新任何前瞻性陳述,無論是基於新信息、未來事件或其他原因。本報告包括尚未獲得監管機構批准的研究用新藥的數據。本報告中包含的某些信息涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及公司自有的內部估計和研究。儘管公司相信這些第三方來源在此報告發布之日可靠,但公司並未獨立核實,並不對從第三方來源獲取的任何信息的充分性、公正性、準確性或完整性作出任何陳述。此外,本報告中包含的所有市場數據都涉及一系列假設和限制,無法保證這些假設的準確性或可靠性。最後,儘管我們相信自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的驗證。
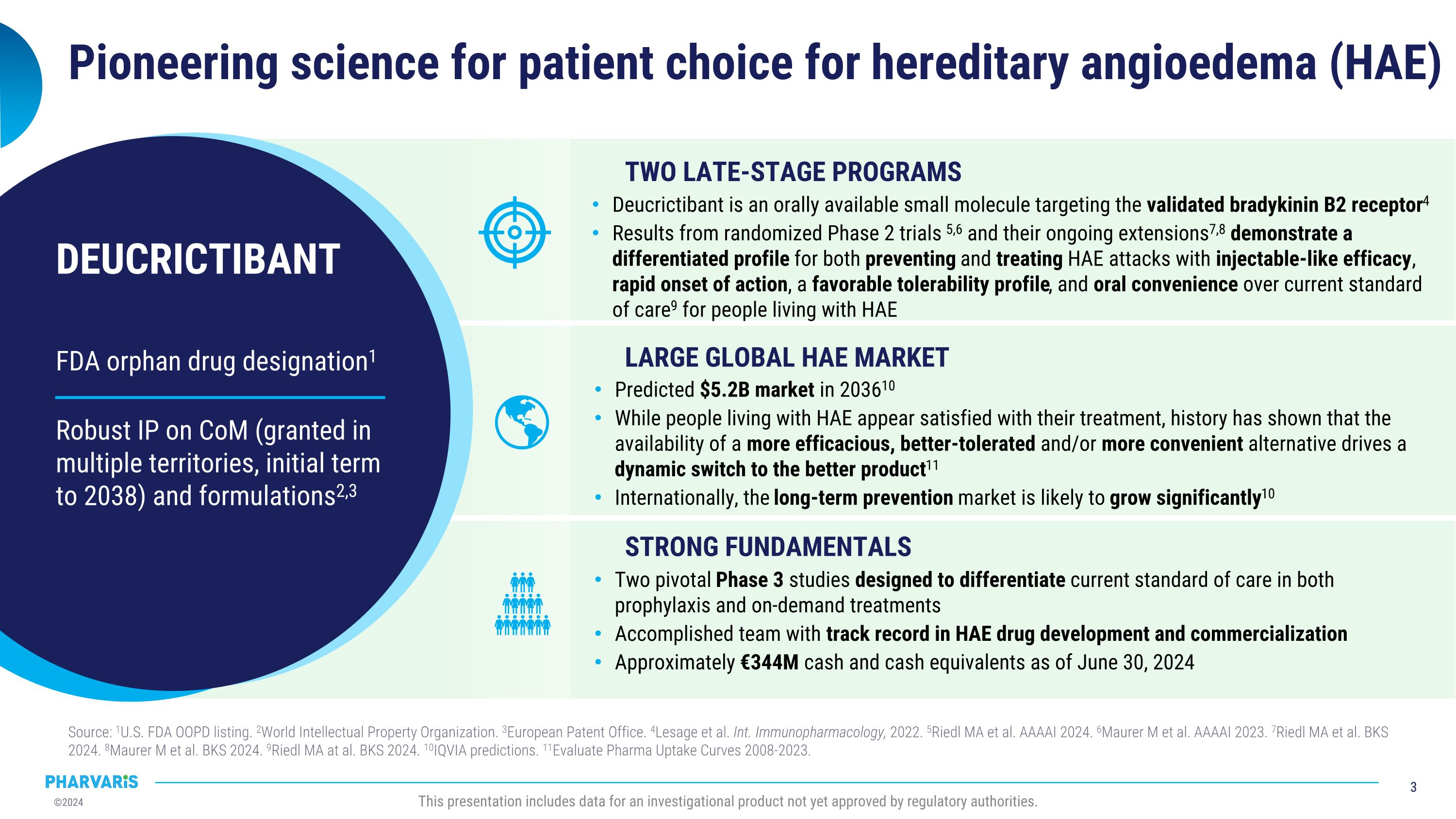
FDA特殊用途藥物認可1 Com領域具有強大的知識產權(在多個地區授權,初步授權期至2038年)和配方2,3 DEUCRICTIBANt爲遺傳性血管性水腫(HAE)患者提供開創性的醫學選擇 來源:1美國 FDA OOPD 列表。 2世界知識產權組織。 3歐洲專利局。 4Lesage等。 Int. Immunopharmacology,2022年。 5Riedl MA等 AAAAI 2024年。 6Maurer m等 AAAAI 2023年。 7Riedl MA等 BKS 2024年。 8Maurer m 等 BKS 2024年。 9Riedl MA等 BKS 2024年。 10IQVIA預測。 11Evaluate Pharma Uptake Curves 2008-2023年。 這個介紹包含了尚未獲得監管機構批准的一個研究產品的數據。 兩個後期階段項目大規模全球HAE市場 紮實的基本面 Deucrictibant是一種口服小分子,靶向驗證的激肽B2受體4 來自隨機的2期臨床試驗5,6及其正在進行的擴展7,8展示了其在預防和治療HAE發作方面具有不同的特徵,具有類似注射劑的療效,快速起效,良好的耐受性以及與當前標準護理9的口服便利性 2036年預計市場規模爲520億元 HAE患者似乎滿意他們的治療,但歷史證明,更有效、更耐受和/或更便利的替代產品的可用性會驅動產品的動態切換11 在國際上,長期預防市場有望顯著增長10 兩個關鍵的3期研究旨在區分當前標準的預防和按需治療 HAE藥物開發和商業化取得了卓著的成果 截至2024年6月30日,現金及現金等價物約爲3,440萬歐元
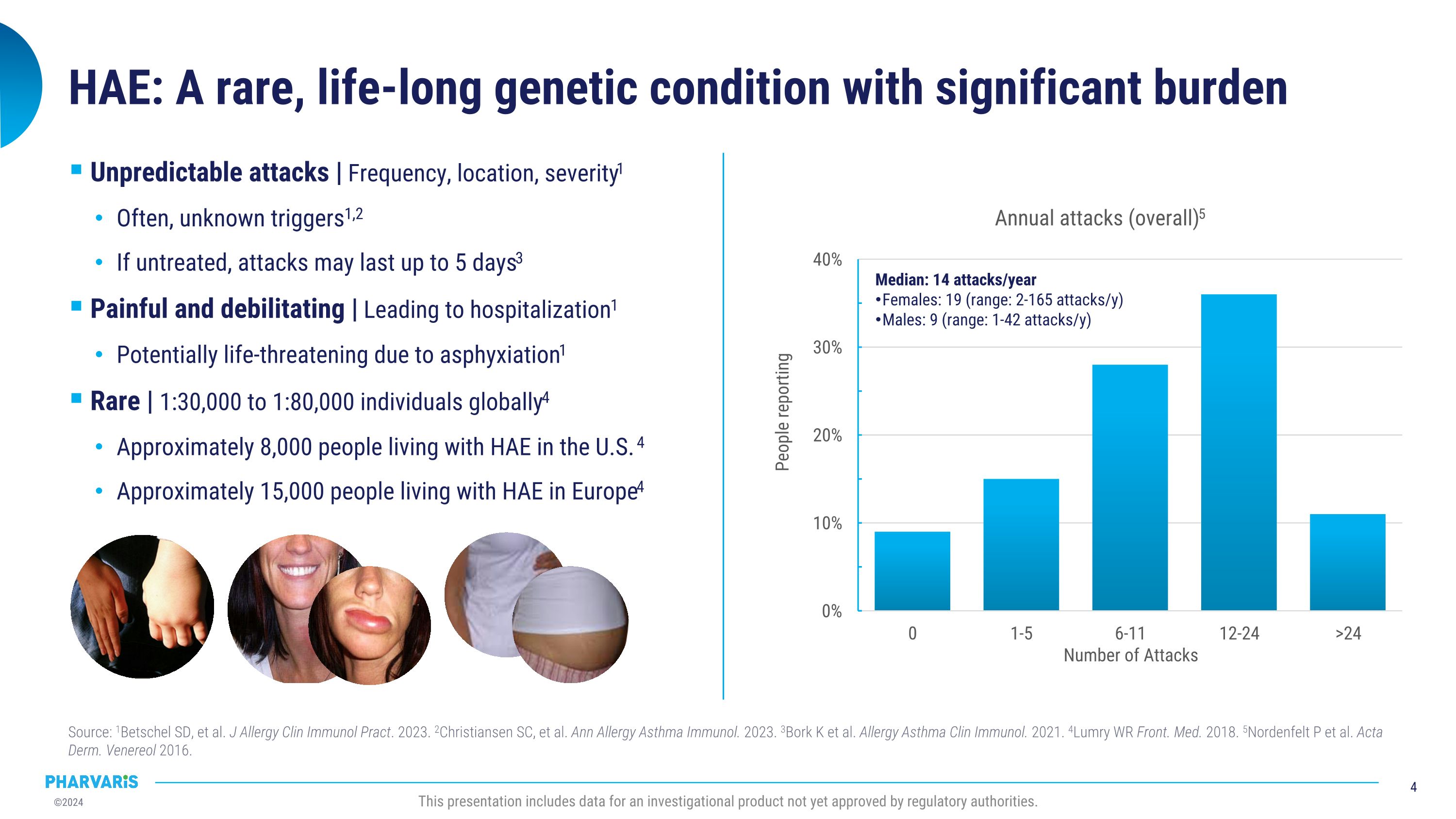
中位數:每年14次攻擊 女性:19次(區間:每年2-165次攻擊) 男性:9次(區間:每年1-42次攻擊) HAE(遺傳性補體C1抑制活性缺乏症):一種罕見的終身遺傳性疾病,負擔重 Source: 1Betschel SD, et al. J Allergy Clin Immunol Pract. 2023. 2Christiansen SC, et al. Ann Allergy Asthma Immunol. 2023. 3Bork k et al. Allergy Asthma Clin Immunol. 2021. 4Lumry WR Front. Med. 2018. 5Nordenfelt P et al. Acta Derm. Venereol 2016. 此演示展示了尚未獲得監管機構批准的研究產品的數據。攻擊的不可預測性 | 頻率、地點、嚴重程度1 經常是未知的觸發因素1,2 如果不治療,攻擊可能持續長達5天3 疼痛和致殘性 | 導致住院1 可能由於窒息而危及生命1 罕見 | 每30,000到80,000人中大約有1個4 美國有大約8,000人患有HAE 4 歐洲有大約15,000人患有HAE4
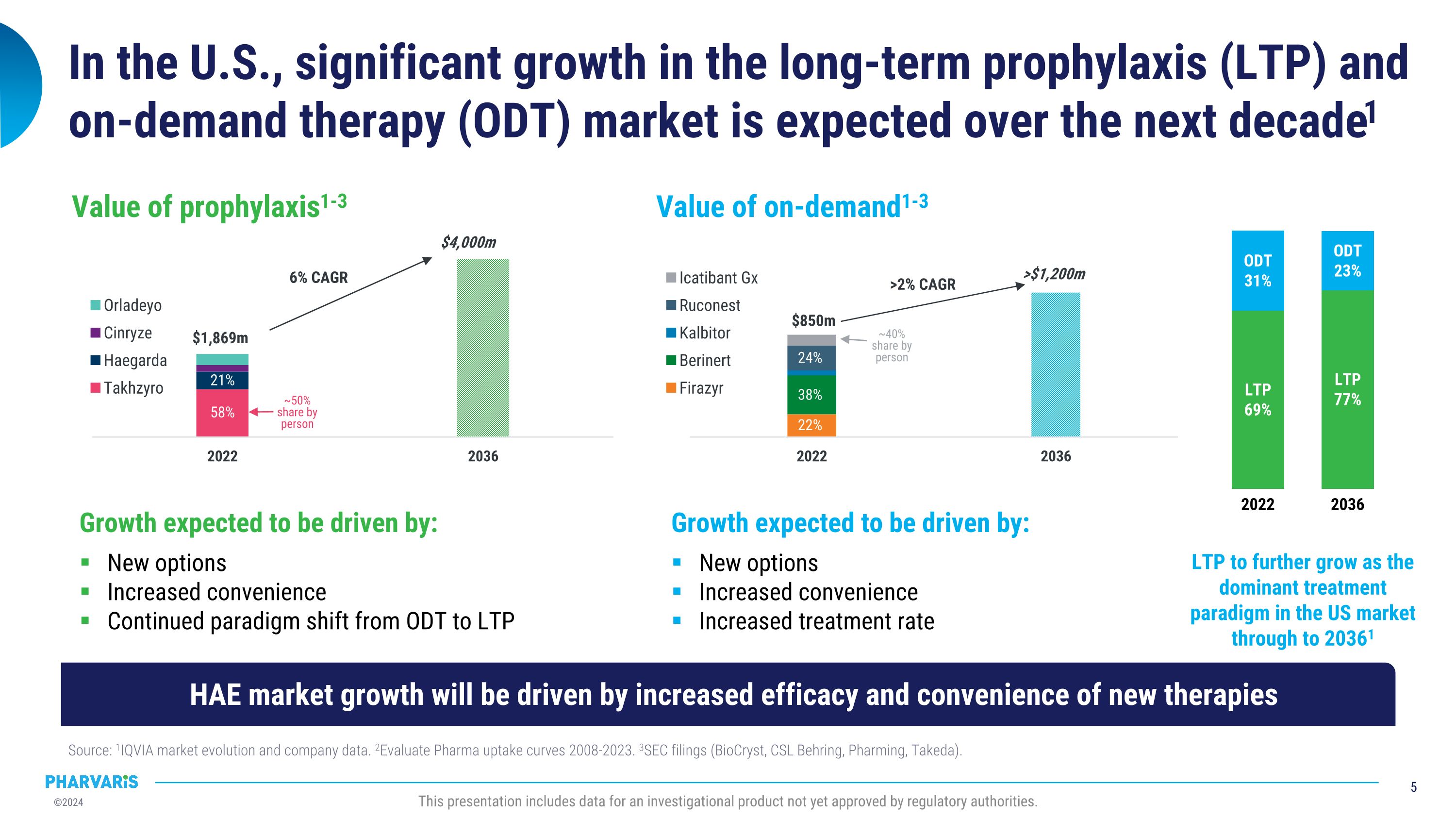
在美國,長期預防(LTP)和需求治療(ODT)市場預計在未來十年出現顯著增長1來源:1IQVIA市場發展和公司數據。2Evaluate Pharma 2008-2023年的採用曲線。3SEC文件(BioCryst,CSL Behring,Pharming,武田製藥)。此演示文稿包括尚未獲得監管機構批准的一種研究性產品的數據。增長的預期將由以下因素推動:新的期權,便利性增加,治療速率增加,按需求的價值1-3爲850萬美元,大於1200萬美元,大於2%年複合增長率22%,38%,24%,大約佔人均份額的40%。增長的預期將由以下因素推動:新的期權,方便性的增加,持續的治療方式從ODt過渡到LTP,長期預防的價值1-3 爲1869億美元,大於4000億美元,6%年複合增長率58%,21% ,大約佔人均份額的50%。到20361年,LTP預計會進一步成爲美國市場的主導治療方式2022年LTP佔69%,ODt佔31%,2036年LTP佔77%,ODt佔23%。HAE市場增長將在新療法的療效和便利性的增加推動下。
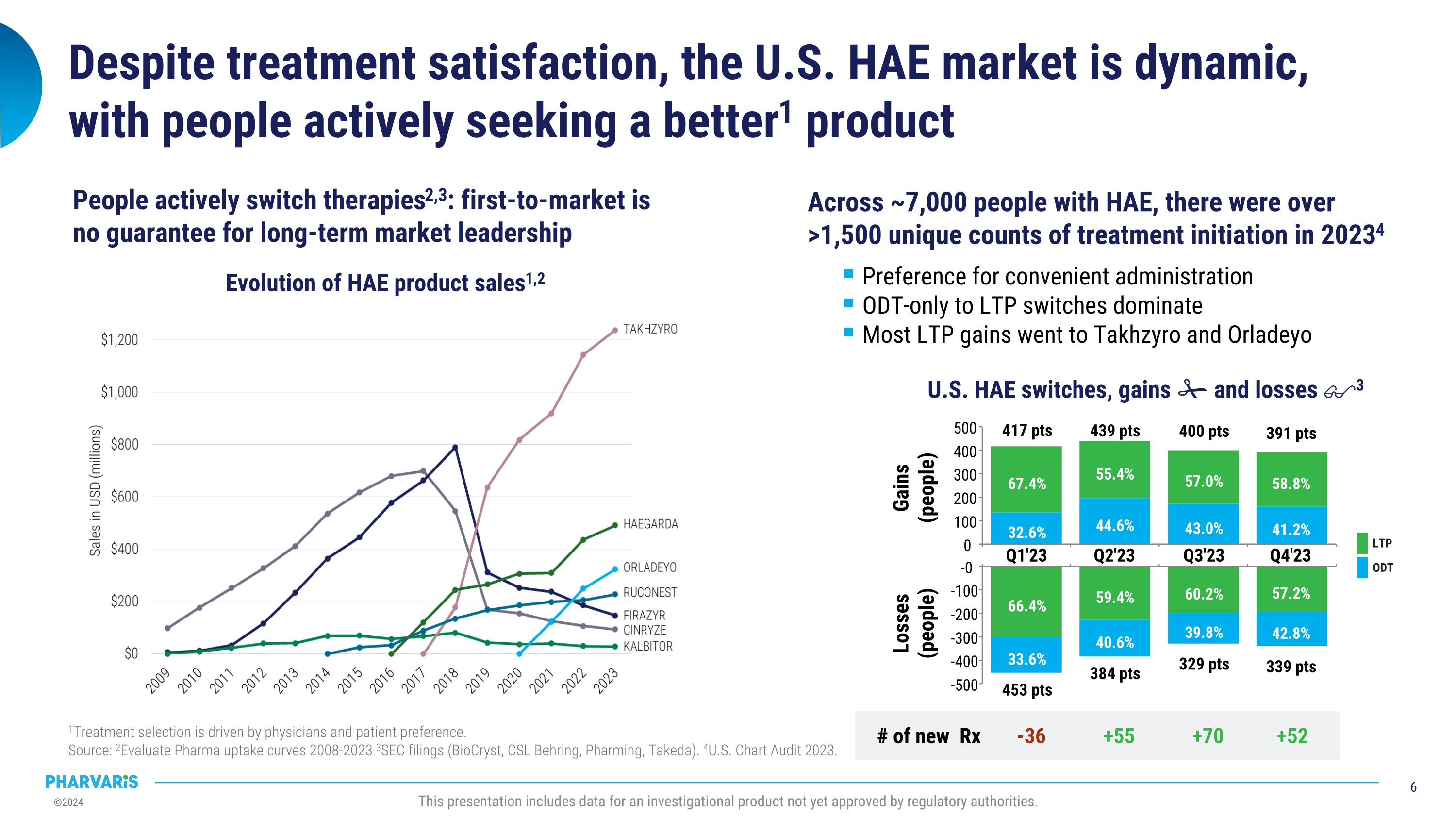
453 點 384 點 339 點 329 點 雖然治療滿意度高,但美國HAE市場變化多端,人們積極尋求更好的產品 1 治療選擇受醫生和患者偏好驅動。 來源: 2 Evaluate Pharma 接受曲線 2008-2023 3 SEC備案(BioCryst,CSL Behring,Pharming,武田)4美國圖表審核2023年。本展示包括尚未獲得監管機構批准的研究產品數據。在約7,000名HAE患者中,2023年有1500多次獨特的治療啓動次數34 偏好方便的ODt治療轉換爲長期預防治療(LTP)主導大部分LTP增長都流向了Takhzyro和Orladeyo 美國HAE 交換、增長和損失3-36 +55 +70 +52 新處方66.4% 59.4% 60.2% 57.2% 33.6% 40.6% 39.8% 42.8% Q1'23 Q2'23 Q3'23 Q4'23 -0 -100 -200 -300 -400 -500 損失 (人數)32.6% 44.6% 43.0% 41.2% 67.4% 55.4% 57.0% 58.8% 417 點 439 點 400 點 391 點 Q1'23 Q2'23 Q3'23 Q4'23 0 100 200 300 400 500 增益 (人數)ODt LTP HAE產品銷售1,2的演變 人們積極轉換療法2,3:首發市場不能保證長期市場領導地位

患有HAE的人們正在追求一個不以他們的狀況爲定義、也不被其管理所負擔的生活1。來源:1 Lumry WR等人. Allergy Asthma Proc. 2020. 2 Geba等人,J Drug Access. 2021. 3U.S. Chart Audit 2023。本演示文稿包含尚未獲得監管機構批准的研究用產品的數據。患有HAE的人積極在產品之間切換3,以尋求在療效、安全性/耐受性和便利性方面的改善。療效是主要的驅動因素...而安全性和耐受性則促使人們探索其他選擇...而便利性是整體偏好的一個關鍵因素2。
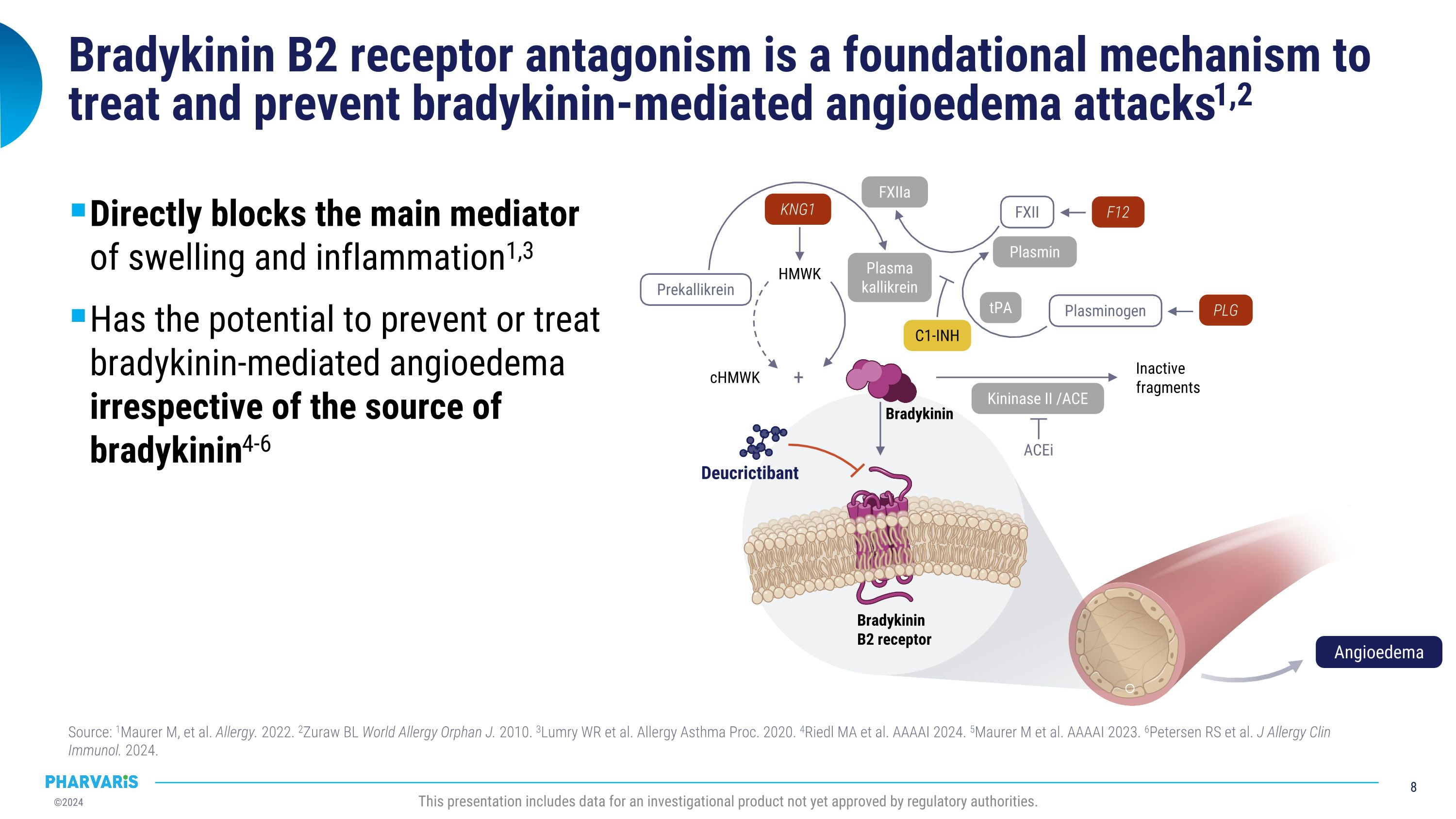
布地奎寧B2受體拮抗是治療和預防布地奎寧介導的血管性水腫發作的基礎機制1,2直接阻斷腫脹和炎症的主要介質1,3有潛力預防或治療布地奎寧介導的血管性水腫,不受布地奎寧來源的限制4-6來源:1Maurer m等。過敏。2022年。2Zuraw BL World Allergy Orphan J. 2010年。3Lumry WR等。過敏哮喘過程。2020年。4Riedl MA等。AAAAI 2024年。5Maurer m等。AAAAI 2023年。6Petersen RS等。J Allergy Clin Immunol. 2024年。本演示包括尚未獲得監管機構批准的研究性產品數據。cHMWk 失活片段HMWk ACEi+前卡裂解酶FXII纖溶酶原纖溶酶原FXIIa tPA 激酶酶II / ACE 血漿卡利肽酶 KNG1 F12 PLG C1-INH 布地奎寧B2受體Deucrictibant布地奎寧血管性水腫
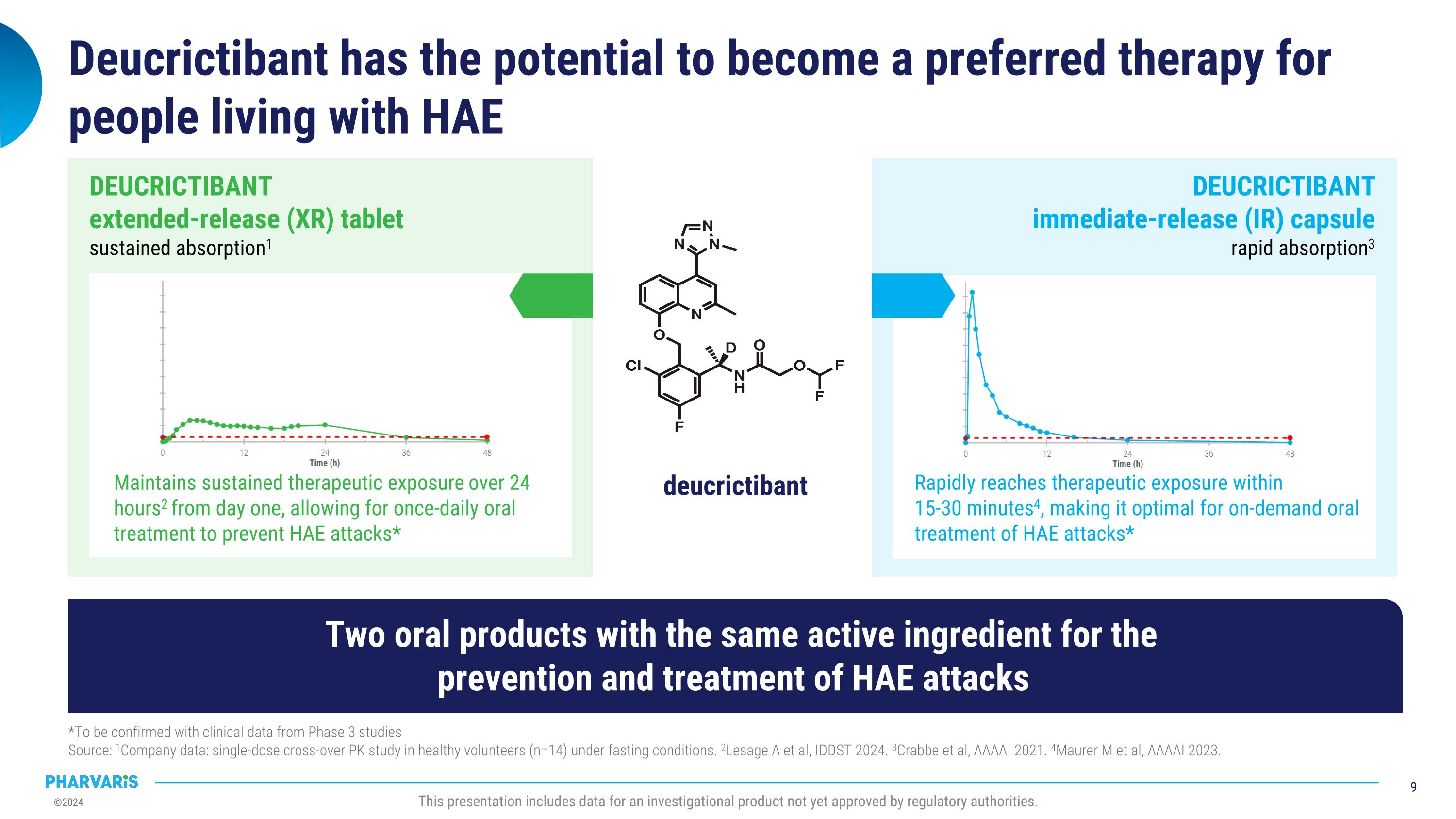
Deucrictibant有潛力成爲HAE患者的首選治療方案*待臨床第三期研究數據確認 來源:1公司數據:在禁食條件下對健康志願者(n=14)進行單劑交叉Pk研究。2Lesage A等,IDDSt 2024. 3Crabbe等,AAAAI 2021. 4Maurer m等,AAAAI 2023. 此演示文稿涉及的數據是一種尚未獲得監管機構批准的調查產品的數據。4迅速達到治療暴露於 15-30分鐘4,使其成爲HAE急性發作的理想口服治療藥物* Deucrictibant 即釋(IR)膠囊 迅速吸收3 Deucrictibant從第一天開始提供持續治療暴露,24小時2,允許每天一次的口服治療 預防HAE急性發作*Deucrictibant 延長釋放(XR)片劑 持續吸收1兩種口服產品具有相同的活性成分,用於HAE發作的預防和治療

Deucrictibant針對LTP和ODt源進行了差異化的描述:1公司調研。2Leasge等人IDDSt 2024。3Groen k等人ACAAI 2022。4Li H等人EAC 2024。5Maurer m等人HAEi Workshop, 2022。6Maurer m等人AAAAI 2023。7Riedl等人WSAAI 2024。8Maurer m等人BKS 2024。這個演示文稿包含一種尚未獲得監管機構批准的研究產品的數據。快速吸收在15-30分鐘內6,Deucrictibant IR達到治療暴露,結果是在30分鐘內停止發作進展7。較長的有效暴露較長的有效暴露會導致單劑量攻擊峯值解決率很高8。單一口服藥物特定的配方允許每日一次服用3(LTP使用XR)或快速單劑量解決HAE發作4(ODT使用IR)。口服ODt或LTP配方Deucrictibant是唯一一種開發中的HAE治療方法1,可以用於預防和需求2上。快速達到穩態Deucrictibant XR有潛力在2-3天內達到穩態5,從而在LTP開始的初始天3提供對HAE發作的保護。LTP ODT
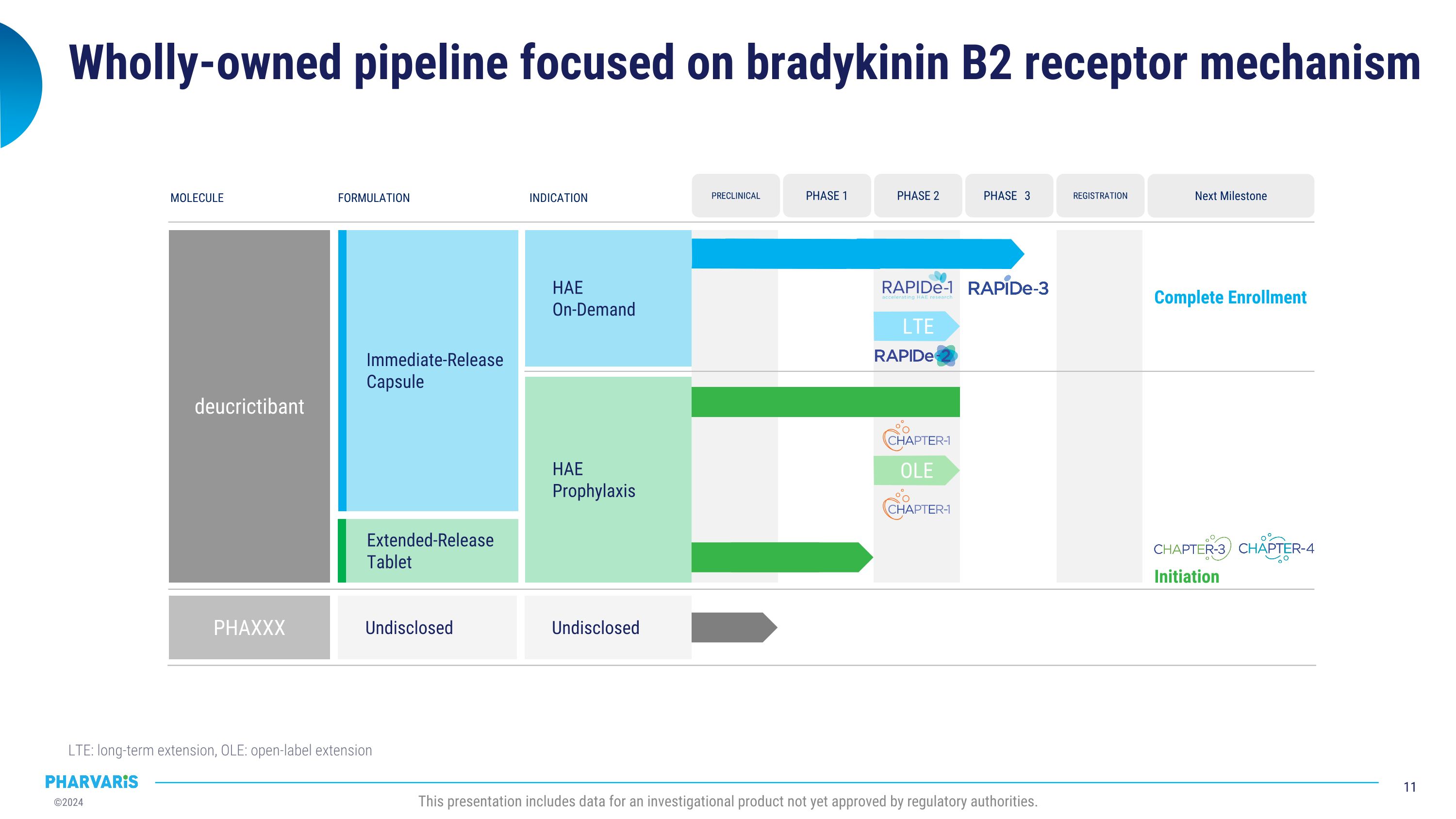
專注於佈雷肽B2受體機制的全資管道 LTE:長期延伸,OLE:開放式延伸 本報告包括尚未獲得監管機構批准的調查產品數據。 分子配方指標 deucrictibant 未公開 PHAXXX HAE 按需 HAE 預防性 下一個里程碑 完成招募 登記 階段3 臨床前 階段1 階段2 未公開 即時釋放膠囊 延長釋放片 OLE 啓動 LTE

按需治療(ODT)長期預防治療(LTP)Deucrictibant LTP和ODt OLE:開放標籤拓展 LTE:長期延伸 來源:1NCT05047185. 2NCT04618211. 3NCT05396105. 4NCT06343779. 22期完整 2/3期 LTE3進行中 3期關鍵4進行中 21期第1部分:隨機對照主要分析(完成) 第2部分:開放標籤拓展(進行中) 第3期關鍵 開始控件第3期OLE開始 推廣 這個報告包含的數據是一個尚未被監管機構批准的研究用途產品。

注射效果帶來的療效和口服便利性,使得deucrictibant具有成爲管理HAE OLE:開放標籤擴展。LTE:長期擴展。PGI-C:患者全球改變印象。PGI-S:患者全球嚴重性印象的潛力。 來源:1Riedl MA等。 BKS 2024年。 2Valerieva A等。 EAACI 2024年。 3Magerl m等。 BKS 2024年。 4Riedl MA等。 AAAAI 2024年。 5Maurer m等。 BKS 2024年。 6Maurer m等。 AAAAI 2023年。該演示文稿包括尚未獲得監管當局批准的調查產品的數據。長期預防治療(LTP)潛在首選LTP安全性和耐受性生活質量公式療效持續一年以上在進行中的OLE研究中1改善疾病控制和健康相關的生活質量與第22,3期降低攻擊的相應增加3進行中的OLE研究中證實第2期安全性和耐受性概況1,4一日一次的商業配方準備進入第3期 按需治療(ODT)潛在首選ODt安全性和耐受性與中位數醫院感染後症狀緩解「好轉」約1.1小時PGI-S症狀消除無「無」約11.5小時 在進行中的LTE研究中5攻擊的85.8%在24小時內完全消除了進行中的LTE研究,其中90.2%的單劑量5證實進行中的LTE研究中第2期安全性和耐受性概況5,6
長期預防用Deucrictibant延釋片

按需治療(ODT)長期預防(LTP)Deucrictibant的LTP臨床發展OLE:開放標籤延續。LTE:長期延期。 來源:1NCT05047185。2NCT04618211。3NCT05396105。4NCT06343779。第22階段完全第2/3 LTE3進行中第3個關鍵性4進行中第21階段1部分:隨機對照主要分析(完成)第2部分:開放標籤延伸(進行中)第3階段關鍵性開啓第3階段OLE開啓該演示包括尚未獲得監管機構批准的調查產品數據。

CHAPTER-1階段2預防試驗的積極頭條數據於2023年12月宣佈:中度和嚴重發作的發生率降低了92.3%* 按需用藥治療的發作發生率降低了92.6%* 在主要、次要和與健康相關的生活質量終點指標上具有臨床意義的結果 兩個劑量下的Deucrictibant耐受性良好 *40mg/天的Deucrictibant治療組;每月發作率減少率基於泊松回歸模型。此處報告的所有發作均經考證;發作率是每月發生的發作次數,也稱爲時間歸一化的發作次數;所有比較Deucrictibant和安慰劑的統計分析都未調整多重性。 來源:1Aygören-Pürsün E等。EAACI 2024。滿足主要終點:與安慰劑相比,每月發作率減少84.5%(p=0.0008)* 本介紹包含一個尚未獲得監管機構批准的調查性產品的數據。
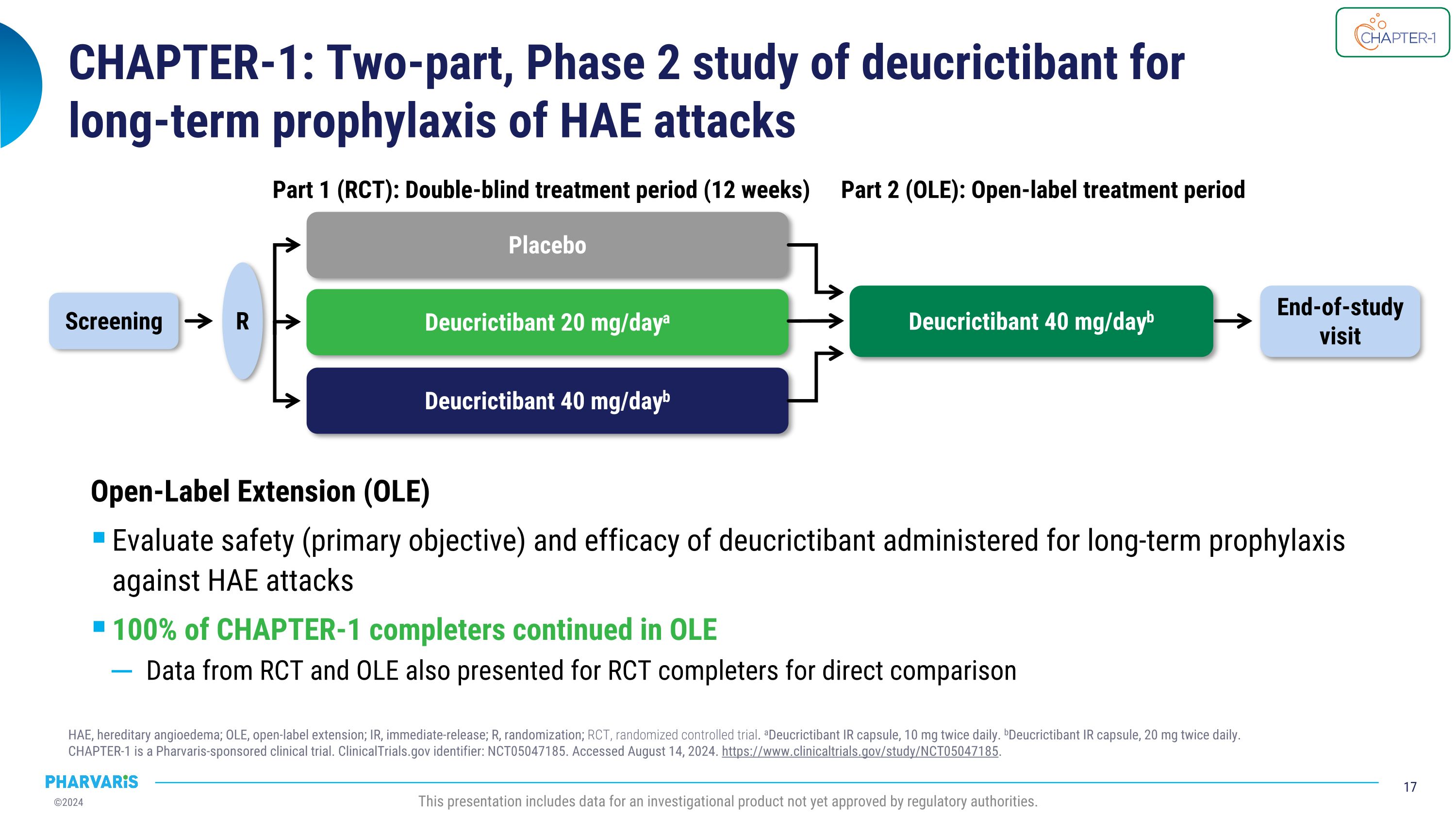
第1章:Deucrictibant的兩階段第2階段的研究,用於長期預防HAE發作HAE,遺傳性血管性水腫;OLE,無標籤延期;IR,即時釋放;R,隨機化;RCt,隨機對照試驗。a Deucrictibant IR膠囊10毫克每日兩次。b Deucrictibant IR膠囊20毫克每日兩次。 第1章是由Pharvaris贊助的臨床試驗。\nClinicalTrials.gov標識符:NCT05047185。於2024年8月14日訪問。https://www.clinicaltrials.gov/study/NCT05047185。本展示包括迄今尚未獲得監管機構批准的調查產品的數據。安慰劑Deucrictibant 20毫克/天a Deucrictibant 40毫克/天b 第1部分(RCT):雙盲治療期(12周)篩選R 結束研究訪問 Deucrictibant 40毫克/天b 第2部分(OLE):開放治療期開放標籤延期(OLE)評估Deucrictibant長期預防HAE發作的安全性(主要目標)和療效100%的CHAPTER-1完成者繼續進行OLE還針對RCt完成者進行直接比較提供RCt和OLE的數據
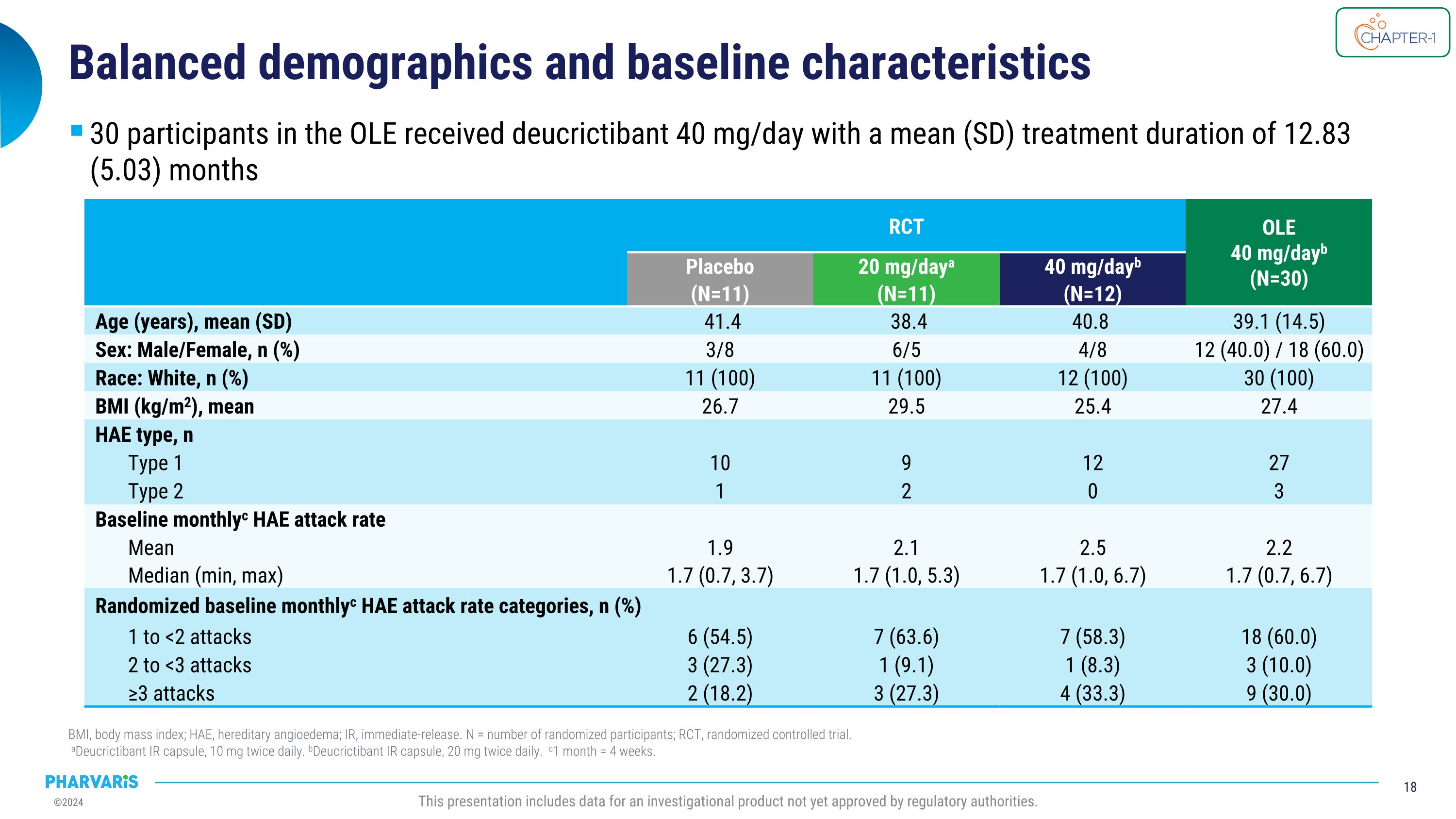
人口統計學和基線特徵BMI,即體重指數;HAE,遺傳性血管性水腫;IR,即時釋放。N = 受試者隨機分配的人數;RCt,隨機對照試驗。 a狄克力替班即時釋放膠囊,每日10毫克2次。 b狄克力替班即時釋放膠囊,每日20毫克2次。 c1個月 = 4周。本報告包括尚未獲得監管機構批准的一種調查產品的數據。RCt OLE 40mg/天b (N=30) 安慰劑(N=11) 每天20mg/a(N=11) 每天40mg/b(N=12) 年齡(歲),平均(標準差) 41.4 38.4 40.8 39.1 (14.5) 性別:男/女,n(%) 3/8 6/5 4/8 12(40.0) / 18(60.0) 種族:白人,n(%) 11(100) 11(100) 12(100) 30(100) BMI(kg/m2),均值 26.7 29.5 25.4 27.4 HAE類型,n 類型1 10 9 12 27 類型2 1 2 0 3 基線每月c HAE發作率 平均值 1.9 2.1 2.5 2.2 中位數(最小,最大) 1.7(0.7,3.7) 1.7(1.0,5.3) 1.7(1.0,6.7) 1.7(0.7,6.7) 隨機分配的基線每月c HAE發作率類別,n(%) 1至<2次發作 6(54.5) 7(63.6) 7(58.3) 18(60.0) 2至<3次發作 3(27.3) 1(9.1) 1(8.3) 3(10.0) ≥3次發作 2(18.2) 3(27.3) 4(33.3) 9(30.0) OLE中的30名參與者每天接受40mg狄克力替班,治療持續平均(標準差)12.83(5.03)個月
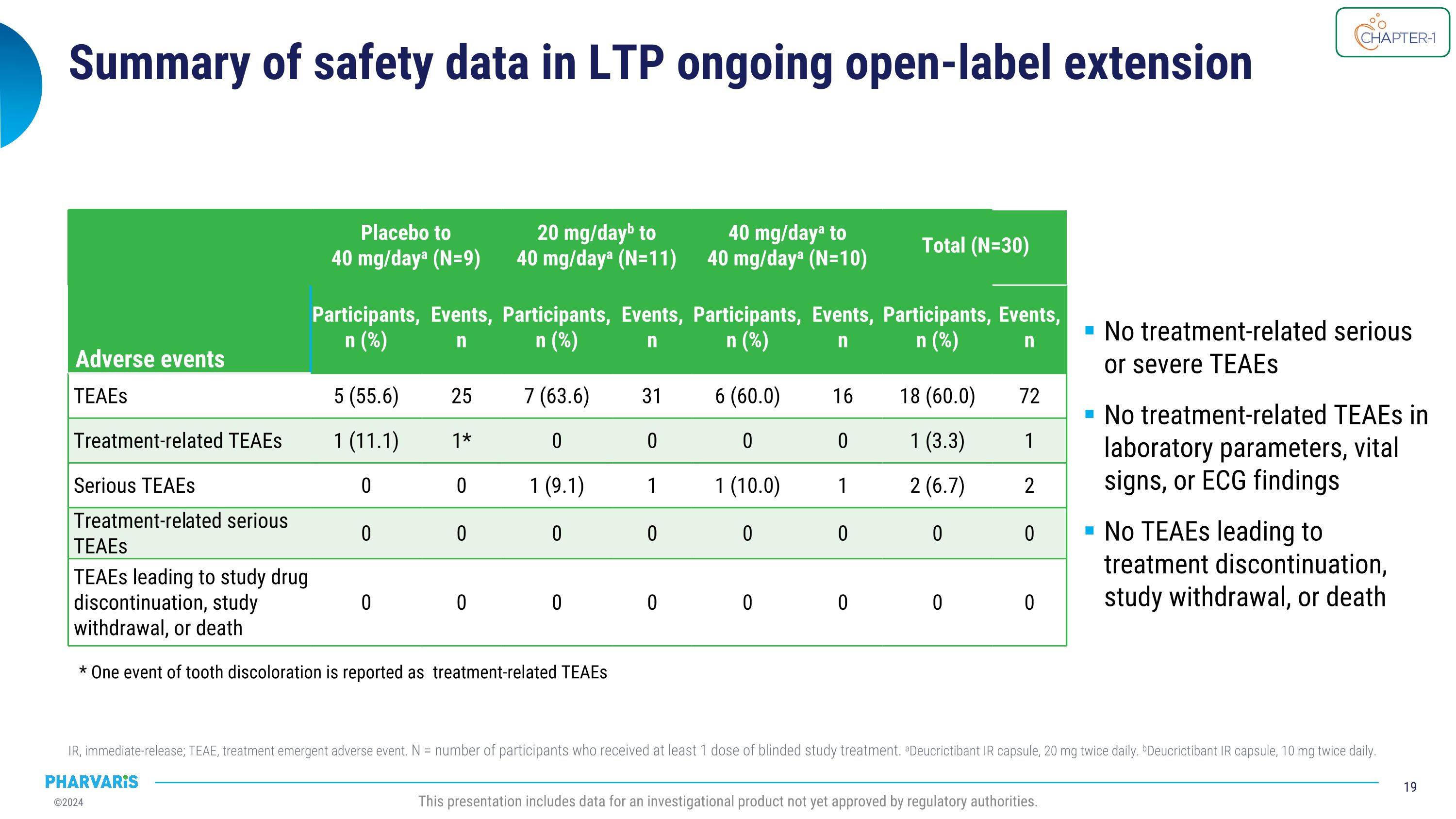
LTP持續開放標籤擴展IR的安全性數據總結,IR代表即釋放,TEAE代表治療相關的不良事件。N爲至少接受了一劑盲目研究治療的參與者數量。aDeucrictibant IR膠囊,每天20毫克,兩次。bDeucrictibant IR膠囊,每天10毫克,兩次。本報告包含尚未獲得監管機構批准的研究產品的數據。不良事件 安慰劑至40毫克/天a(N=9)20毫克/天b至40毫克/天a(N=11)40毫克/天a至40毫克/天a(N=10)總計(N=30) 事件 參與者,n(%) 事件,n 參與者,n(%) 事件,n 參與者,n(%) 事件,n 參與者,n(%) 事件,n TEAE 5(55.6) 25 7(63.6) 31 6(60.0) 16 18(60.0) 72 與治療相關的TEAE 1(11.1) 1* 0 0 0 0 1(3.3) 1 嚴重TEAE 0 0 1(9.1) 1 1(10.0) 1 2(6.7) 2 與治療相關的嚴重TEAE 0 0 0 0 0 0 0 0 TEAE導致研究藥物停止使用,退出研究或死亡 0 0 0 0 0 0 0 0 無與治療相關的嚴重或嚴重TEAE 實驗室指標,生命體徵或心電圖結果中無與治療相關的TEAE TEAE未導致治療停止,退出研究或死亡 * 有一例牙齒變色的事件報告爲與治療相關的TEAE
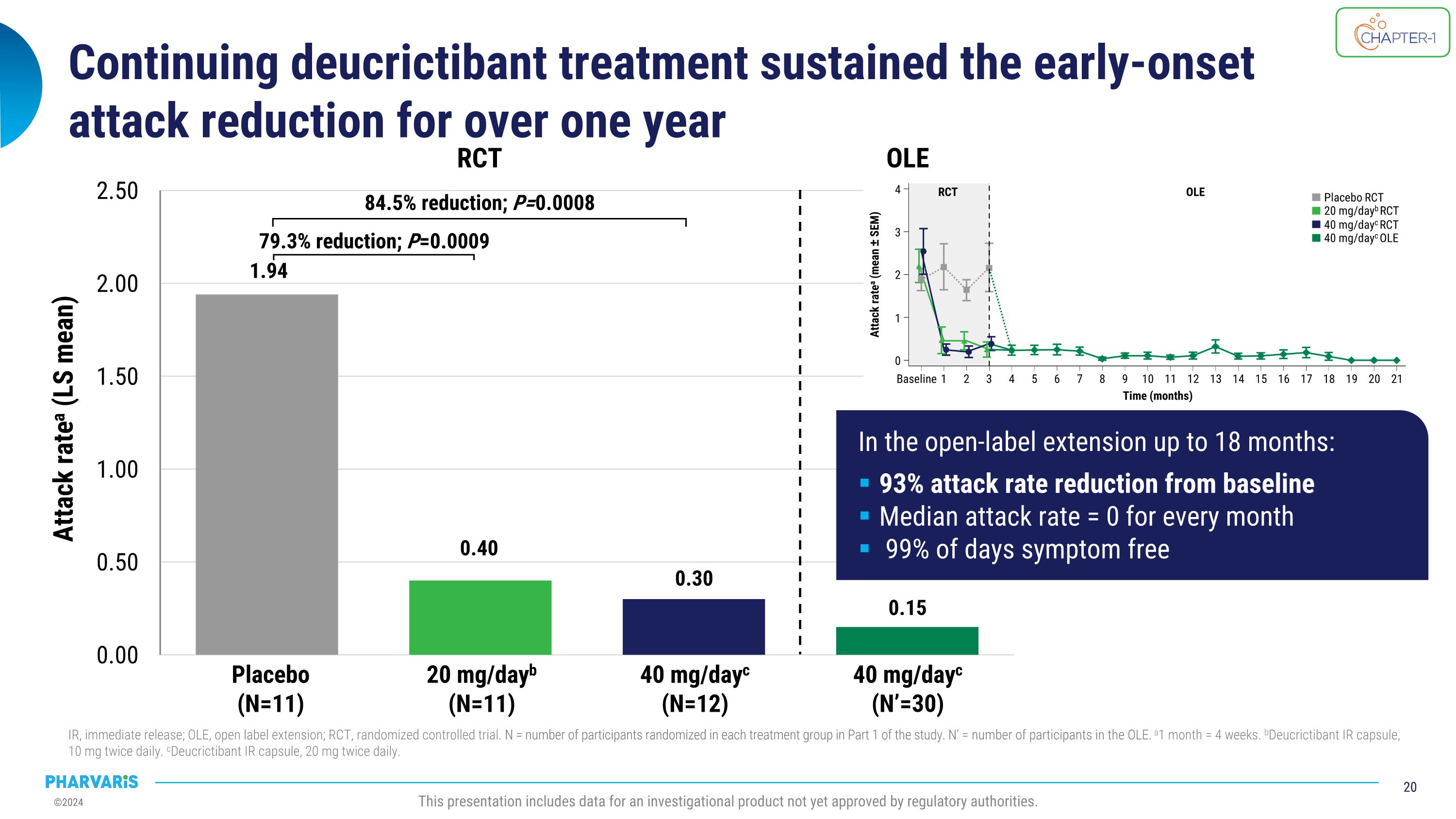
持續使用deucrictibant治療能夠延續早期發作的減少,持續超過一年IR,即刻釋放;OLE,開放標籤延展;RCT,隨機對照試驗。N = 在研究的第一部分中每個治療組中隨機分配的參與者數量。N' = OLE中參與者的數量。a1個月 = 4周。bDeucrictibant IR膠囊,10毫克,每天兩次。cDeucrictibant IR膠囊,20毫克,每天兩次。本次演示包括尚未獲得監管機關批准的研究產品的數據。安慰劑(N=11)20毫克/天b(N=11)40毫克/天c(N=12)RCT 40毫克/天c(N'=30)OLE 降低了79.3%;P=0.0009 降低了84.5%;P=0.0008 發作率a(LS均值)在延展期達到18個月時:相對於基線,發作率降低了93% 平均每個月的發作率 = 0 99%的天數沒有症狀
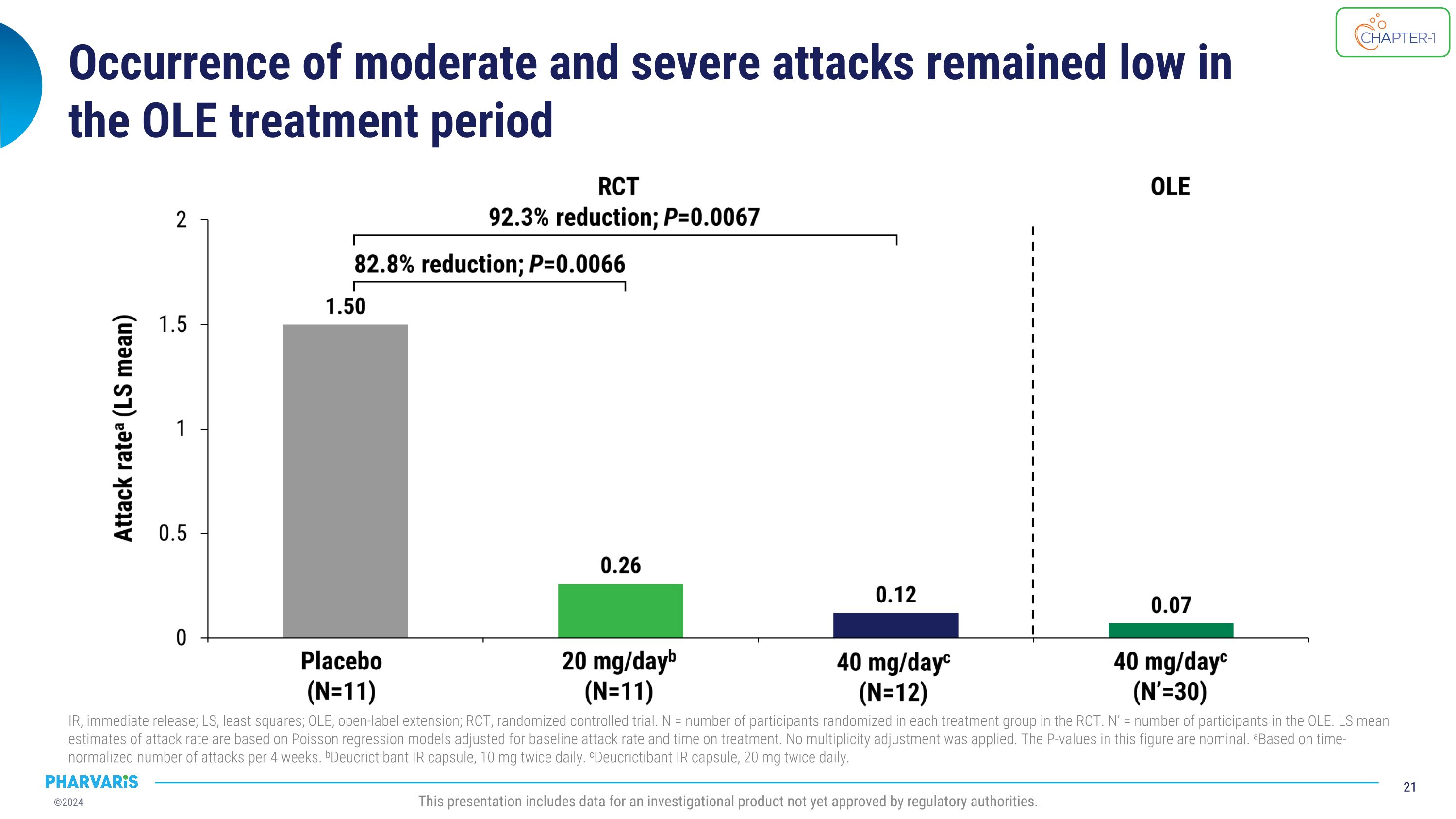
在OLE治療期間,中等和嚴重發作的發生率保持較低水平。 IR,立即釋放; LS,最小二乘法; OLE,開放標籤延長; RCt,隨機對照試驗。 N = 在RCt中每個治療組中隨機分配的參與者數量。 N' = OLE中的參與者數量。 根據基線發作率和治療時間進行調整的Poisson回歸模型的LS均值估計。 沒有應用多重性調整。 本圖中的P值是名義的。 根據每4周的時標準化發作次數。 b10毫克兩次每日口服的Deucrictibant IR膠囊。 c20毫克兩次每日口服的Deucrictibant IR膠囊。 此展示包括尚未獲得監管機構批准的調查產品的數據。
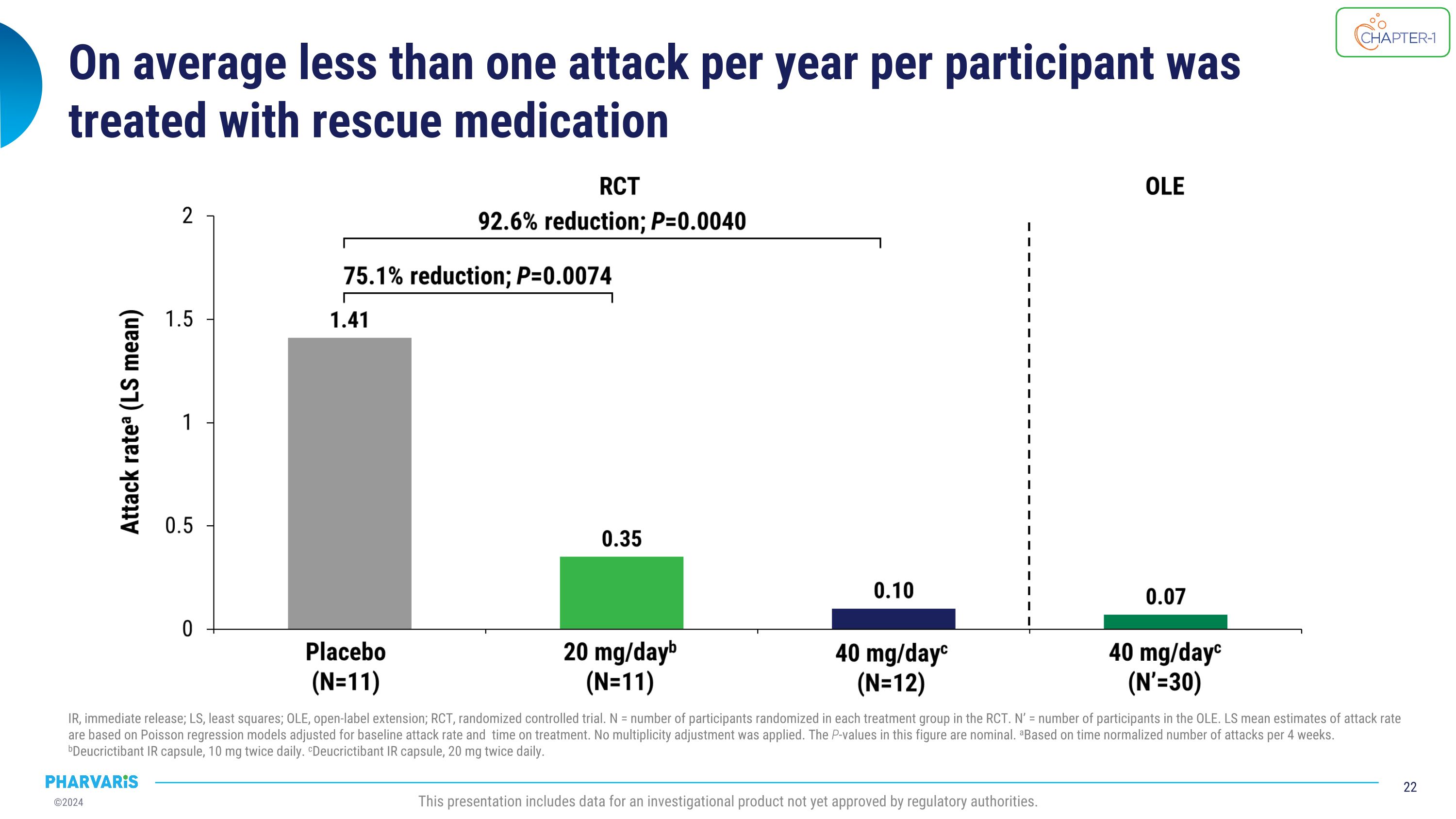
每位參與者每年平均不到一次的發作使用緊急救助藥物IR治療,即刻釋放;LS,最小二乘法;OLE,開放式延伸;RCt,隨機對照試驗。 N = 在RCt中每個治療組中隨機分配的參與者人數。 N' = 開放式延伸中的參與者人數。根據泊松回歸模型調整基線發作率和治療時間計算的LS平均發作率估計。未應用多重性調整。本圖中的P值爲名義上的。a基於每4周標準化攻擊次數。b迪克西特巴特IR膠囊,每天10毫克,每天兩次。c迪克西特巴特IR膠囊,每天20毫克,每天兩次。此展示包含尚未獲得監管機構批准的研究產品數據。
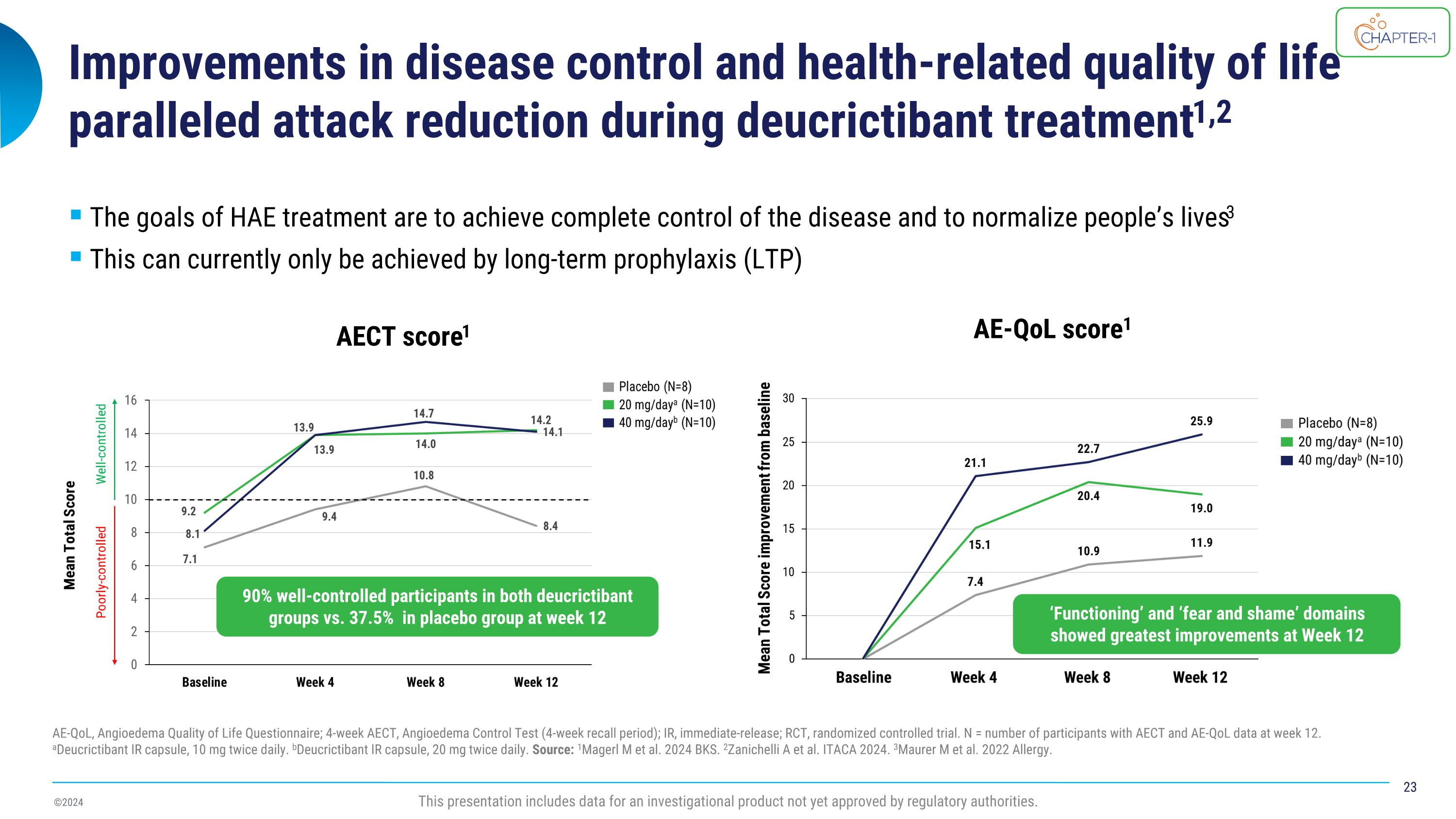
在deucrictibant治療期間,疾病控制和與健康相關的生活質量的改善與攻擊次數的減少相平行1,2 AE-QoL、血管性水腫生活質量問卷;4周AECt、血管性水腫控制測試(4週迴顧期);IR,即時釋放;RCt,隨機對照試驗。N = 12周時具有AECt和AE-QoL數據的參與者數。aDeucrictibant IR膠囊,每天10毫克2次。bDeucrictibant IR膠囊,每天20毫克2次。來源:1Magerl等。2024 BKS。2Zanichelli A等。ITACA 2024。3Maurer等。2022年過敏。HAE治療的目標是實現疾病的完全控制,並使人們的生活恢復正常3目前只能通過長期預防(LTP)來實現AE Ct得分1 AE-QoL得分1此演示包括尚未獲得監管機構批准的一種調查產品的數據。第12周,雙方deucrictibant組的受控率達到90%,安慰劑組爲37.5%「功能」和「恐懼與羞恥」領域在第12周顯示出最大的改善
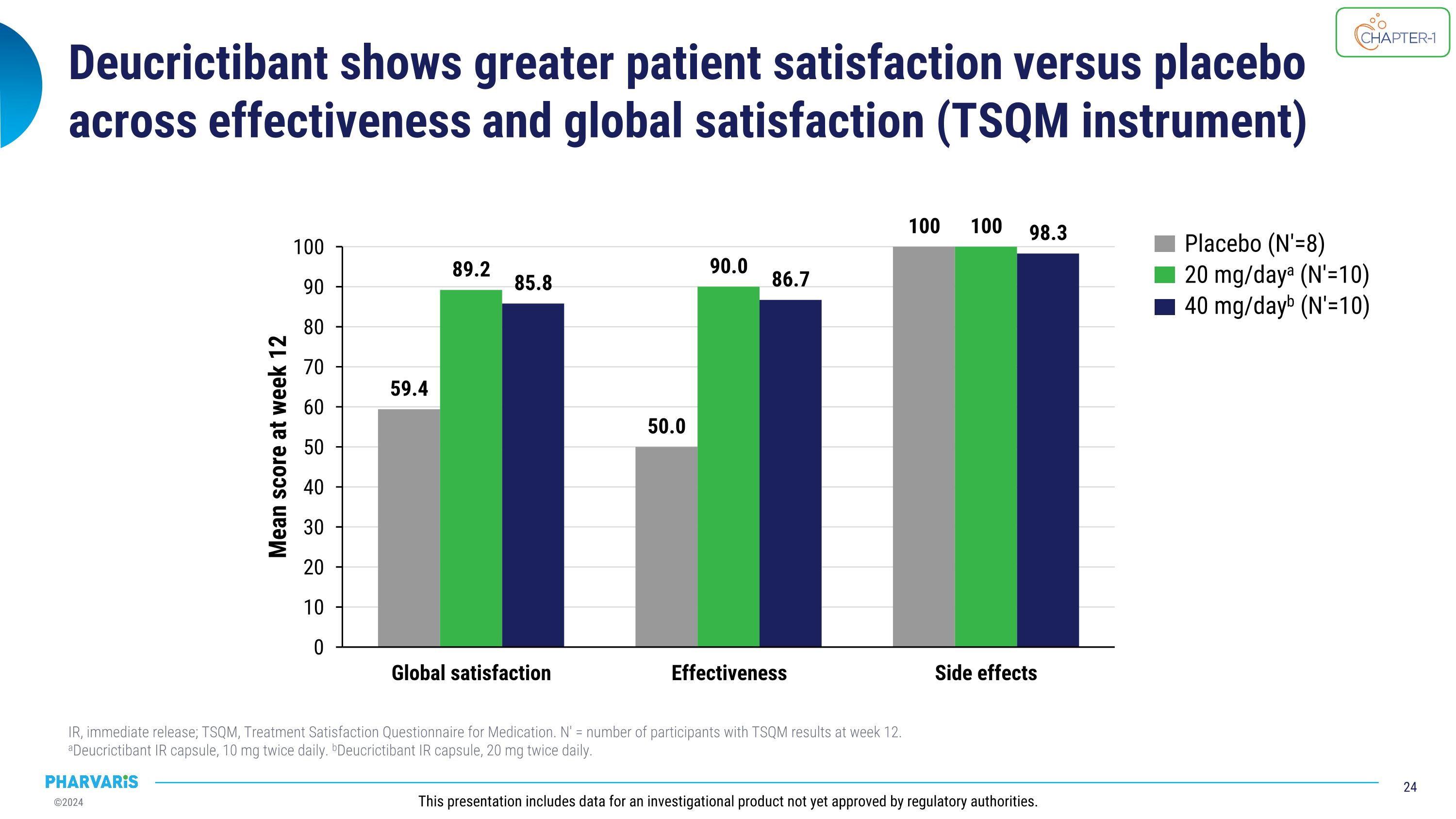
Deucrictibant在效果和全球滿意度(TSQm工具)方面顯示出比安慰劑更高的患者滿意度。即刻釋放(IR); TSQm,藥物治療滿意度問卷。N′ = 12周時具有TSQm結果的參與者人數。 aDeucrictibant IR膠囊,每日兩次10毫克。bDeucrictibant IR膠囊,每日兩次20毫克。此演示包括尚未獲得監管機構批准的研究性產品數據。安慰劑(N′=8)每日20毫克a (N′=10)每日40毫克b(N′=10)
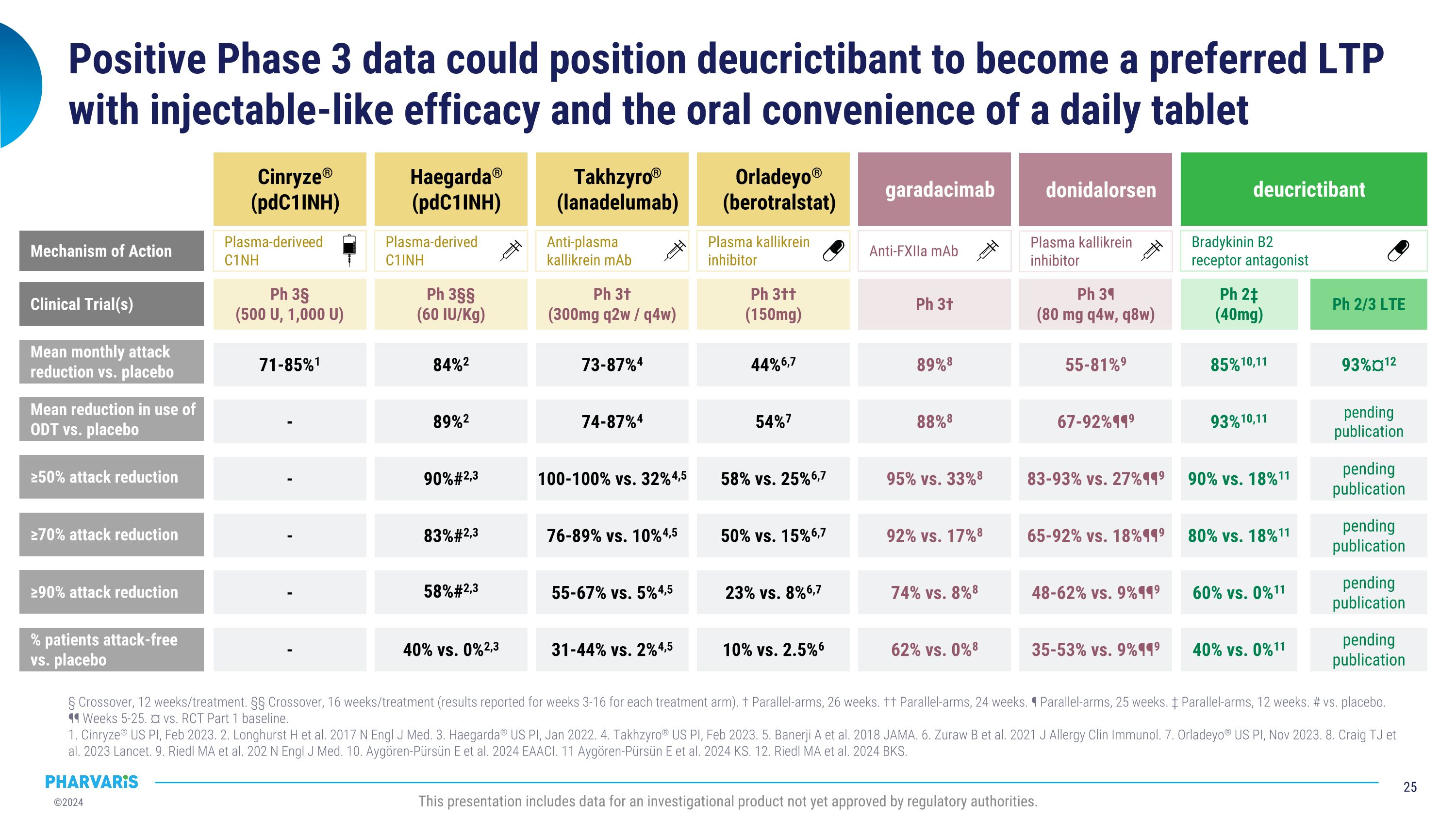
Phase 3積極的數據可能使Deucrictibant成爲首選的注射效力和每天一片便捷的口服藥片LTP。 12周/治療的交叉 16周/治療的交叉(對於每個治療組的3-16周的結果報道)。 對照研究 26周。 對照研究 24周。 對照研究 25周。 對照研究 12周。 與安慰劑相比。 ¶¶ 第5-25周。 對照RCt第一階段基線的比較。 1.Cinryze®美國藥品說明書,2023年2月。 2.Longhurst H等人。2017 N Engl J Med。 3.Haegarda®美國藥品說明書,2022年1月。 4.Takhzyro®美國藥品說明書,2023年2月。 5.Banerji A等人。2018年JAMA。 6.Zuraw b等人。2021年J Allergy Clin Immunol。 7.Orladeyo®美國藥品說明書,2023年11月。 8.Craig TJ等人。2023年《柳葉刀》。 9.Riedl MA等人。202 N Engl J Med。 10.Aygören-Pürsün E等人。2024年EAACI。 11.Aygören-Pürsün E等人。2024年KS。 12.Riedl MA等人。2024年BKS。 此報告包括未經監管機構批准的研究性產品數據。 與安慰劑相比,每月平均發作減少≥50%發作減少≥70% Cinryze® (pdC1INH) Haegarda® (pdC1INH) Takhzyro® (lanadelumab) Orladeyo®(berotralstat) garadacimab 89%8 95% vs. 33%8 92% vs. 17%8 74% vs. 8%8 62% vs. 0%8 71-85%1 - - - - 84%2 90%#2,3 83%#2,3 58%#2,3 40% vs. 0%2,3 73-87%4 100-100% vs. 32%4,5 76-89% vs. 10%4,5 55-67% vs. 5%4,5 31-44% vs. 2%4,5 44%6,7 58% vs. 25%6,7 50% vs. 15%6,7 23% vs. 8%6,7 10% vs. 2.5%6 ≥90%發作減少百分比與安慰劑相比抗FXIIa mAb 血漿激酶抑制劑抗血漿激酶抗體 血漿源性C1INH 血漿源性C1NH 作用機制 donidalorsen 55-81%9 83-93% vs. 27%¶¶9 65-92% vs. 18%¶¶9 48-62% vs. 9%¶¶9 35-53% vs. 9%¶¶9 血漿激酶抑制劑 deucrictibant 第3階段† 第3階段††(150mg) 第3階段† (300mg q2w / q4w) 第3階段§§ (60 IU/Kg) 第3階段§ (500 U, 1,000 U) 臨床試驗* 第3階段¶ (80 mg q4w, q8w) 第2階段‡ (40mg) 第2/3階段LTE 內啡肽B2受體拮抗劑85%10,11 90% vs. 18%11 80% vs. 18%11 60% vs. 0%11 40% vs. 0%11 93%¤12 未發佈 未發佈 未發佈 未發佈 對安慰劑使用ODt的平均減少率88%8 - 89%2 74-87%4 54%7 67-92%¶¶9 93%10,11 未發佈

第三章和第四章的臨床研究
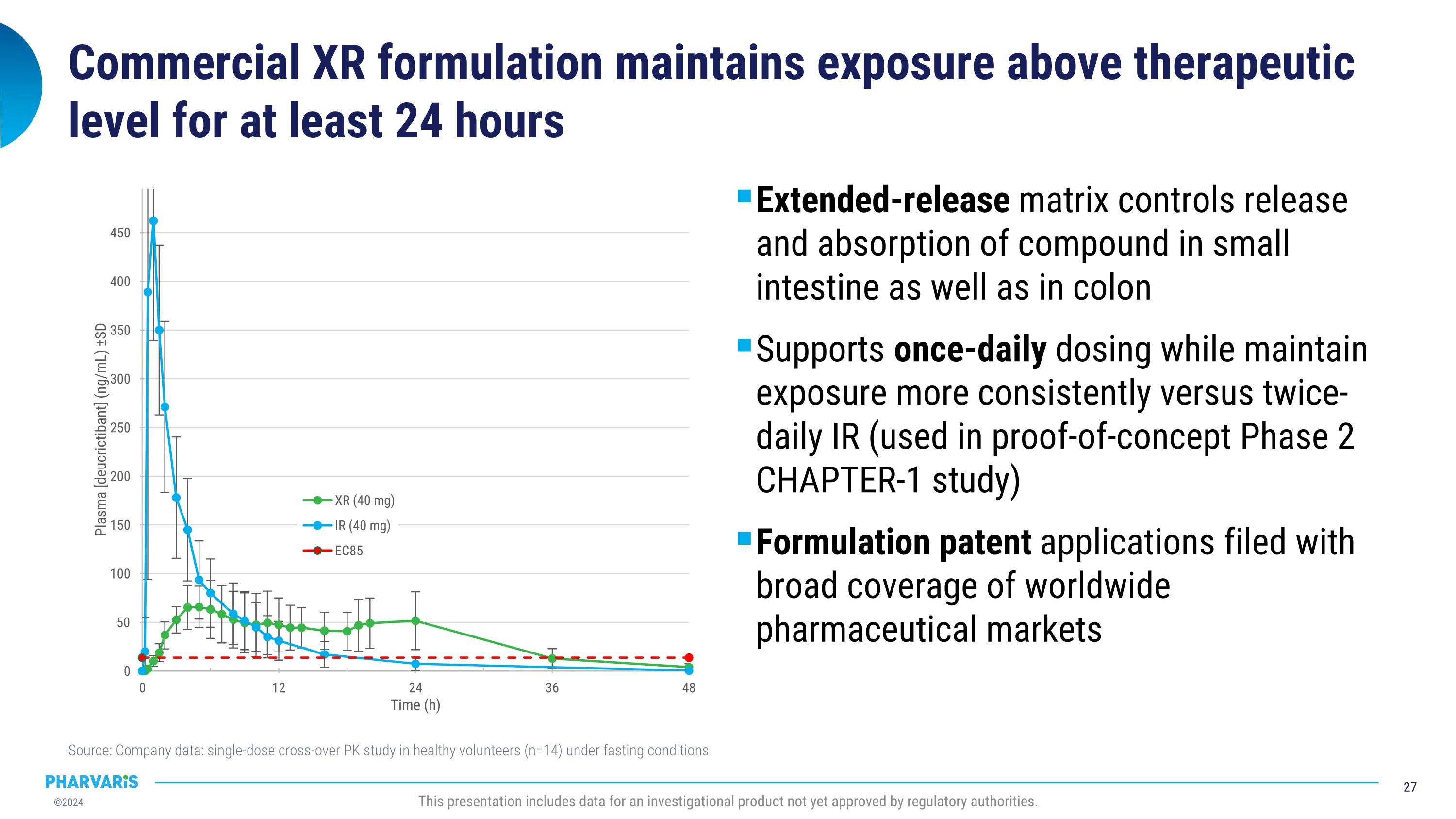
商業性XR劑型可保持治療水平至少24小時 延長釋放基質控制化合物在小腸和結腸內的釋放和吸收 與兩次IR(用於概念驗證第2章第1研究)相比,支持每日一次的給藥方式,同時更一致地維持暴露水平 藥品專利申請涵蓋了全球藥品市場 來源:公司數據:健康志願者(n=14)在空腹條件下的單劑交叉Pk研究 本報告包含尚未獲得監管機構批准的調查產品的數據。

第三章研究:一項全球性的3期研究,旨在對HAE患者進行預防性治療。目標招募約81名青少年和成年人,患有HAE的病人。計劃於2024年底啓動。研究目標:評估和描述研究者確認的HAE發作,在24周的治療期間的發生情況;治療相關不良事件的發生率;評估deucrictibant XR的藥代動力學;評估參與者報告的生活質量的變化;進入開放標籤延伸研究。此演示包含了尚未獲得監管機構批准的一種調查產品的數據。
按需服用 Deucrictibant 速釋膠囊

按需治療(ODT)長期預防(LTP)Deucrictibant的臨床開發用於ODt OLE:開放標籤延長。LTE:長期延長。 來源:1NCT05047185。2NCT04618211。3NCT05396105。4NCT06343779。第22期完成第2/3期LTE3正在進行第3期關鍵4正在進行第21期部分1:隨機對照主要分析(已完成) 部分2:開放標籤延長(進行中) 第3期關鍵創業公司第3期OLE創業公司該展示包括尚未獲得監管機構批准的一種調查性產品的數據。

症狀演變至緩解和消退。症狀進展臨床試驗終點跨越整個發作時間過程。AMRA,血管性水腫症狀評分量表;EoP,進展結束;HAE,遺傳性血管性水腫;IR,即時釋放;PGI-C,患者整體變化自評量表;PGI-S,患者整體嚴重程度自評量表;1. ClinicalTrials.gov.口服PHA-022121用於治療遺傳性血管性水腫急性發作的劑量範圍研究(RAPIDe-1)。網址:https://clinicaltrials.gov/study/NCT04618211。2024年8月訪問;2. Maurer等人. AAAAI 2022,海報。3. Riedl等人. ACAAI 2023,海報。4. ClinicalTrials.gov.口服PHA-022121治療遺傳性血管性水腫急性發作的延展研究(RAPIDe-2)。網址:https://clinicaltrials.gov/study/NCT05396105。2024年8月訪問;5. ClinicalTrials.gov.口服Deucrictibant軟膠囊治療青少年和成人遺傳性血管性水腫急性發作的研究(RAPIDe-3)。網址:https://clinicaltrials.gov/study/NCT06343779。2024年8月訪問。6. Maurer等人. EAACI 2024,海報。該報告包括尚未獲得監管當局批准的調查產品數據。時間(比例不一致)臨床表現Deucrictibant IR治療進展結束症狀緩解開始完全症狀消退RAPIDe-11,2,3RAPIDe-35,6AMRA所有3項≤10PGI-S「沒有」;AMRA所有3項≤10PGI-C「稍微好轉」;AMRA-3≥30%減少主要終點PGI-C「稍微好轉」症狀顯著緩解AMRA-3≥50%減少RAPIDe-24PGI-S「沒有」;AMRA所有3項≤10PGI-C「稍微好轉」AMRA≥30%減少;PGI-C「更好」;PGI-S減少≥1分;AMRA≥50%減少PGI-C「更好」;PGI-S減少≥1分;AMRA≥50%減少AMRA達到EoP的時間事後
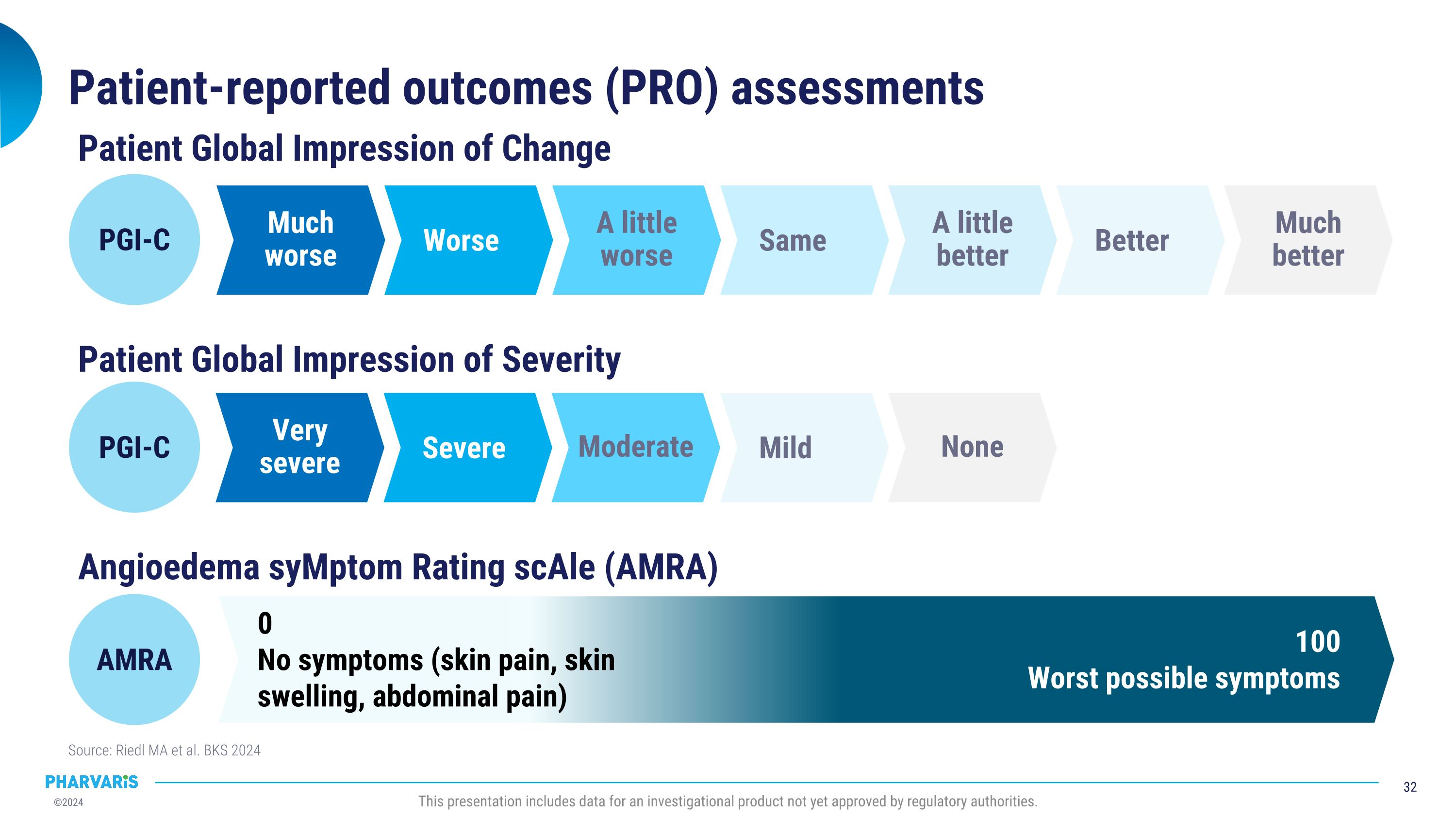
患者自評結果(PRO)評估來源:Riedl MA等。BKS 2024本演示文稿包括尚未獲得監管機構批准的試驗性產品的數據。患者整體改善評價 PGI-C 更壞 更差 稍差 與之同等 稍好 更好 顯著好轉 患者整體嚴重程度評價 非常嚴重 嚴重 中度 輕度 無 PGI-C 丘疹性水腫症狀評分尺度(AMRA) 100 最嚴重的症狀 0 沒有症狀(皮膚疼痛、皮膚腫脹、腹痛) AMRA

RAPIDe-1,一項關於HAE的季相2的隨需應變性研究。症狀惡化在25-26分鐘內結束*(基於AMRA-3)†2 症狀緩解發作在2.4小時內*(AMRA-3減少≥30%)1 救助藥物使用減少5倍*1 81.7%的發作在24小時內達到症狀緩解*(所有症狀複合體中的TOS PRO爲「好轉或緩解」)†3 所有劑量下的Deucrictibant耐受良好1 *集合10、20、30毫克Deucrictibant治療組 †基於事後分析 來源:1Maurer m等人 ACAAI 2023. 2 Riedl MA等人 ACAAI 2023. 3李H等人 EAC 2024. 達到主要終點:deucrictibant IR顯著 減少發作症狀與安慰劑相比*1 本報告包括尚未獲得監管機構批准的正在研究中產品的數據。
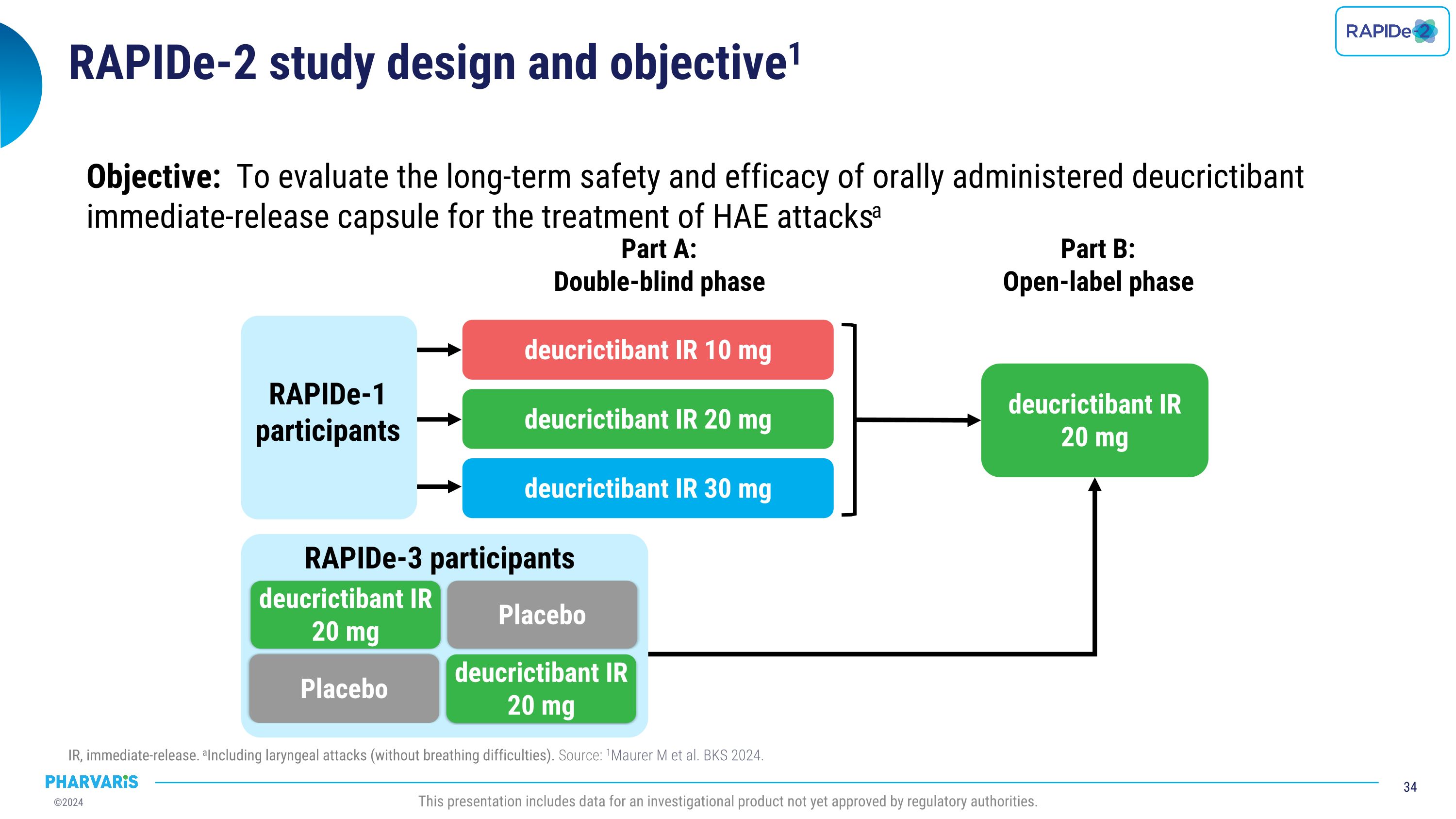
RAPIDe-2研究設計和目標1 IR,即時釋放。包括喉頭髮作(沒有呼吸困難)。來源:1Maurer m等人。BKS 2024。本報告包括尚未獲得監管機構批准的一種研究產品的數據。目標:評估口服即時釋放的deucrictibant膠囊用於HAE發作的長期安全性和有效性a部分A:雙盲階段B部分:開放標籤階段RAPIDe-1參與者deucrictibant IR 10毫克deucrictibant IR 20 mgdeucrictibant IR 30 mgdeucrictibant IR 20 mgRAPIDe-3參與者安慰劑deucrictibant IR 20 mg安慰劑deucrictibant IR 20 mg
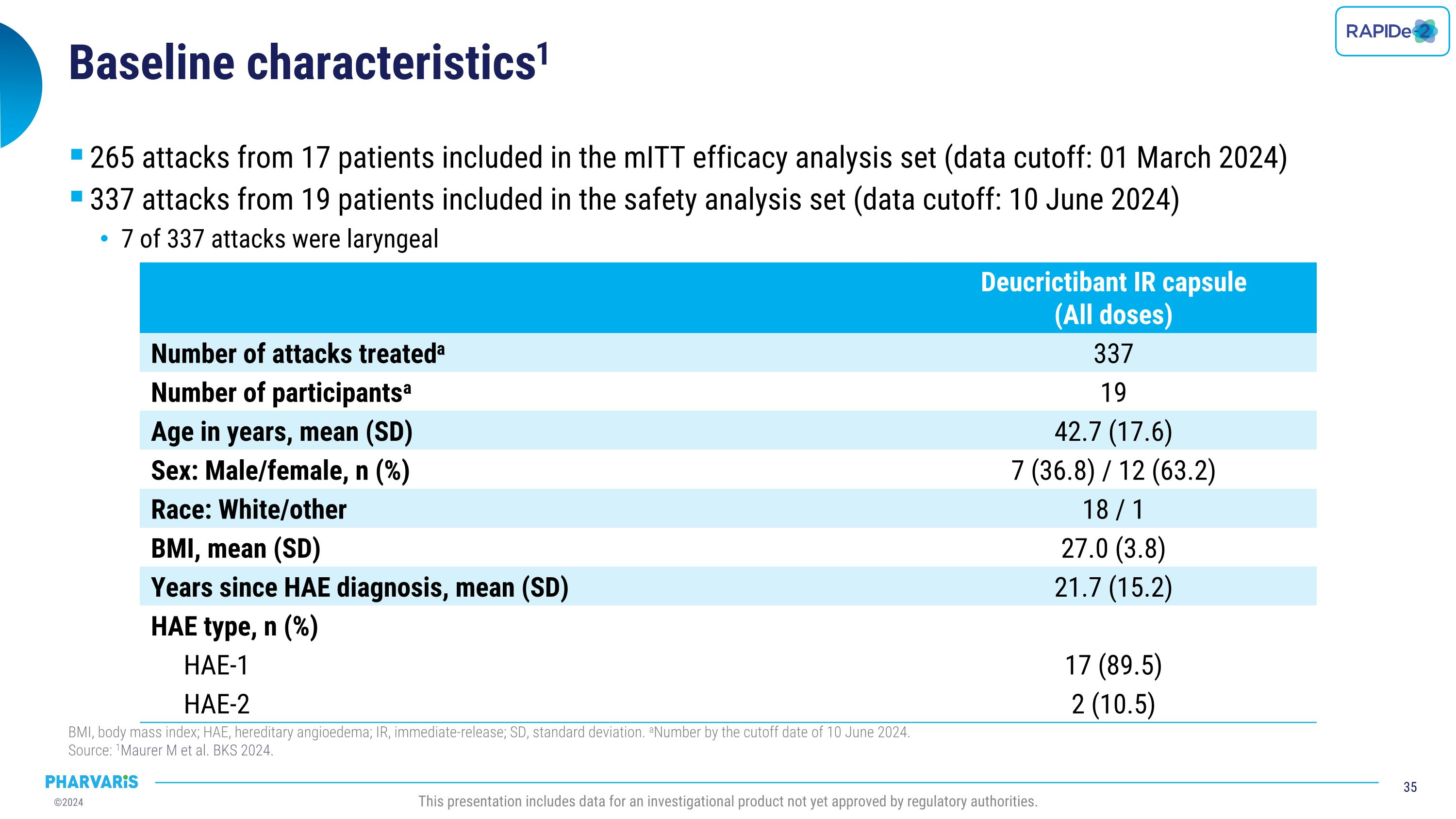
基線特徵:mITt有效性分析集合中包括了17名患者的265次發作(數據截止日期:2024年3月1日),安全性分析集合中包括了19名患者的337次發作(數據截止日期:2024年6月10日),其中7次發作爲喉部。BMI,身體質量指數;HAE,遺傳性血管水腫;IR,即時釋放;SD,標準偏差。截至2024年6月10日的數量。 來源:Maurer等人,BKS 2024。此報告包括尚未獲得監管機構批准的調查產品的數據。Deucrictibant IR膠囊(所有劑量)治療的發作次數:337,患者人數:19,年齡,均值(SD):42.7(17.6),性別:男性/女性,數量(%):7(36.8)/12(63.2),種族:白人/其他,18/1,BMI,均值(SD):27.0(3.8),自HAE診斷以來的年數,均值(SD):21.7(15.2),HAE類型,數量(%):HAE-1,17(89.5);HAE-2,2(10.5)
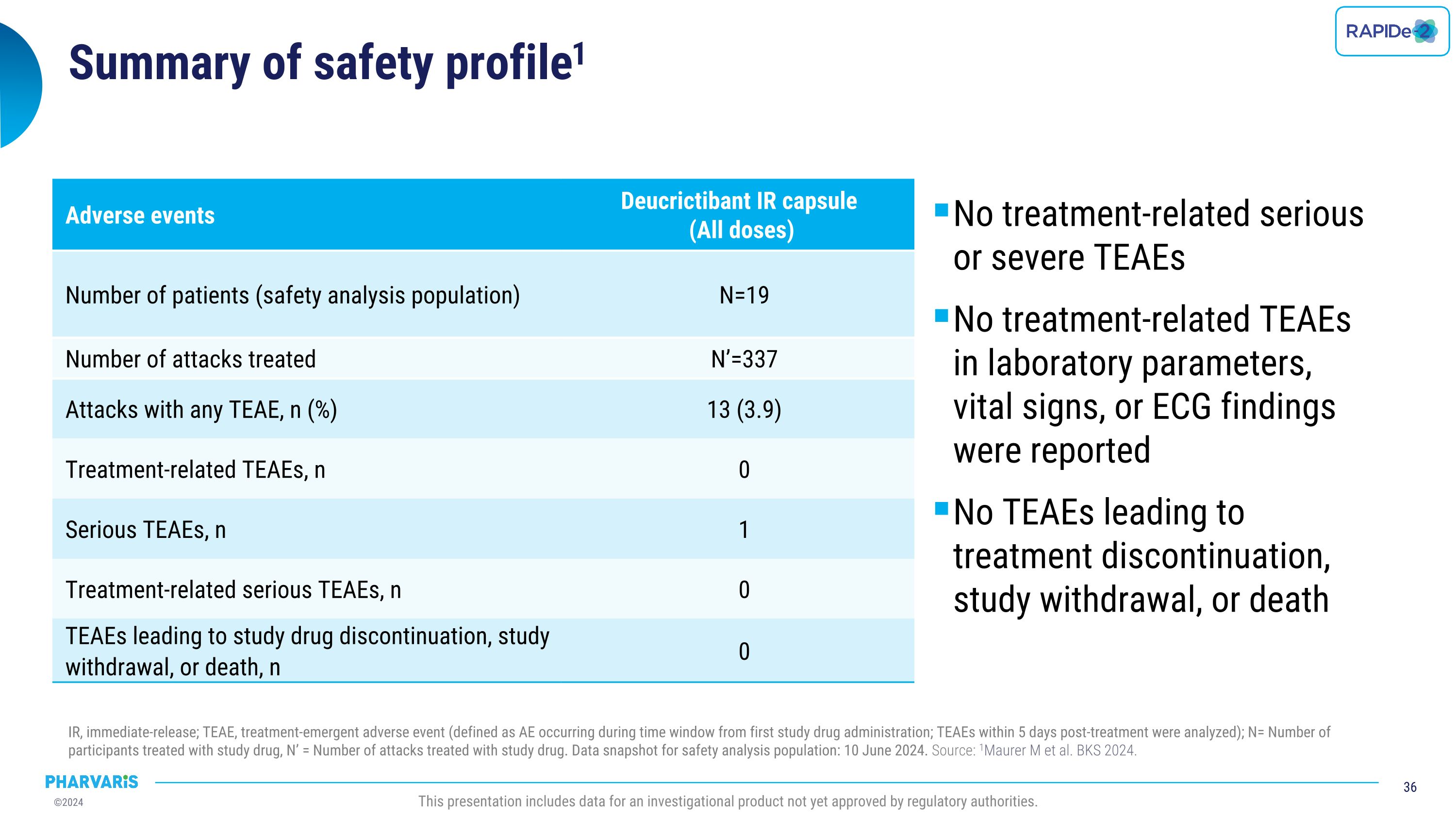
安全概況總結1 未出現與治療相關的嚴重或嚴重的治療相關不良事件 未報告與實驗室參數、生命體徵或心電圖結果相關的治療相關不良事件 未出現因不良事件導致的治療中斷、研究退出或死亡 立即釋放(IR);TEAE,治療期新出現的不良事件(定義爲首次接受研究藥物給藥後發生的不良事件;在發帖後5天內發生的TEAEs得以分析);N=接受研究藥物治療的參與者數量,N’=接受研究藥物治療的發作數量。安全分析人群的數據快照:2024年6月10日。來源: Maurer等人,BKS 2024。該報告包含尚未獲得監管機構批准的調查產品的數據。 不良事件 德克瑙他胺立即釋放膠囊(所有劑量) 患者數量(安全分析人群)N=19 接受治療的發作數量N’=337 有任何TEAE的發作,n(%)13 (3.9) 與治療相關的TEAEs,n 0 嚴重的TEAEs,n 1 與治療相關的嚴重的TEAEs,n 0 TEAEs導致研究藥物中斷、研究退出或死亡,n 0
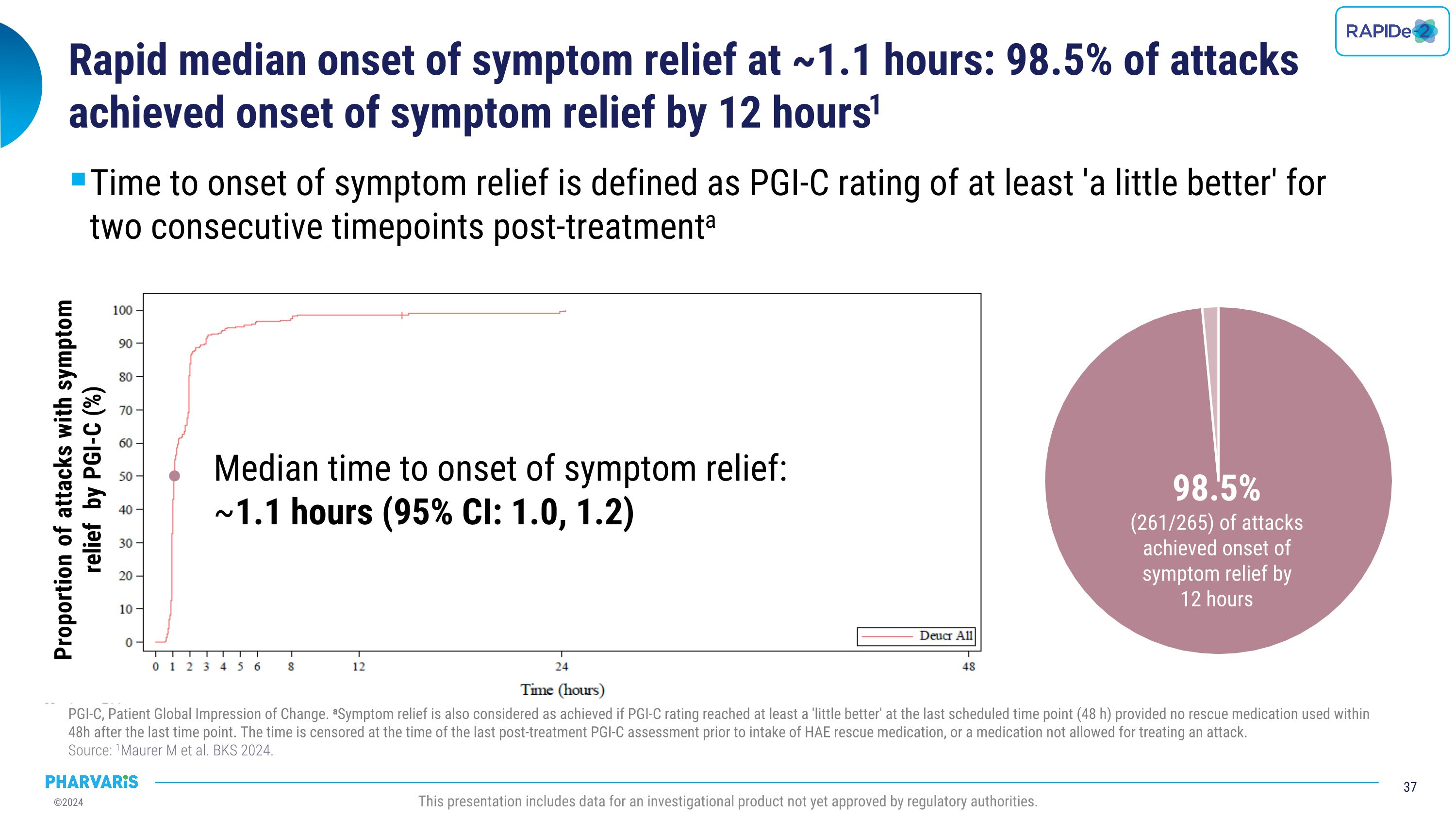
症狀緩解的快速中位數發作時間爲約1.1小時:98.5%的發作在12小時內實現了症狀緩解。症狀緩解發作時間被定義爲連續的兩個時間點治療後的PGI-C評分至少爲「稍微好轉」。PGI-C代表患者整體狀況的變化。如果最後一個預定時間點(48小時)內未使用救助藥物,並且在最後一次時點之後的48小時內未使用救助藥物,那麼也認爲已經實現了症狀緩解。時間以治療後最後一次PGI-C評估之前使用HAE救助藥物的時間爲截止點,或者使用了一種不被允許用於治療發作的藥物。 來源:1Maurer m et al. BKS 2024. 此演示包括一種尚未獲得監管機構批准的研究性產品的數據。根據PGI-C評分,症狀緩解的比例爲(%)症狀緩解的中位數發作時間爲:約1.1小時(95% CI:1.0, 1.2)
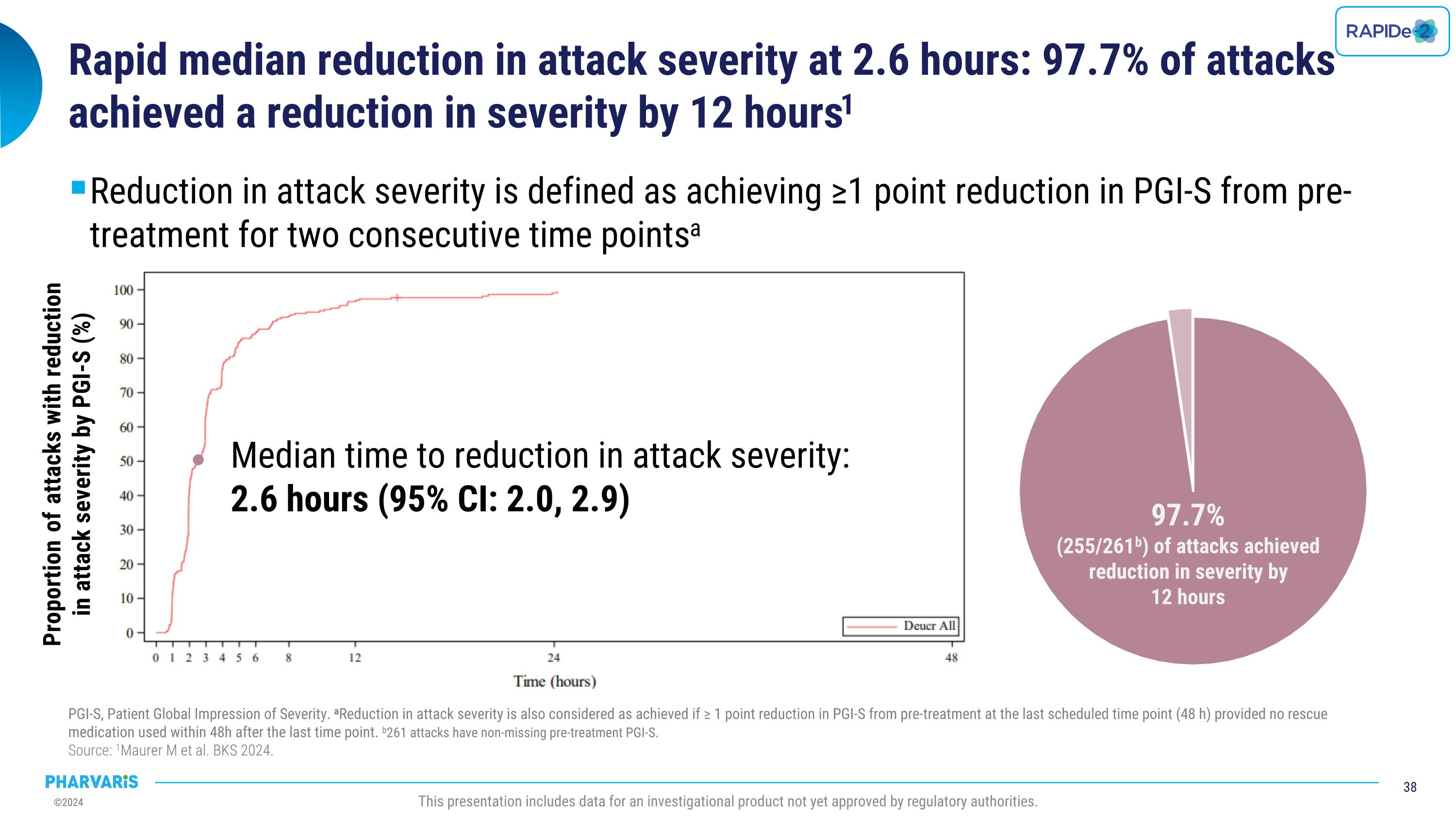
2.6小時內攻擊嚴重程度快速中位數降低:97.7%的攻擊在12小時內實現了嚴重程度的降低。攻擊嚴重程度的降低被定義爲在兩個連續時間點上達到PGI-S前治療的≥1分減少。PGI-S,患者全球印象嚴重程度。如果最後計劃的時間點(48小時)內未使用救援藥物,且在最後一個時間點後48小時內未使用救援藥物,則也可以認爲攻擊嚴重程度降低≥1分。261次攻擊有未缺失的前治療PGI-S值。 來源:1Maurer m等人,BKS 2024。本報告包括尚未獲得監管機構批准的研究產品的數據。降低攻擊嚴重程度的中位時間: 2.6小時(95% CI:2.0, 2.9)具有攻擊嚴重程度降低的比例按照PGI-S進行(%)
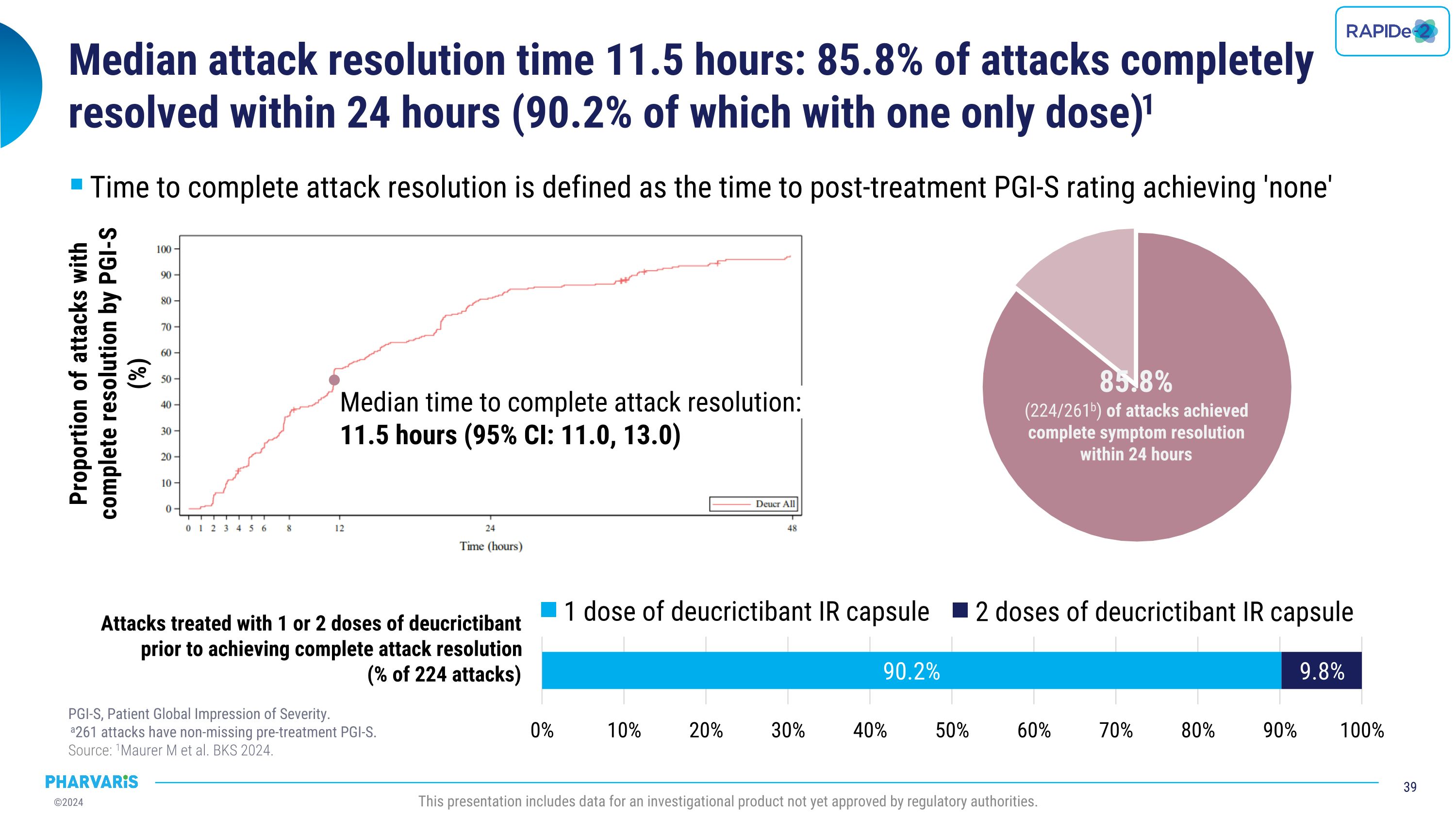
中單攻擊解決時間的中位數爲11.5小時:85.8%的攻擊在24小時內完全解決(其中有90.2%的攻擊僅需要一種藥物)。攻擊解決的時間被定義爲治療後的PGI-S評分達到「無」。共有261次攻擊的預治療PGI-S評分未缺失。來源:Maurer等人,《BKS 2024》,此展示包含尚未獲得監管機構批准的研究性產品的數據。攻擊完全解決的中位數時間:11.5小時(95% CI: 11.0, 13.0)PGI-S評分達到完全解決的攻擊比例(%):1劑脫克瑞替邦IR膠囊 2劑脫克瑞替邦IR膠囊在完全解決攻擊之前接受1或2劑脫克瑞替邦膠囊治療的攻擊的比例(224次攻擊的百分比)
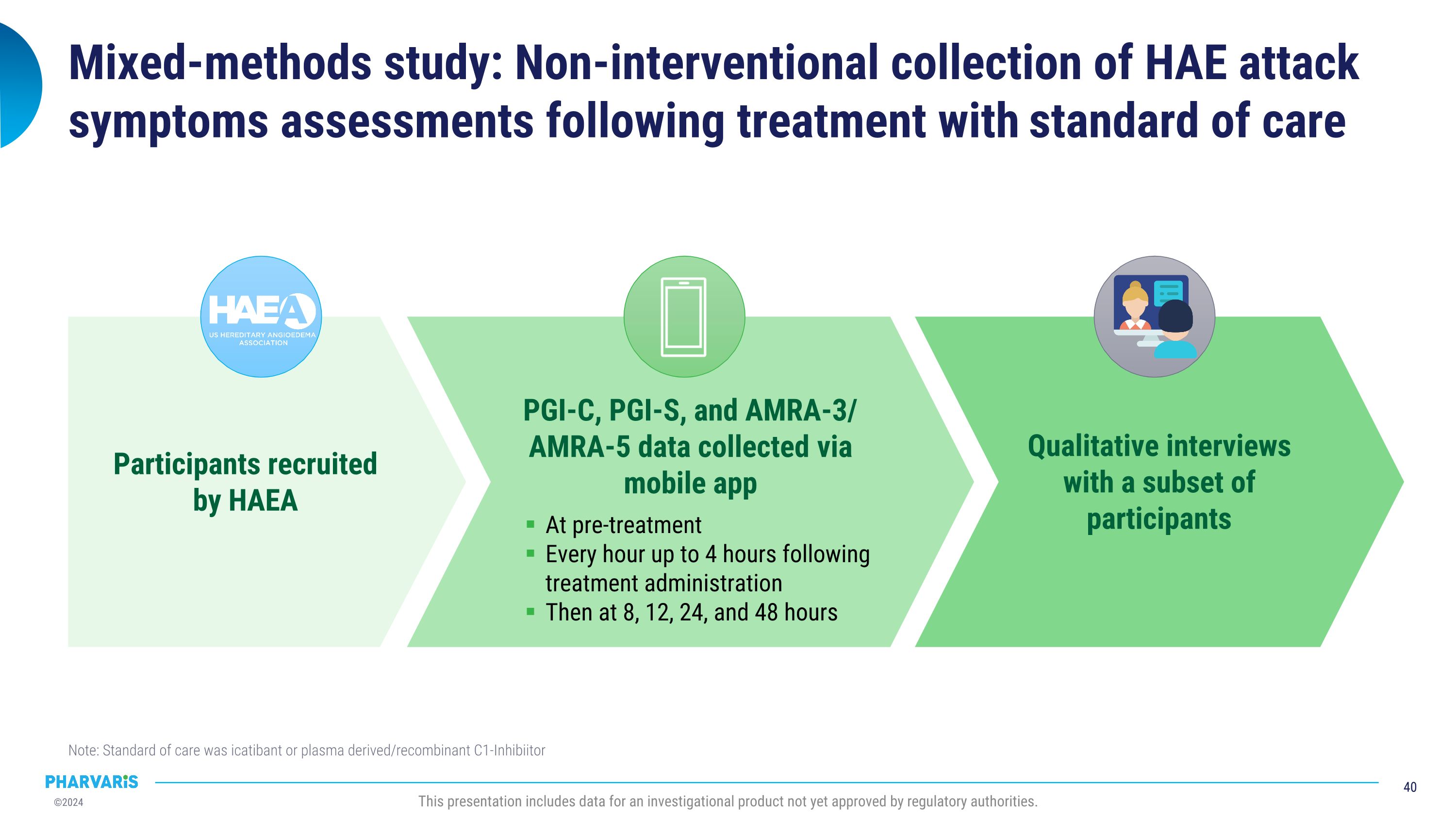
混合方法研究:標準護理治療後,非干預性收集HAE發作症狀評估,注意:標準護理爲icatibant或血漿衍生/重組C1抑制劑。此演示包括尚未獲得監管機構批准的調查產品的數據。通過HAEA PGI-C、PGI-S和AMRA-3/AMRA-5數據在移動應用程序上招募參與者。治療前每小時進行治療後4小時的監測然後在8、12、24和48小時時進行定性訪談與部分參與者
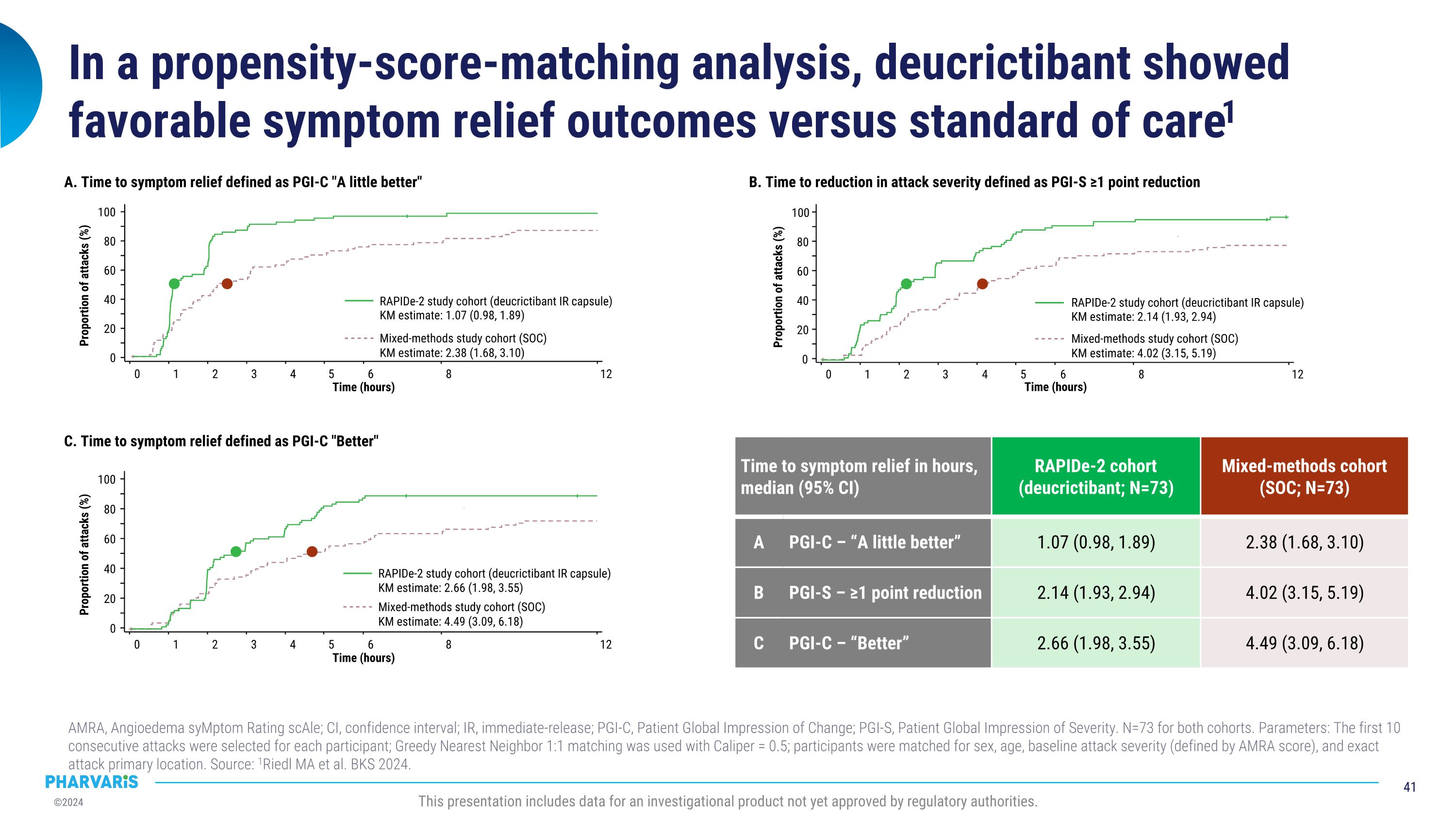
在傾向分數匹配分析中,與標準護理相比,deucrictibant顯示出良好的症狀緩解效果1。本演示文稿包括監管機構尚未批准的研究產品的數據。AMRA,血管性水腫症狀評級量表;CI,置信區間;投資者關係,即時釋放;PGI-C,患者全球變化印象;PGI-S,患者對嚴重程度的全球印象。兩個隊列的 N=73。參數:爲每位參與者選擇了前 10 次連續攻擊;使用 Caliper = 0.5 的 Greedy Nearest Neighbor 1:1 配對;根據性別、年齡、基準攻擊嚴重程度(由 AMRA 分數定義)和確切的攻擊主要位置對參與者進行匹配。資料來源:1Riedl MA 等人。BKS 2024。A. 症狀緩解時間定義爲 PGI-C 「好一點」 0 1 2 3 4 6 12 時間(小時)0 20 40 60 80 100 發作比例(%)混合方法研究隊列(SOC)Km 估計:2.38(1.68、3.10)Rapide-2 研究隊列(去氯替班投資者關係膠囊)Km 估計值:1.07(0.98,1.89)5 C。症狀緩解時間定義爲 PGI-C 「更好」 發作比例 (%) 0 8 1 2 5 3 4 6 12 時間(小時)0 20 40 60 80 100 混合方法研究隊列 (SOC) Km 估計值:4.49 (3.09, 6.18) Rapide-2 研究隊列(deucrictibant IR 膠囊)Km 估計值:2.66(1.98,3.55)b。攻擊嚴重程度降低定義爲 PGI-S 降低 ≥1 點攻擊比例 (%) 0 1 2 5 3 4 6 12 時間(小時)0 20 40 60 80 100 混合方法研究隊列 (SOC) Km 估計值:4.02 (3.15、5.19) Rapide-2 研究隊列(deucrictibant IR 膠囊)Km 估計值:2.14(1.93,2.94)8 出現症狀的時間以小時爲單位緩解,中位數(95% 置信區間)Rapide-2 隊列(deucrictibant;N=73)混合方法隊列(SOC;N=73)A PGI-C — 「好一點」 1.07(0.98,1.89)2.38(1.68,3.10)b PGI-S — 降幅≥1點 2.14(1.93,2.94)4.02(3.15,5.19)) C PGI-C — 「更好」 2.66 (1.98, 3.55)4.49 (3.09、6.18)

RAPIDe-3臨床研究
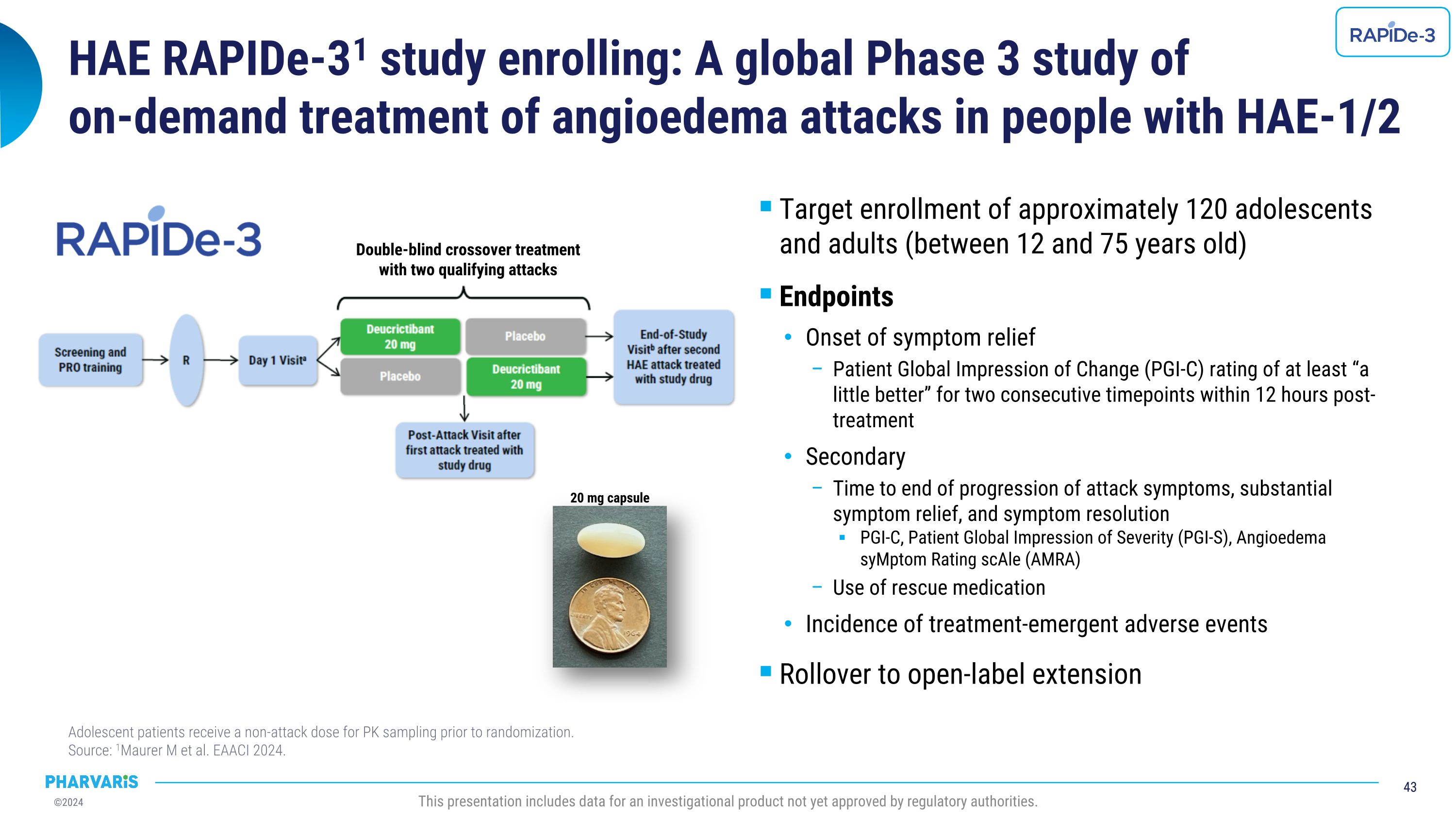
HAE RAPIDe-31研究正在招募:一項針對HAE-1/2患者的全球性3期研究,研究內容爲按需治療血管性水腫發作,幷包括約120名12至75歲的青少年和成年人。終點評估包括症狀緩解的起始時間、患者整體改善印象(PGI-C)評分在12小時內至少連續2次達到「稍有好轉」,次要終點評估包括髮作症狀進展結束時間、明顯的症狀緩解和症狀緩解,PGI-C、患者整體嚴重程度評估(PGI-S)、血管性水腫症狀評分量表(AMRA)、急救藥物使用、治療相關不良事件的發生率,青少年患者在隨機化之前需接受非發作劑量用於藥代動力學採樣。 來源:1Maurer m et al. EAACI 2024. 20毫克膠囊。此演示文稿包括尚未獲得監管機構批准的待批治療產品數據。雙盲交叉治療,涵蓋兩次符合資格的發作。
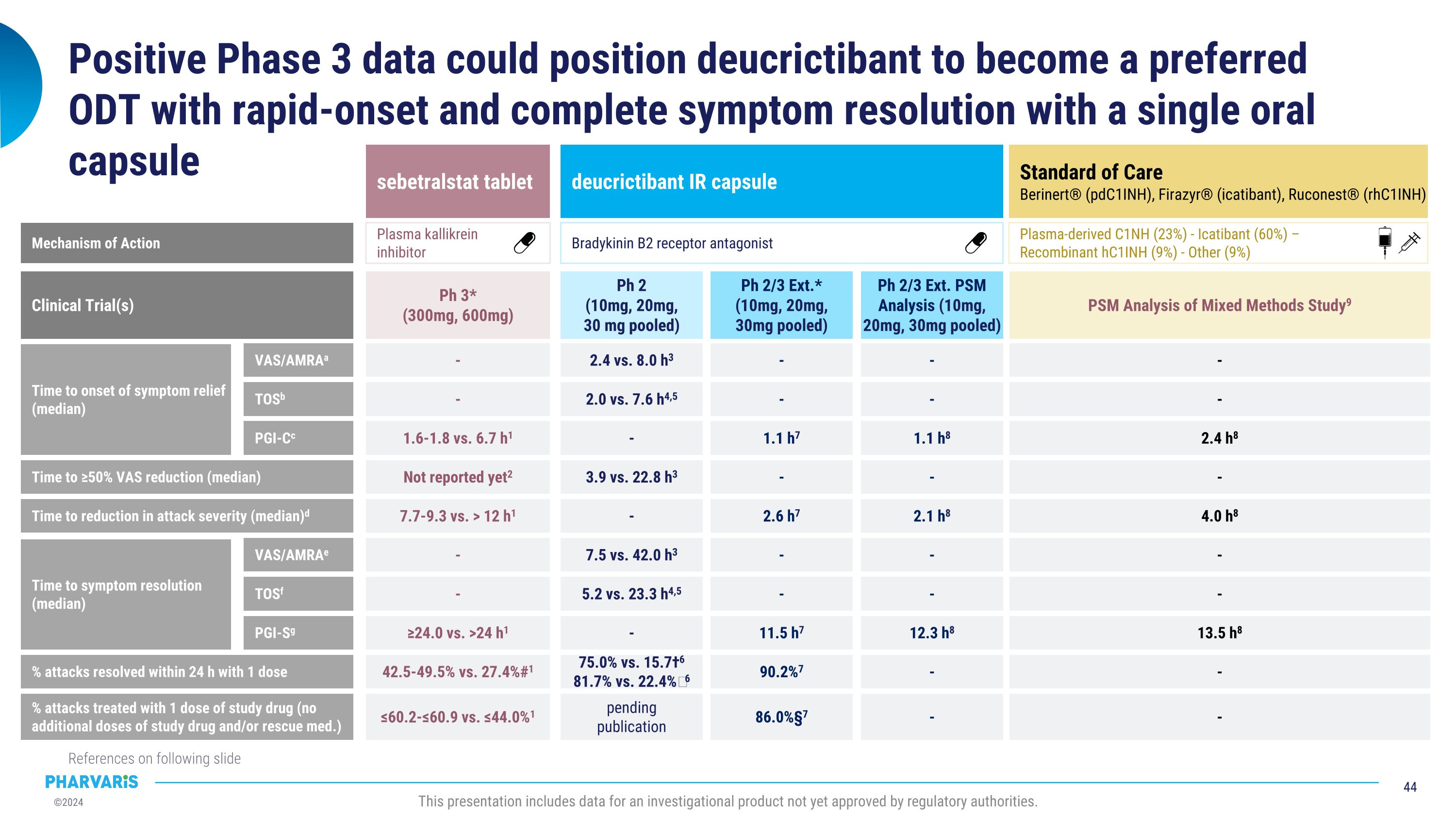
血漿源性C1NH(23%) - Icatibant(60%) - 重組hC1INH(9%) - 其他(9%)積極的3期數據可能讓deucrictibant成爲首選ODt,並通過一顆口服膠囊實現快速緩解症狀和完全緩解症狀。以下幻燈片上有參考文獻。本演示文稿包含尚未獲得監管機構批准的研究性產品的數據。症狀緩解的時間(中位數) 標準治療 Berinert®(pdC1INH),Firazyr®(icatibant),Ruconest®(rhC1INH) - - 2.4小時8 - 4.0小時8 - - 13.5小時8 - 混合方法研究的PSm分析9 臨床試驗 時間達到VAS降低50%(中位數) 攻擊嚴重程度降低時間(中位數) 症狀緩解時間(中位數) 攻擊緩解百分比(1劑量內24小時內) - 用一劑量治療攻擊的百分比(無額外劑量的研究藥物和/或救護藥物) VAS / AMRAa TOSb PGI-Cc VAS / AMRAe TOSf PGI-Sg 動作機制 sebetralstat片劑 deucrictibant IR膠囊 2.4小時vs.8.0小時3 - 2.0小時vs.7.6小時4,5 - - 1.1小時7 3.9小時vs.22.8小時3 - - 2.6小時7 7.5小時vs.42.0小時3 - 5.2小時vs.23.3小時4,5 - - 11.5小時7 75.0% vs. 15.7†6 81.7% vs. 22.4%‖6 90.2%7 - - 1.6-1.8小時vs.6.7小時1 尚未報告2 7.7-9.3小時vs.> 12小時1 - - ≥24.0小時vs.> 24小時1 42.5-49.5% vs. 27.4%#1 Ph 2(10毫克,20毫克,30毫克混合) Ph 2/3 Ext.*(10mg, 20mg, 30mg混合) Ph 3*(300mg, 600mg)待發表 86.0%§7 ≤60.2-≤60.9% vs. ≤44.0%1 腦缺血 B2受體拮抗劑 血漿激肽清蛋白酶抑制劑 - - 1.1小時8 - 2.1小時8 - - 12.3小時8 - Ph 2/3 Ext. PSm分析(10mg,20mg,30mg混合) -

ODt比較數據參考 * 用於治療藥物的發作包括非喉部和喉部的發作。#通過PGI-S評估症狀緩解。†通過VAS / AMRA評估症狀緩解。‖通過TOS評估症狀緩解。a.通過VAS / AMRA定義爲「從治療前評分減少30%以上的VAS-3」在3箇中減輕的症狀的開始時間解釋爲「VAS / AMRA的緩解症狀開始時間定義爲「基線受影響的所有症狀群在兩個或多個連續時間點上首次達到至少對所有其他症狀群沒有新出現症狀的少量改善」」,如果改善在兩個連續時間點上持續。”在4,5. c.通過PGI-C定義爲「症狀緩解的開始時間如在時間事件分析中評估的那樣。」緩解症狀的開始被定義爲在試劑首次給藥後的12小時內,在7個和8個時間點以及在1個時間點之內,使用了7點病人整體變化評估量表(PGI-C)的評分(評分範圍從「好多」到「糟糕多」),評分範圍達到了兩個或更多連續時間點。””在1個和7個時間點的至少有連續的兩個時間點”以及在試劑給藥後的12小時內下降了7,8. d.通過PGI-S評估爲「發作嚴重程度的降低被定義爲在首次給藥後的12小時內,在1個時間點上改善的5點病人整體嚴重程度評估量表(PGI-S)的評分(評分從「無」到「非常嚴重」)達到了兩個或更多連續時間點。」”在7個和8個試劑給藥後的12小時內,從治療前獲得了≥1分緩解嚴重程度的病人整體嚴重程度評估量表(PGI-S)到達了連續的兩個時間點。”’e.通過VAS / AMRA定義爲「所有3個單獨的VAS項目≤10。」在3箇中解釋的症狀緩解的開始時間解釋爲「TOS根據『基線受影響的所有症狀群首次達到『好多或緩解』並且在任何其他症狀群中沒有新症狀報告的時間點』。」”在.4,5 g.通過PGI-S評估解釋爲「在治療後24小時達到PGI-S評分爲「無」」在1個和7箇中的連續兩個時間點。”點,.1. Riedl MA等 2024年N Engl J Med。 2. https://www.clinicaltrialsregister.eu/ctr-search/trial/2021-001226-21/DE(於2024年9月2日訪問)。 3. Maurer m等 2023年AAAAI。 4. Riedl MA等 2023年C1INH研討會。 5. RAPIDe-1 Phase 2 Top-line data presentation,https://ir.pharvaris.com/static-files/733117c4-4632-4bd6-a930億.9484c46e063c(於2024年9月2日訪問)。 6. Li HH等2024年EAC。 7. Maurer m等2023年BKS。 8. Riedl MA等2024年BKS。 9. Mendivil等2023年UCARE此演示包括尚未獲得監管當局批准的研究用產品的數據。

我們的策略是成爲HAE市場的領導者,注:這是一個願景,需要通過第三階段臨床數據來確認 這份演講包括了尚未獲得監管機構批准的研究性產品的數據 1 2 4 3 贏得口服LTP市場 成爲首選LTP利用 B2R拮抗劑MoA的組合 成爲ODt LTP的標準護理 在HAE社區進行深度合作的基礎上開始

超越HAE
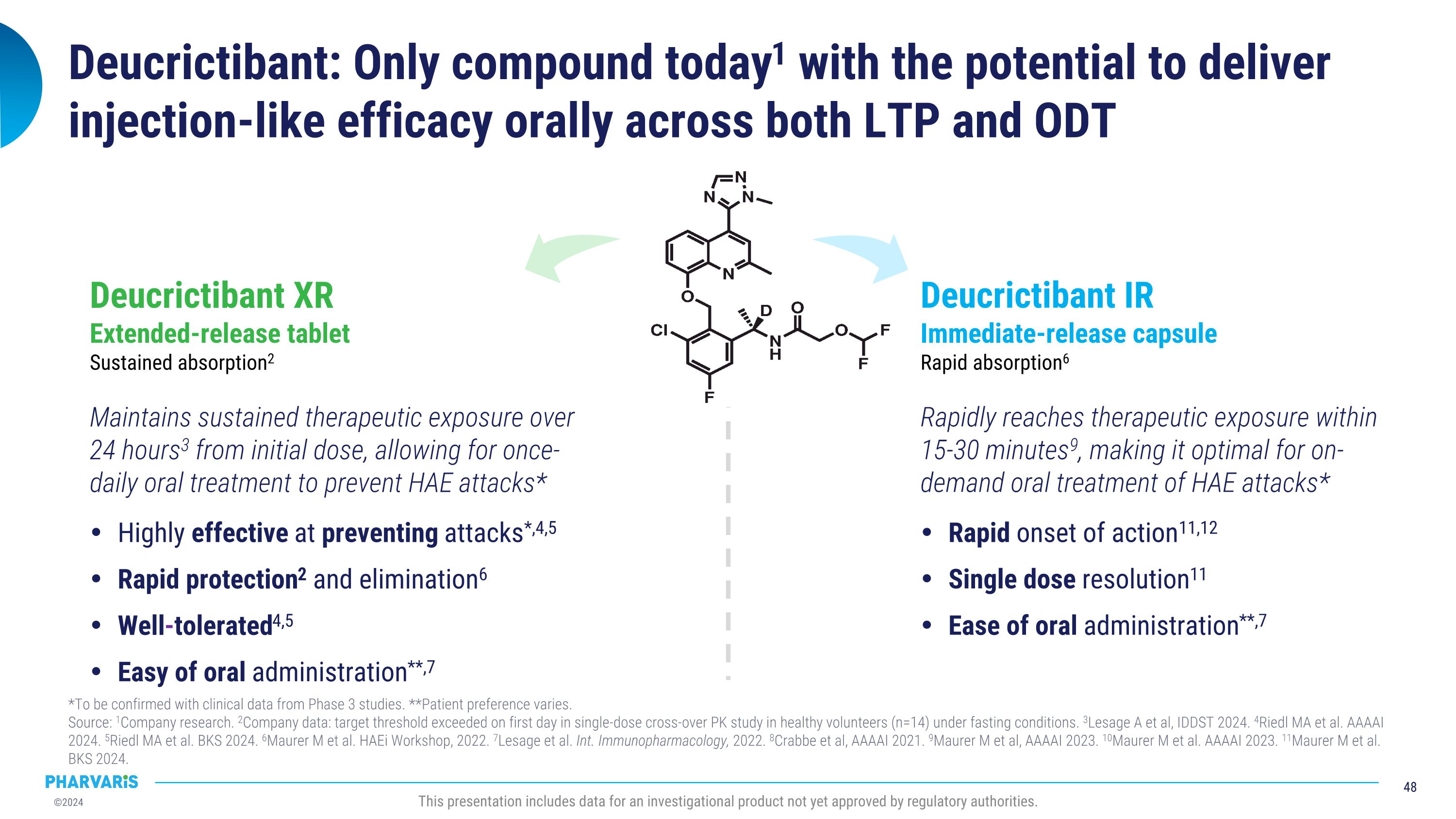
說明:今日只有compound1有潛力在LTP和ODt兩方面實現口服注射般的療效*需通過第3期臨床數據確認。**患者偏好因人而異。 來源:1公司研究。2公司數據:單劑量交叉PK研究中,健康志願者(n=14)在空腹條件下首日達到目標閾值。3Lesage A等人,IDDSt 2024. 4Riedl MA等人,AAAAI 2024. 5Riedl MA等人,BKS 2024. 6Maurer中單等人,HAEi Workshop,2022. 7Lesage等人,Int. Immunopharmacology,2022. 8Crabbe等人,AAAAI 2021. 9Maurer中單等人,AAAAI 2023. 10Maurer中單等人,AAAAI 2023. 11Maurer中單等人,BKS 2024. 本演示包括尚未獲得監管機構批准的一種調查性產品的數據。Deucrictibant XR 延長釋放片 持續吸收2 從初始劑量開始,維持持續治療曝光,每24小時3次,可實現一天一次的口服治療,預防HAE發作*在預防發作*4,5方面效果顯著,保護快2和消除6良好耐受性4,5口服易**,7 Deucrictibant IR 即時釋放膠囊 快速吸收6 15-30分鐘9內迅速達到治療曝光,最適合HAE發作的即時口服治療* 快速起效11,12單劑量解決方便11口服易**,7
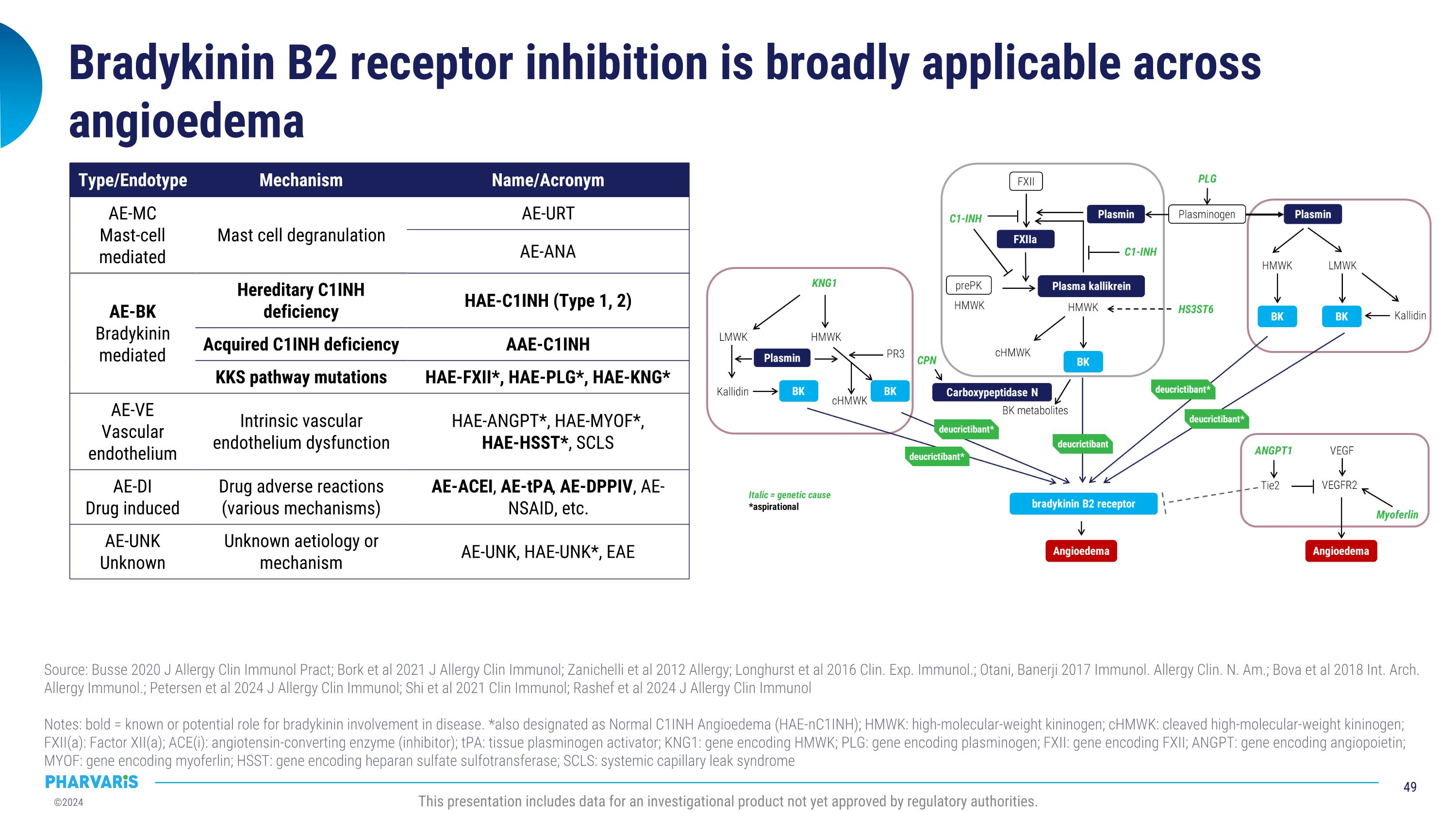
佈雷地昆B2受體抑制在血管性水腫上具有廣泛適用性來源:布斯2020年《過敏與臨床免疫學實踐雜誌》;博克等2021年《過敏與臨床免疫學雜誌》;扎尼基利等2012年《過敏症期刊》;朗赫斯特等2016年《臨床與實驗免疫學雜誌》;奧塔尼、巴內爾吉2017年《免疫與過敏症臨床北美版》;博瓦等2018年《國際過敏與免疫學檔案》;彼得森等2024年《過敏與臨床免疫學雜誌》;實等2021年《臨床免疫學雜誌》;拉希弗等2024年《過敏與臨床免疫學雜誌》備註:粗體=已知或潛在的佈雷地昆參與疾病的作用。*也被指定爲正常C1INH血管性水腫(HAE-nC1INH);HMWK:高分子量激肽原;cHMWK:裂解的高分子量激肽原;FXII(a):第XII因子(a);ACE(i):血管緊張素轉換酶(抑制劑);tPA:組織纖溶酶原激活物;KNG1:編碼HMWK的基因;PLG:編碼纖溶酶原的基因;FXII:編碼FXII的基因;ANGPT:編碼血管生成素的基因;MYOF:編碼myoferlin的基因;HSST:編碼硫酸肝素硫轉移酶的基因;SCLS:全身毛細血管漏綜合徵類型/終止型機制名稱/縮寫AE-MC肥大細胞介導肥大細胞脫顆粒AE-URtAE-ANA AE-Bk佈雷地昆介導家族性C1INH缺乏症HAE-C1INH(類型1、2)獲得性C1INH缺乏症AAE-C1INH KKS通路突變HAE-FXII*,HAE-PLG*,HAE-KNG* AE-VE血管內皮固有血管內皮功能障礙HAE-ANGPT*,HAE-MYOF*,HAE-HSST*,SCLS AE-DI藥物引起藥物不良反應(各種機制)AE-ACEI,AE-tPA,AE-DPPIV,AE-NSAID,以太經典 AE-UNk未知未知的病因或機制AE-UNk,HAE-UNK*,EAE該報告包含一個尚未獲得監管機構批准的調查產品的數據。
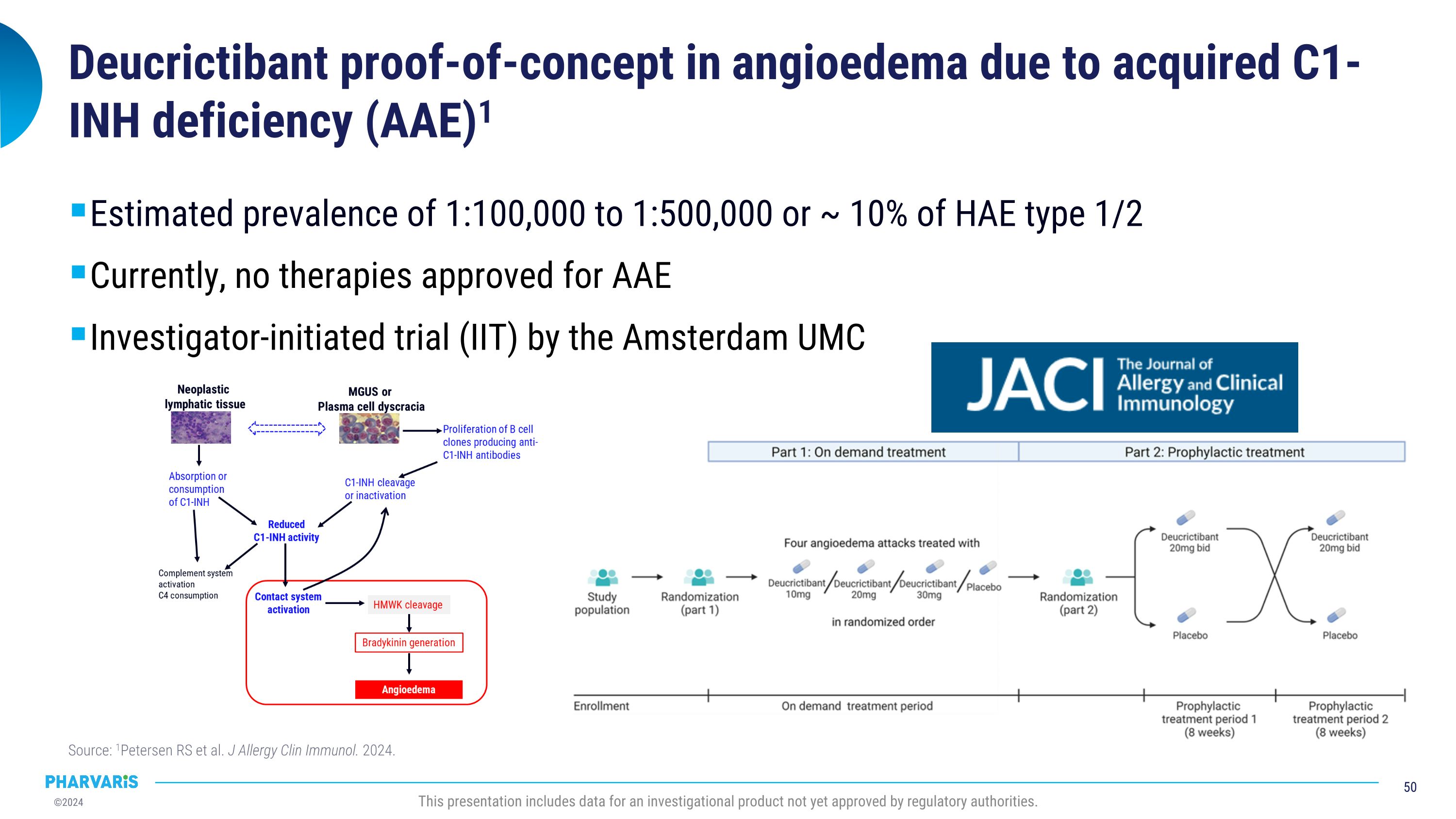
通過獲得性C1-INH缺乏引起的血管性水腫的自證概念板塊(AAE)的病例研究1,估計患病率爲100,000至500,000(或HAE類型1/2的約10%)。目前,尚無治療AAE的批准療法。阿姆斯特丹大學醫療中心的研究組發起的試驗(IIT)。資料來源:1Petersen RS等人。《過敏與免疫》雜誌。2024年。本報告顯示了尚未獲得監管機構批准的一種調查產品的數據。
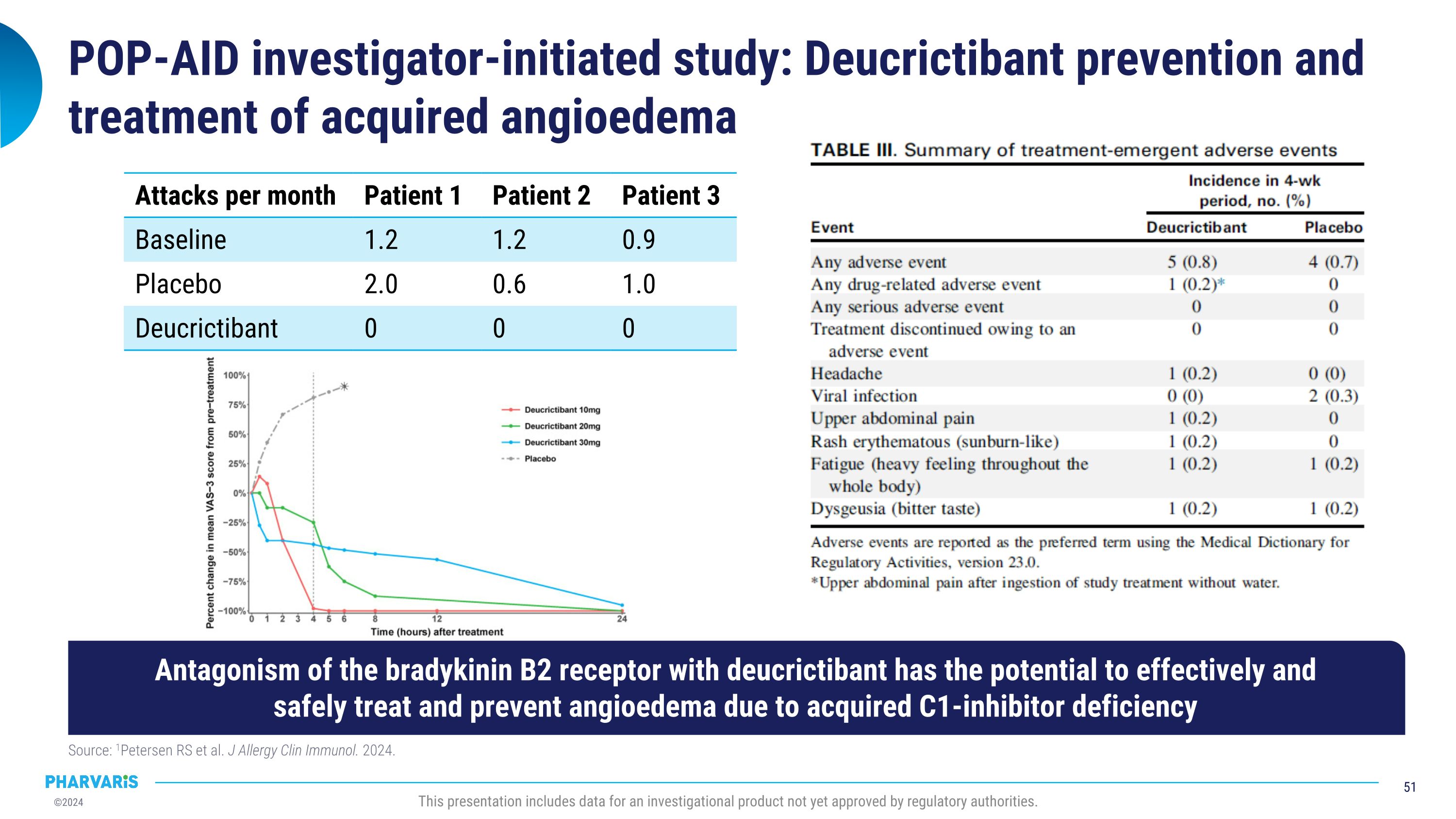
POP-AID調查員發起的研究:Deucrictibant預防和治療獲得性血管性水腫來源:1Petersen RS等人。J Allergy Clin Immunol. 2024.此演示包括尚未獲得監管機構批准的調查性產品的數據。每月發作次數 患者1 患者2 患者3 基線 1.2 1.2 0.9 安慰劑 2.0 0.6 1.0 Deucrictibant 0 0 0 通過Deucrictibant對激肽酶B2受體的拮抗作用,具有潛力有效且安全地治療和預防獲得性C1-抑制劑缺陷引起的血管性水腫

罕見的過敏與免疫疾病(商業)Bk介導的疾病(研發)Bk介導的血管性水腫:nC1,AAE Pharvaris希望藉助其基礎的B2R專業知識,爲HAE之外的疾病開發治療方案:HAE Type 1/2。此演示包括尚未獲得監管機構批准的調查性產品的數據。

www.pharvaris.com 納斯達克: PHVS 本報告包含尚未獲得監管機構批准的調查產品的數據。

PHVS有野心將deucrictibant的潛力發展成爲偏好的治療bradykinin介導疾病的選擇 來源:1Riedl MA等。BKS 2024。2Maurer m等。BKS 2024。3公司研究。4Petersen RS等。J Allergy Clin Immunol。2024。5Lesage等。Int。Immunopharmacology, 2022年 長期HAE延展數據1,2鞏固了我們對deucrictibant成爲HAE AAE管理的首選選擇的信心 基於社區的興趣3和初始令人感興趣的數據4,PHVS計劃在AAE nC1中推進deucrictibant的開發 利用B2受體作用機制5,潛在應用於正常C1-INH遺傳性血管性水腫