
为患者选择开创性的科学企业展示2024年9月陈列品99.4

免责声明 本报告包含一定的“前瞻性陈述”,这些陈述涉及重大风险和不确定性。本报告中所有与历史事实无关的陈述均应被视为前瞻性陈述,包括但不限于含有“相信”、“预计”、“期望”、“估计”、“可能”、“可以”、“应该”、“将”、“意图”等字样的陈述。我们在很大程度上基于我们对未来事件和趋势的当前预期和预测,认为这些事件和趋势可能对我们的财务状况、经营业绩、业务策略和财务需求产生影响。此类前瞻性陈述涉及未知风险、不确定性和其他因素,可能导致我们的实际结果、财务状况、业绩、成就或行业结果与任何未来结果、业绩或成就以及由此类前瞻性陈述所隐含的结果显著不同。可能导致此类差异的因素包括但不限于我们与监管机构(包括FDA)的互动结果不确定、我们临床开发计划(尤其是deucrictibant)的预期时间、进展或成功,这些计划目前处于全球晚期临床试验阶段,我们能否在进行中和将来的非临床研究和临床试验中复制RAPIDe-1、RAPIDe-2和CHAPTER-1 Phase 2研究所展示的疗效和安全性引起的风险,流行病(如COVID-19大流行)可能对我们的业务、非临床研究和临床试验产生不利影响,监管批准的结果和时间、普通股股票价格、获得我们产品候选人或任何我们将来可能开发的产品候选人的监管批准的时间、成本及其他限制,我们能否建立商业能力或与第三方达成市场、销售和分销我们的产品候选人的协议,我们在药品行业中的竞争能力,包括现有疗法、新兴潜在有竞争性的疗法和有竞争性的非专利产品的竞争能力,我们能否为我们的产品候选人进行市场营销、商业化并获得市场接受,我们能否在需要时以可接受的条件筹集资金,美国、欧盟和其他司法管辖区的监管发展,我们能否保护我们的知识产权和专有技术,并在不侵犯他人知识产权或监管专属权的情况下运营我们的业务,适用法律和法规(包括税法)变化所带来的负面影响的管理能力,一般市场、政治和经济条件的变化和不确定性(包括由通货膨胀和俄罗斯与乌克兰之间的冲突以及哈马斯对以色列的攻击及随之而来的战争引起的变化),以及在我们年度20-F表中“关于前瞻性陈述的小心声明”和“项目3.关键信息--D.风险因素”标题下描述的其他因素。新的风险和不确定性可能会不时出现,无法预测所有风险和不确定性。除非法律另有规定,否则我们无义务公开更新任何前瞻性陈述,无论是基于新信息、未来事件或其他原因。本报告包括尚未获得监管机构批准的研究用新药的数据。本报告中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及公司自有的内部估计和研究。尽管公司相信这些第三方来源在此报告发布之日可靠,但公司并未独立核实,并不对从第三方来源获取的任何信息的充分性、公正性、准确性或完整性作出任何陈述。此外,本报告中包含的所有市场数据都涉及一系列假设和限制,无法保证这些假设的准确性或可靠性。最后,尽管我们相信自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的验证。
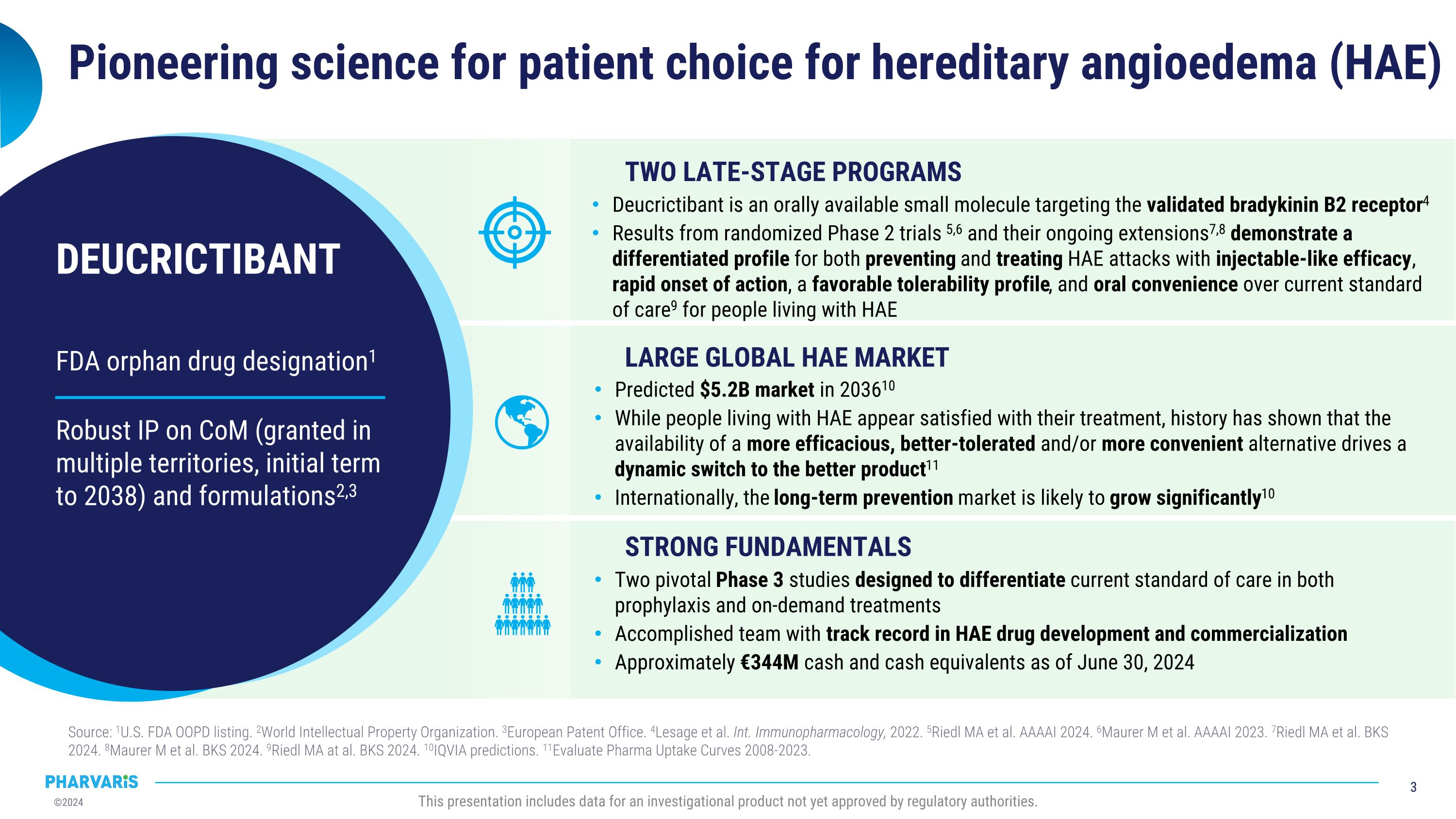
FDA特殊用途药物认可1 Com领域具有强大的知识产权(在多个地区授权,初步授权期至2038年)和配方2,3 DEUCRICTIBANt为遗传性血管性水肿(HAE)患者提供开创性的医学选择 来源:1美国 FDA OOPD 列表。 2世界知识产权组织。 3欧洲专利局。 4Lesage等。 Int. Immunopharmacology,2022年。 5Riedl MA等 AAAAI 2024年。 6Maurer m等 AAAAI 2023年。 7Riedl MA等 BKS 2024年。 8Maurer m 等 BKS 2024年。 9Riedl MA等 BKS 2024年。 10IQVIA预测。 11Evaluate Pharma Uptake Curves 2008-2023年。 这个介绍包含了尚未获得监管机构批准的一个研究产品的数据。 两个后期阶段项目大规模全球HAE市场 扎实的基本面 Deucrictibant是一种口服小分子,靶向验证的激肽B2受体4 来自随机的2期临床试验5,6及其正在进行的扩展7,8展示了其在预防和治疗HAE发作方面具有不同的特征,具有类似注射剂的疗效,快速起效,良好的耐受性以及与当前标准护理9的口服便利性 2036年预计市场规模为520亿元 HAE患者似乎满意他们的治疗,但历史证明,更有效、更耐受和/或更便利的替代产品的可用性会驱动产品的动态切换11 在国际上,长期预防市场有望显著增长10 两个关键的3期研究旨在区分当前标准的预防和按需治疗 HAE药物开发和商业化取得了卓著的成果 截至2024年6月30日,现金及现金等价物约为3,440万欧元
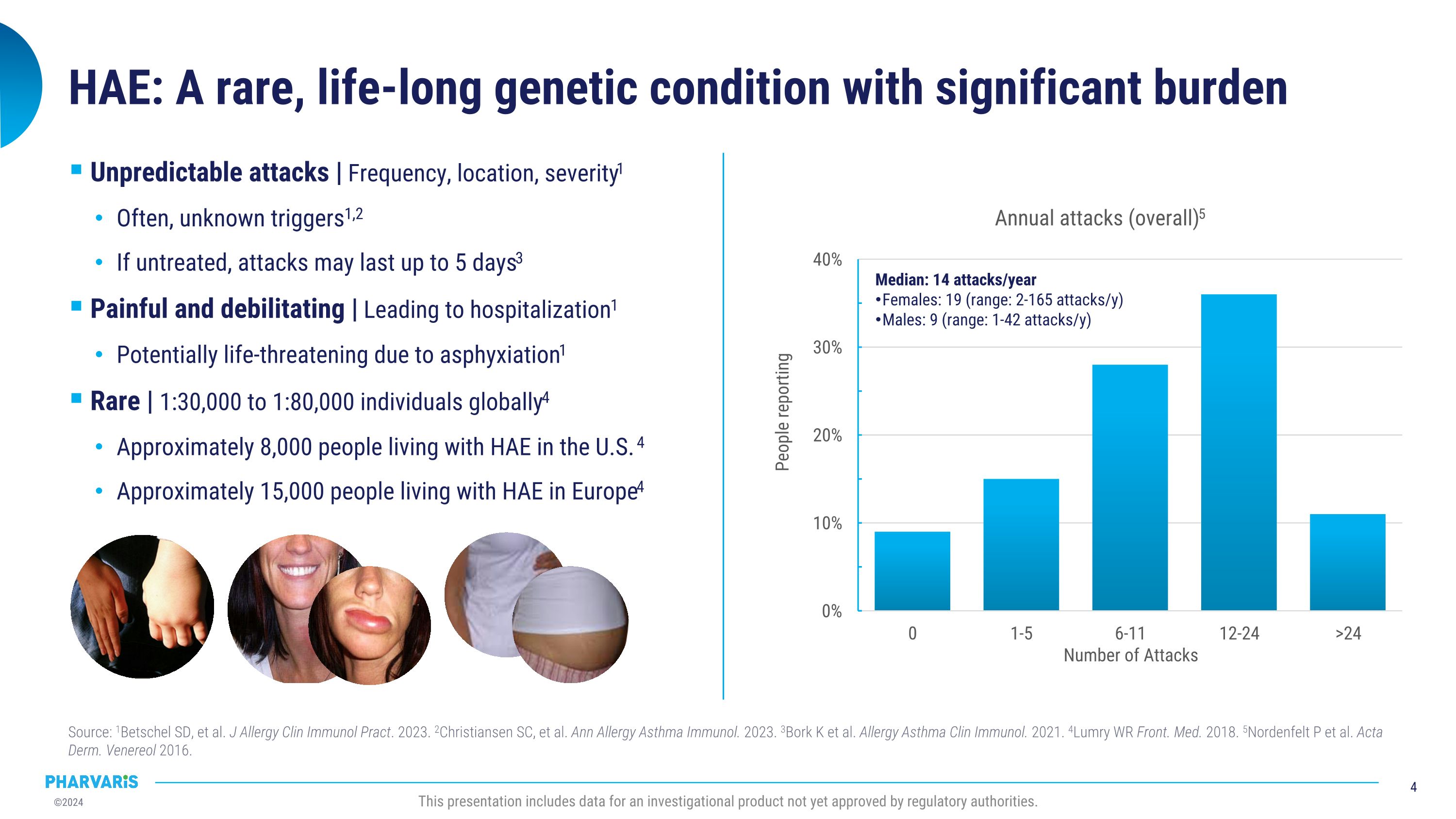
中位数:每年14次攻击 女性:19次(区间:每年2-165次攻击) 男性:9次(区间:每年1-42次攻击) HAE(遗传性补体C1抑制活性缺乏症):一种罕见的终身遗传性疾病,负担重 Source: 1Betschel SD, et al. J Allergy Clin Immunol Pract. 2023. 2Christiansen SC, et al. Ann Allergy Asthma Immunol. 2023. 3Bork k et al. Allergy Asthma Clin Immunol. 2021. 4Lumry WR Front. Med. 2018. 5Nordenfelt P et al. Acta Derm. Venereol 2016. 此演示展示了尚未获得监管机构批准的研究产品的数据。攻击的不可预测性 | 频率、地点、严重程度1 经常是未知的触发因素1,2 如果不治疗,攻击可能持续长达5天3 疼痛和致残性 | 导致住院1 可能由于窒息而危及生命1 罕见 | 每30,000到80,000人中大约有1个4 美国有大约8,000人患有HAE 4 欧洲有大约15,000人患有HAE4
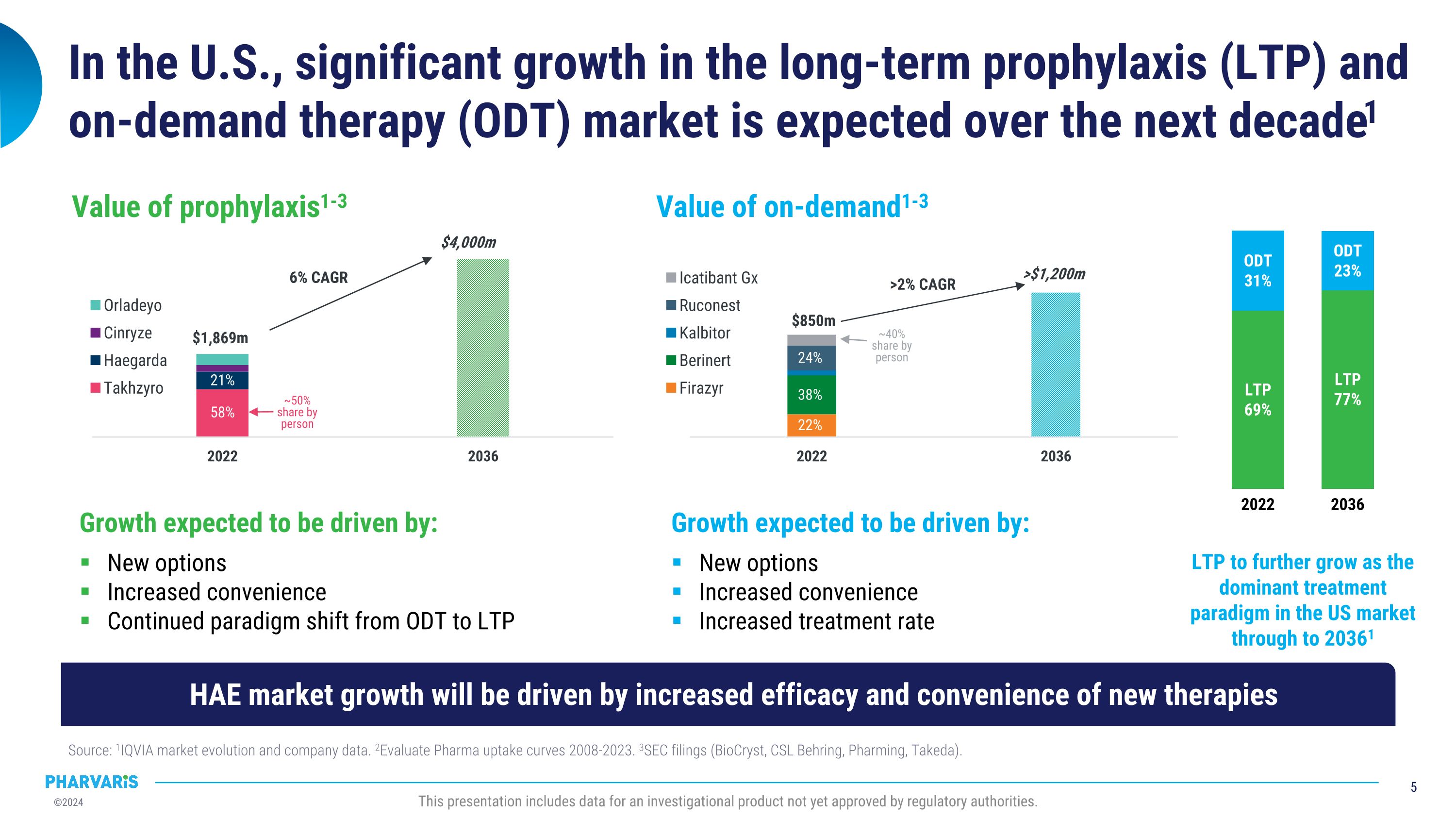
在美国,长期预防(LTP)和需求治疗(ODT)市场预计在未来十年出现显著增长1来源:1IQVIA市场发展和公司数据。2Evaluate Pharma 2008-2023年的采用曲线。3SEC文件(BioCryst,CSL Behring,Pharming,武田制药)。此演示文稿包括尚未获得监管机构批准的一种研究性产品的数据。增长的预期将由以下因素推动:新的期权,便利性增加,治疗速率增加,按需求的价值1-3为850万美元,大于1200万美元,大于2%年复合增长率22%,38%,24%,大约占人均份额的40%。增长的预期将由以下因素推动:新的期权,方便性的增加,持续的治疗方式从ODt过渡到LTP,长期预防的价值1-3 为1869亿美元,大于4000亿美元,6%年复合增长率58%,21% ,大约占人均份额的50%。到20361年,LTP预计会进一步成为美国市场的主导治疗方式2022年LTP占69%,ODt占31%,2036年LTP占77%,ODt占23%。HAE市场增长将在新疗法的疗效和便利性的增加推动下。
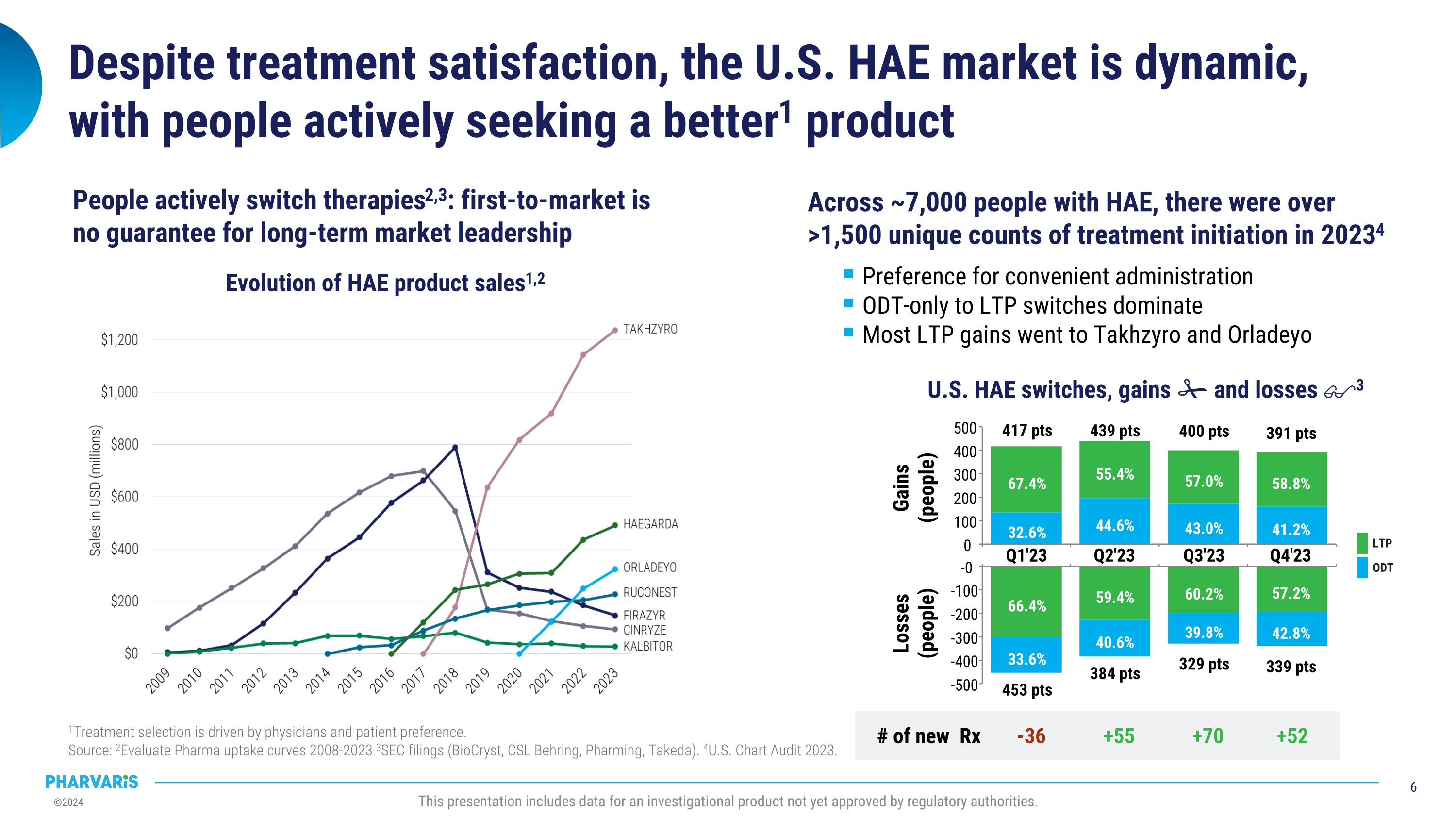
453 点 384 点 339 点 329 点 虽然治疗满意度高,但美国HAE市场变化多端,人们积极寻求更好的产品 1 治疗选择受医生和患者偏好驱动。 来源: 2 Evaluate Pharma 接受曲线 2008-2023 3 SEC备案(BioCryst,CSL Behring,Pharming,武田)4美国图表审核2023年。本展示包括尚未获得监管机构批准的研究产品数据。在约7,000名HAE患者中,2023年有1500多次独特的治疗启动次数34 偏好方便的ODt治疗转换为长期预防治疗(LTP)主导大部分LTP增长都流向了Takhzyro和Orladeyo 美国HAE 交换、增长和损失3-36 +55 +70 +52 新处方66.4% 59.4% 60.2% 57.2% 33.6% 40.6% 39.8% 42.8% Q1'23 Q2'23 Q3'23 Q4'23 -0 -100 -200 -300 -400 -500 损失 (人数)32.6% 44.6% 43.0% 41.2% 67.4% 55.4% 57.0% 58.8% 417 点 439 点 400 点 391 点 Q1'23 Q2'23 Q3'23 Q4'23 0 100 200 300 400 500 增益 (人数)ODt LTP HAE产品销售1,2的演变 人们积极转换疗法2,3:首发市场不能保证长期市场领导地位

患有HAE的人们正在追求一个不以他们的状况为定义、也不被其管理所负担的生活1。来源:1 Lumry WR等人. Allergy Asthma Proc. 2020. 2 Geba等人,J Drug Access. 2021. 3U.S. Chart Audit 2023。本演示文稿包含尚未获得监管机构批准的研究用产品的数据。患有HAE的人积极在产品之间切换3,以寻求在疗效、安全性/耐受性和便利性方面的改善。疗效是主要的驱动因素...而安全性和耐受性则促使人们探索其他选择...而便利性是整体偏好的一个关键因素2。
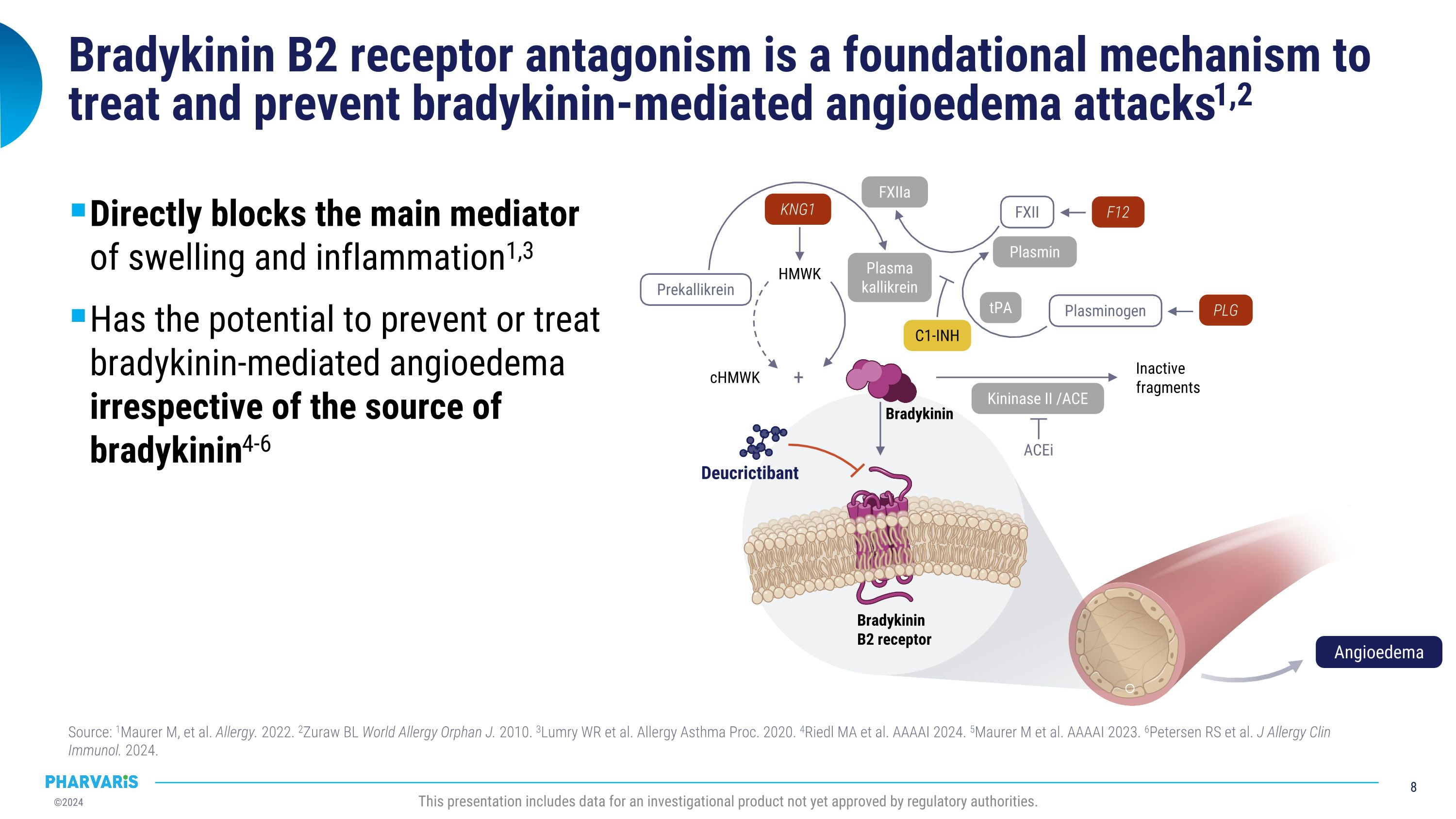
布地奎宁B2受体拮抗是治疗和预防布地奎宁介导的血管性水肿发作的基础机制1,2直接阻断肿胀和炎症的主要介质1,3有潜力预防或治疗布地奎宁介导的血管性水肿,不受布地奎宁来源的限制4-6来源:1Maurer m等。过敏。2022年。2Zuraw BL World Allergy Orphan J. 2010年。3Lumry WR等。过敏哮喘过程。2020年。4Riedl MA等。AAAAI 2024年。5Maurer m等。AAAAI 2023年。6Petersen RS等。J Allergy Clin Immunol. 2024年。本演示包括尚未获得监管机构批准的研究性产品数据。cHMWk 失活片段HMWk ACEi+前卡裂解酶FXII纤溶酶原纤溶酶原FXIIa tPA 激酶酶II / ACE 血浆卡利肽酶 KNG1 F12 PLG C1-INH 布地奎宁B2受体Deucrictibant布地奎宁血管性水肿
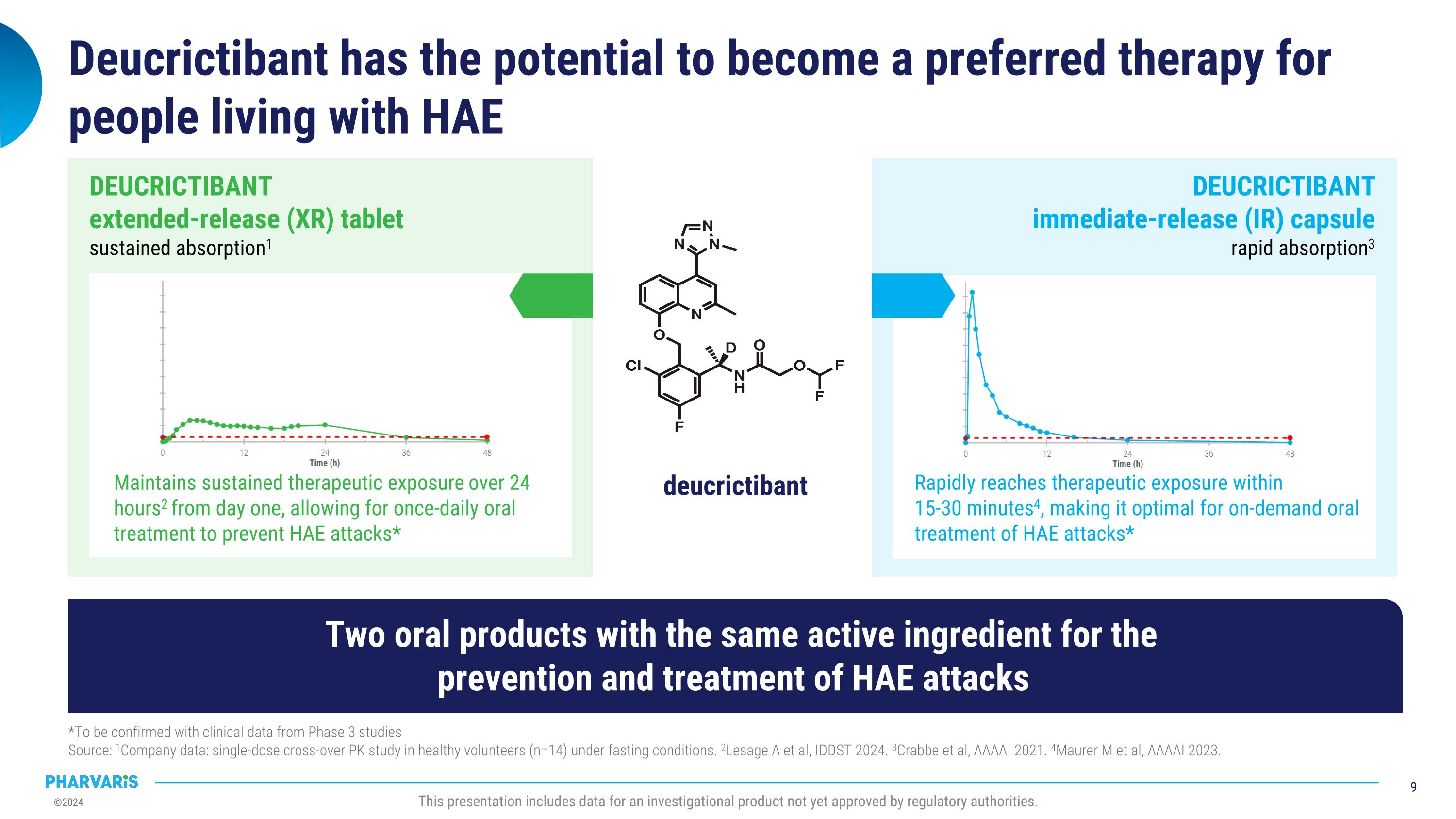
Deucrictibant有潜力成为HAE患者的首选治疗方案*待临床第三期研究数据确认 来源:1公司数据:在禁食条件下对健康志愿者(n=14)进行单剂交叉Pk研究。2Lesage A等,IDDSt 2024. 3Crabbe等,AAAAI 2021. 4Maurer m等,AAAAI 2023. 此演示文稿涉及的数据是一种尚未获得监管机构批准的调查产品的数据。4迅速达到治疗暴露于 15-30分钟4,使其成为HAE急性发作的理想口服治疗药物* Deucrictibant 即释(IR)胶囊 迅速吸收3 Deucrictibant从第一天开始提供持续治疗暴露,24小时2,允许每天一次的口服治疗 预防HAE急性发作*Deucrictibant 延长释放(XR)片剂 持续吸收1两种口服产品具有相同的活性成分,用于HAE发作的预防和治疗

Deucrictibant针对LTP和ODt源进行了差异化的描述:1公司调研。2Leasge等人IDDSt 2024。3Groen k等人ACAAI 2022。4Li H等人EAC 2024。5Maurer m等人HAEi Workshop, 2022。6Maurer m等人AAAAI 2023。7Riedl等人WSAAI 2024。8Maurer m等人BKS 2024。这个演示文稿包含一种尚未获得监管机构批准的研究产品的数据。快速吸收在15-30分钟内6,Deucrictibant IR达到治疗暴露,结果是在30分钟内停止发作进展7。较长的有效暴露较长的有效暴露会导致单剂量攻击峰值解决率很高8。单一口服药物特定的配方允许每日一次服用3(LTP使用XR)或快速单剂量解决HAE发作4(ODT使用IR)。口服ODt或LTP配方Deucrictibant是唯一一种开发中的HAE治疗方法1,可以用于预防和需求2上。快速达到稳态Deucrictibant XR有潜力在2-3天内达到稳态5,从而在LTP开始的初始天3提供对HAE发作的保护。LTP ODT
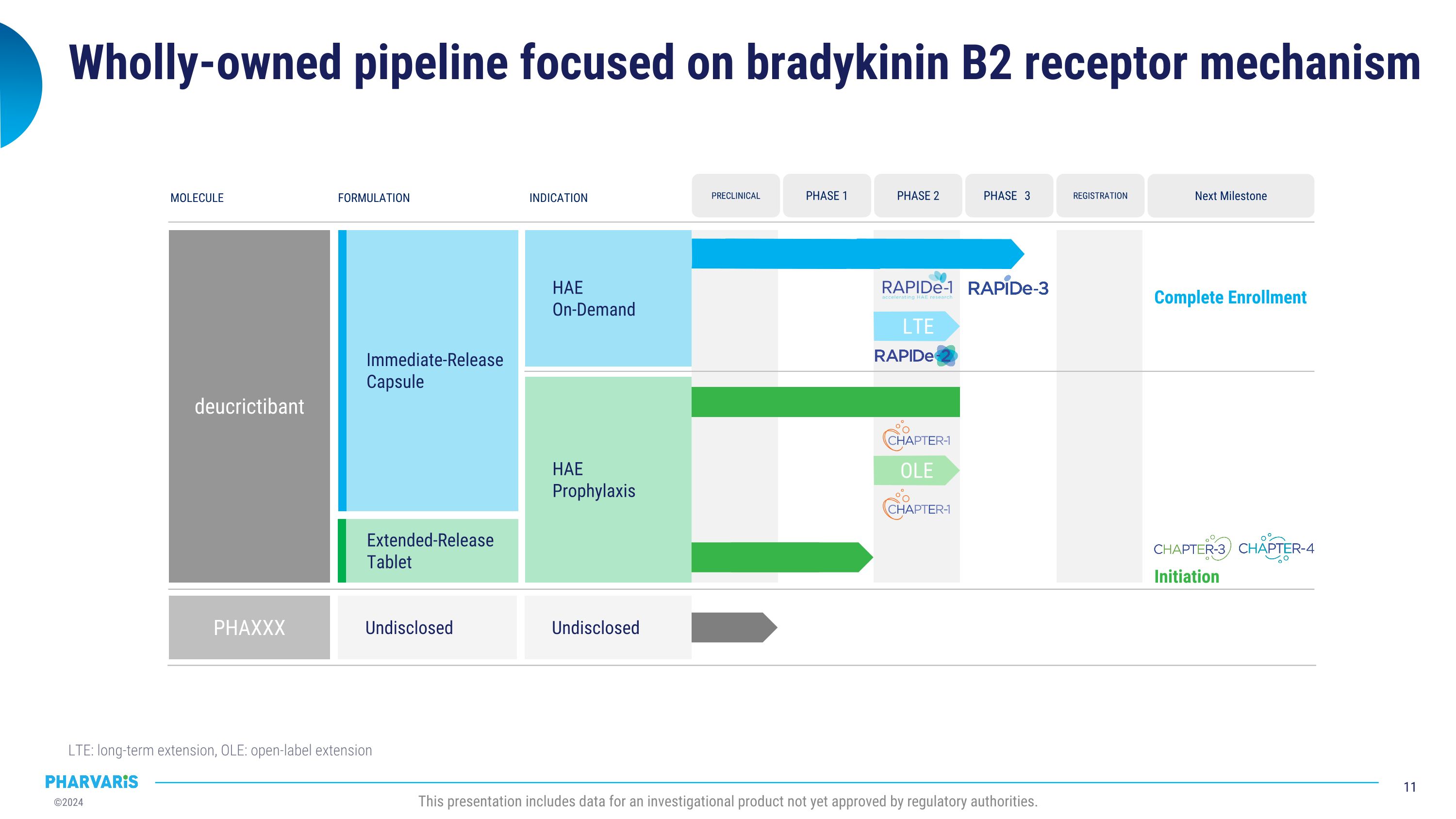
专注于布雷肽B2受体机制的全资管道 LTE:长期延伸,OLE:开放式延伸 本报告包括尚未获得监管机构批准的调查产品数据。 分子配方指标 deucrictibant 未公开 PHAXXX HAE 按需 HAE 预防性 下一个里程碑 完成招募 登记 阶段3 临床前 阶段1 阶段2 未公开 即时释放胶囊 延长释放片 OLE 启动 LTE

按需治疗(ODT)长期预防治疗(LTP)Deucrictibant LTP和ODt OLE:开放标签拓展 LTE:长期延伸 来源:1NCT05047185. 2NCT04618211. 3NCT05396105. 4NCT06343779. 22期完整 2/3期 LTE3进行中 3期关键4进行中 21期第1部分:随机对照主要分析(完成) 第2部分:开放标签拓展(进行中) 第3期关键 开始控件第3期OLE开始 推广 这个报告包含的数据是一个尚未被监管机构批准的研究用途产品。

注射效果带来的疗效和口服便利性,使得deucrictibant具有成为管理HAE OLE:开放标签扩展。LTE:长期扩展。PGI-C:患者全球改变印象。PGI-S:患者全球严重性印象的潜力。 来源:1Riedl MA等。 BKS 2024年。 2Valerieva A等。 EAACI 2024年。 3Magerl m等。 BKS 2024年。 4Riedl MA等。 AAAAI 2024年。 5Maurer m等。 BKS 2024年。 6Maurer m等。 AAAAI 2023年。该演示文稿包括尚未获得监管当局批准的调查产品的数据。长期预防治疗(LTP)潜在首选LTP安全性和耐受性生活质量公式疗效持续一年以上在进行中的OLE研究中1改善疾病控制和健康相关的生活质量与第22,3期降低攻击的相应增加3进行中的OLE研究中证实第2期安全性和耐受性概况1,4一日一次的商业配方准备进入第3期 按需治疗(ODT)潜在首选ODt安全性和耐受性与中位数医院感染后症状缓解“好转”约1.1小时PGI-S症状消除无“无”约11.5小时 在进行中的LTE研究中5攻击的85.8%在24小时内完全消除了进行中的LTE研究,其中90.2%的单剂量5证实进行中的LTE研究中第2期安全性和耐受性概况5,6
长期预防用Deucrictibant延释片

按需治疗(ODT)长期预防(LTP)Deucrictibant的LTP临床发展OLE:开放标签延续。LTE:长期延期。 来源:1NCT05047185。2NCT04618211。3NCT05396105。4NCT06343779。第22阶段完全第2/3 LTE3进行中第3个关键性4进行中第21阶段1部分:随机对照主要分析(完成)第2部分:开放标签延伸(进行中)第3阶段关键性开启第3阶段OLE开启该演示包括尚未获得监管机构批准的调查产品数据。

CHAPTER-1阶段2预防试验的积极头条数据于2023年12月宣布:中度和严重发作的发生率降低了92.3%* 按需用药治疗的发作发生率降低了92.6%* 在主要、次要和与健康相关的生活质量终点指标上具有临床意义的结果 两个剂量下的Deucrictibant耐受性良好 *40mg/天的Deucrictibant治疗组;每月发作率减少率基于泊松回归模型。此处报告的所有发作均经考证;发作率是每月发生的发作次数,也称为时间归一化的发作次数;所有比较Deucrictibant和安慰剂的统计分析都未调整多重性。 来源:1Aygören-Pürsün E等。EAACI 2024。满足主要终点:与安慰剂相比,每月发作率减少84.5%(p=0.0008)* 本介绍包含一个尚未获得监管机构批准的调查性产品的数据。
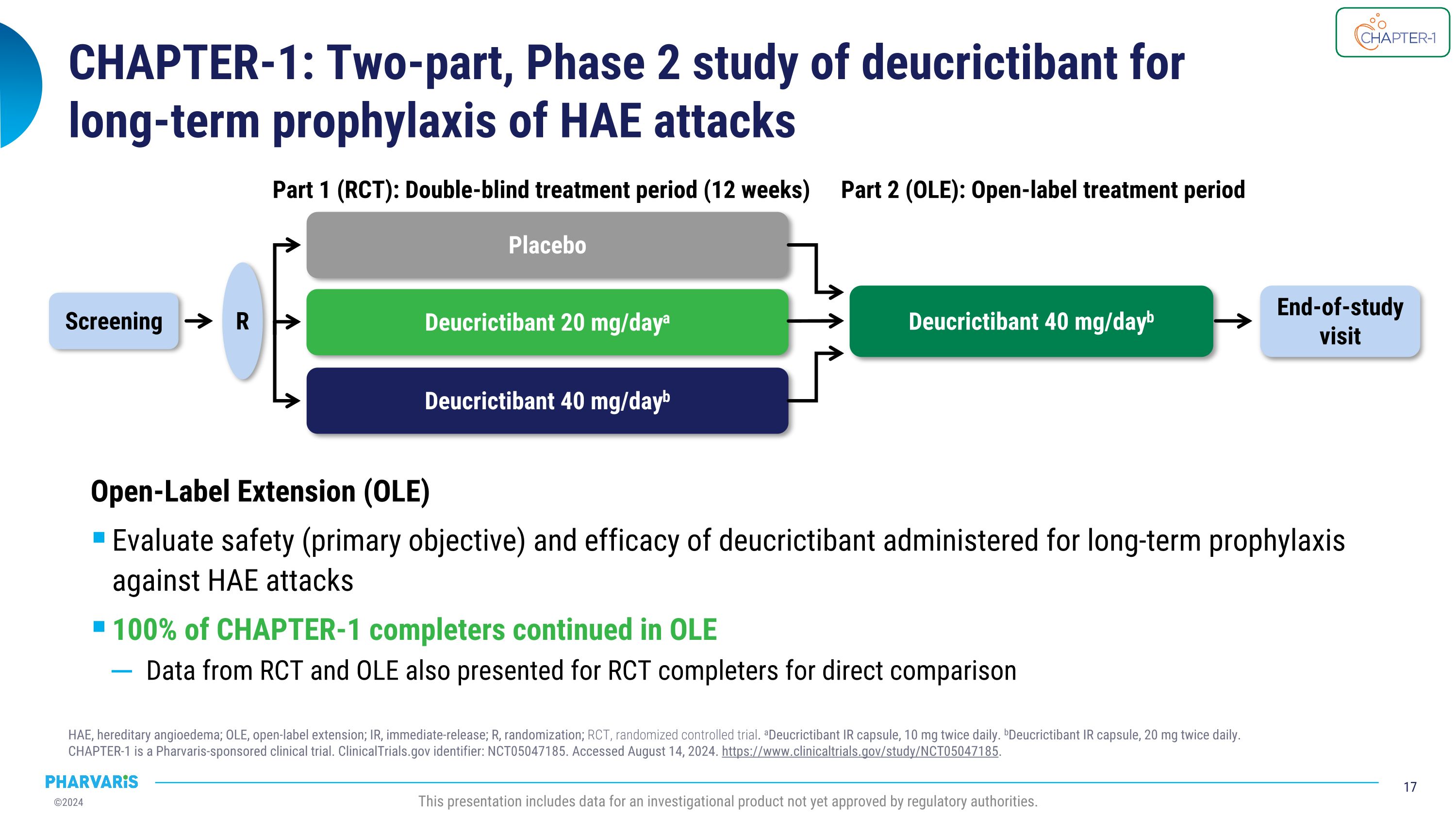
第1章:Deucrictibant的两阶段第2阶段的研究,用于长期预防HAE发作HAE,遗传性血管性水肿;OLE,无标签延期;IR,即时释放;R,随机化;RCt,随机对照试验。a Deucrictibant IR胶囊10毫克每日两次。b Deucrictibant IR胶囊20毫克每日两次。 第1章是由Pharvaris赞助的临床试验。\nClinicalTrials.gov标识符:NCT05047185。于2024年8月14日访问。https://www.clinicaltrials.gov/study/NCT05047185。本展示包括迄今尚未获得监管机构批准的调查产品的数据。安慰剂Deucrictibant 20毫克/天a Deucrictibant 40毫克/天b 第1部分(RCT):双盲治疗期(12周)筛选R 结束研究访问 Deucrictibant 40毫克/天b 第2部分(OLE):开放治疗期开放标签延期(OLE)评估Deucrictibant长期预防HAE发作的安全性(主要目标)和疗效100%的CHAPTER-1完成者继续进行OLE还针对RCt完成者进行直接比较提供RCt和OLE的数据
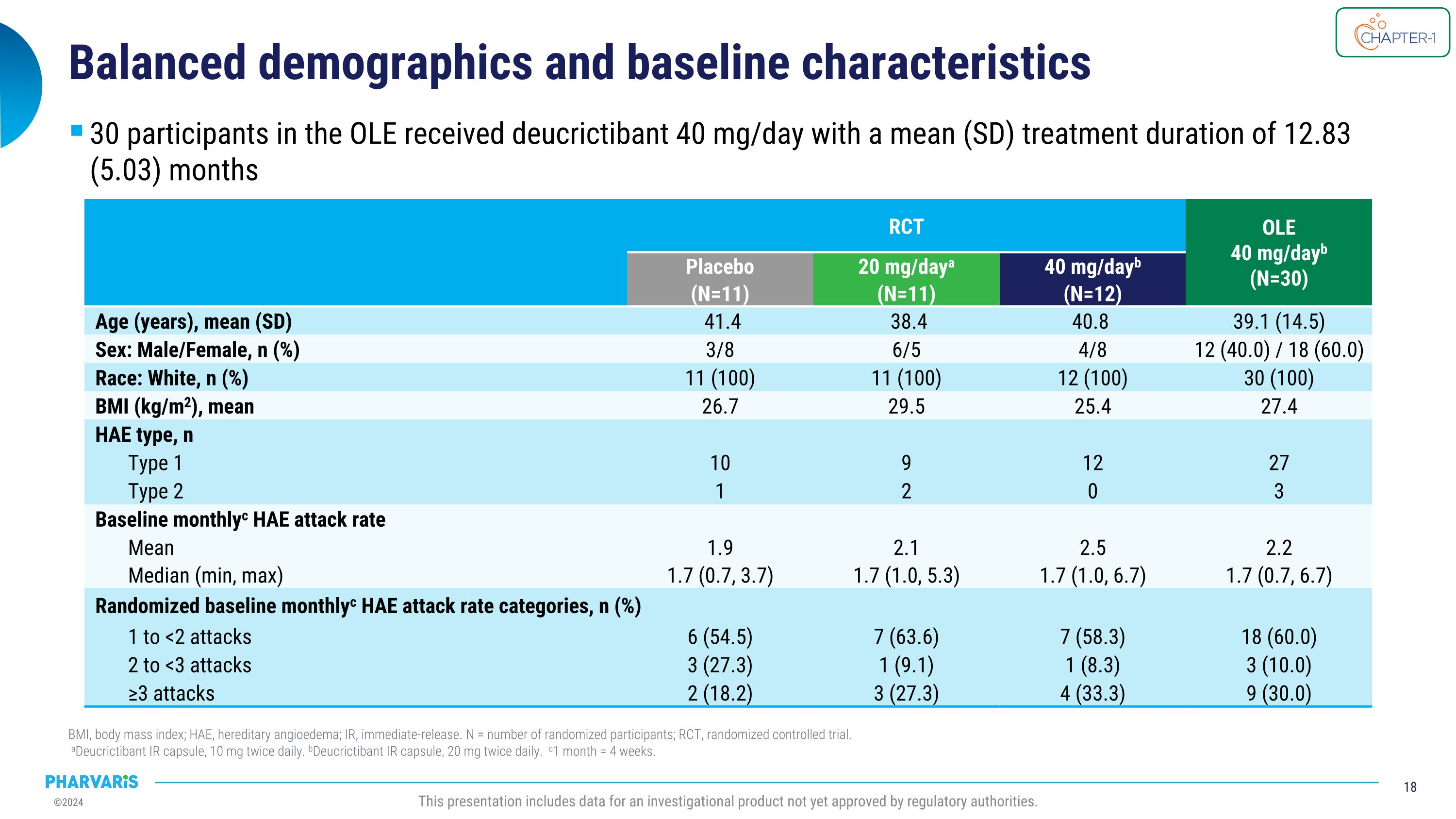
人口统计学和基线特征BMI,即体重指数;HAE,遗传性血管性水肿;IR,即时释放。N = 受试者随机分配的人数;RCt,随机对照试验。 a狄克力替班即时释放胶囊,每日10毫克2次。 b狄克力替班即时释放胶囊,每日20毫克2次。 c1个月 = 4周。本报告包括尚未获得监管机构批准的一种调查产品的数据。RCt OLE 40mg/天b (N=30) 安慰剂(N=11) 每天20mg/a(N=11) 每天40mg/b(N=12) 年龄(岁),平均(标准差) 41.4 38.4 40.8 39.1 (14.5) 性别:男/女,n(%) 3/8 6/5 4/8 12(40.0) / 18(60.0) 种族:白人,n(%) 11(100) 11(100) 12(100) 30(100) BMI(kg/m2),均值 26.7 29.5 25.4 27.4 HAE类型,n 类型1 10 9 12 27 类型2 1 2 0 3 基线每月c HAE发作率 平均值 1.9 2.1 2.5 2.2 中位数(最小,最大) 1.7(0.7,3.7) 1.7(1.0,5.3) 1.7(1.0,6.7) 1.7(0.7,6.7) 随机分配的基线每月c HAE发作率类别,n(%) 1至<2次发作 6(54.5) 7(63.6) 7(58.3) 18(60.0) 2至<3次发作 3(27.3) 1(9.1) 1(8.3) 3(10.0) ≥3次发作 2(18.2) 3(27.3) 4(33.3) 9(30.0) OLE中的30名参与者每天接受40mg狄克力替班,治疗持续平均(标准差)12.83(5.03)个月
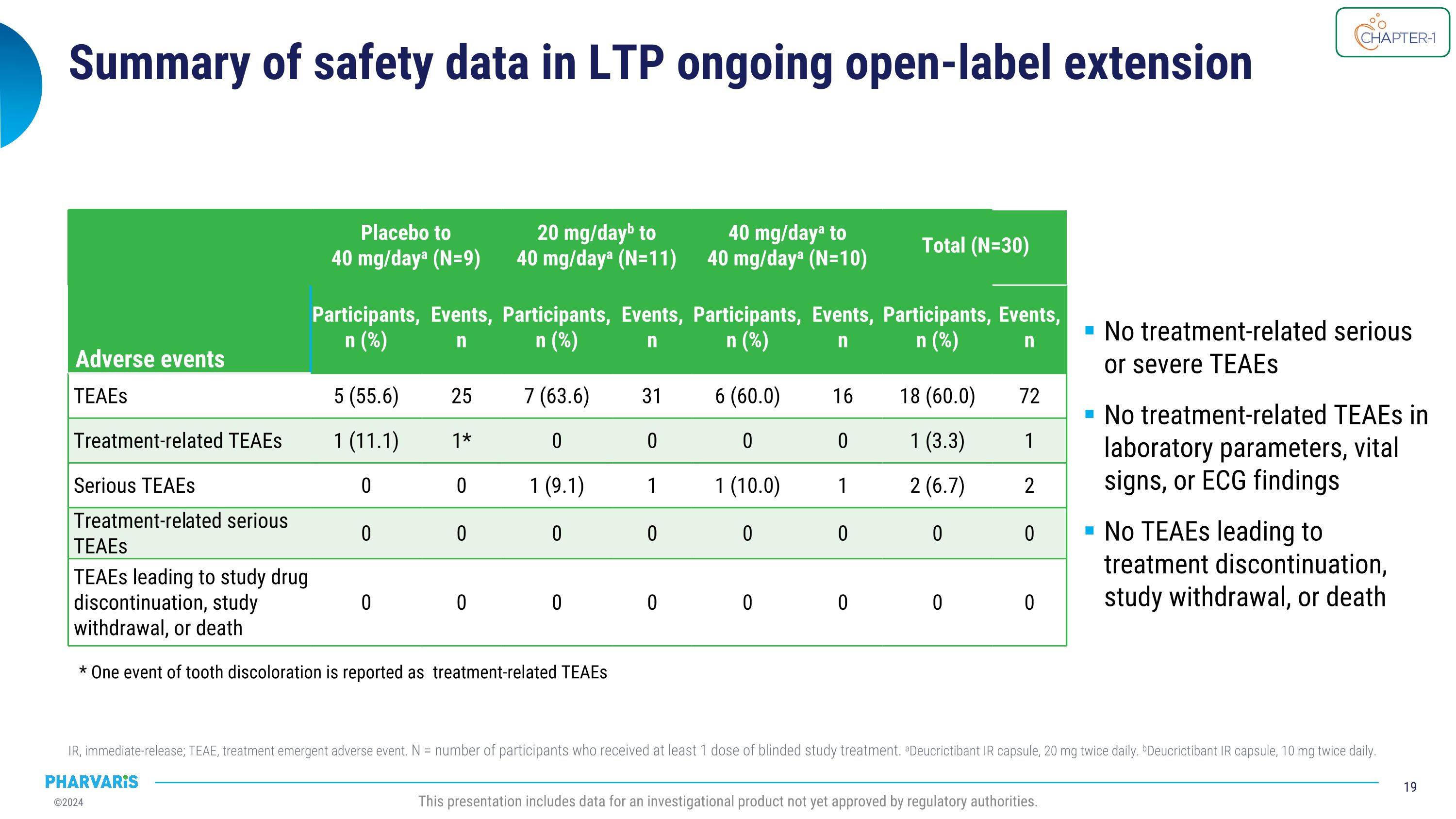
LTP持续开放标签扩展IR的安全性数据总结,IR代表即释放,TEAE代表治疗相关的不良事件。N为至少接受了一剂盲目研究治疗的参与者数量。aDeucrictibant IR胶囊,每天20毫克,两次。bDeucrictibant IR胶囊,每天10毫克,两次。本报告包含尚未获得监管机构批准的研究产品的数据。不良事件 安慰剂至40毫克/天a(N=9)20毫克/天b至40毫克/天a(N=11)40毫克/天a至40毫克/天a(N=10)总计(N=30) 事件 参与者,n(%) 事件,n 参与者,n(%) 事件,n 参与者,n(%) 事件,n 参与者,n(%) 事件,n TEAE 5(55.6) 25 7(63.6) 31 6(60.0) 16 18(60.0) 72 与治疗相关的TEAE 1(11.1) 1* 0 0 0 0 1(3.3) 1 严重TEAE 0 0 1(9.1) 1 1(10.0) 1 2(6.7) 2 与治疗相关的严重TEAE 0 0 0 0 0 0 0 0 TEAE导致研究药物停止使用,退出研究或死亡 0 0 0 0 0 0 0 0 无与治疗相关的严重或严重TEAE 实验室指标,生命体征或心电图结果中无与治疗相关的TEAE TEAE未导致治疗停止,退出研究或死亡 * 有一例牙齿变色的事件报告为与治疗相关的TEAE
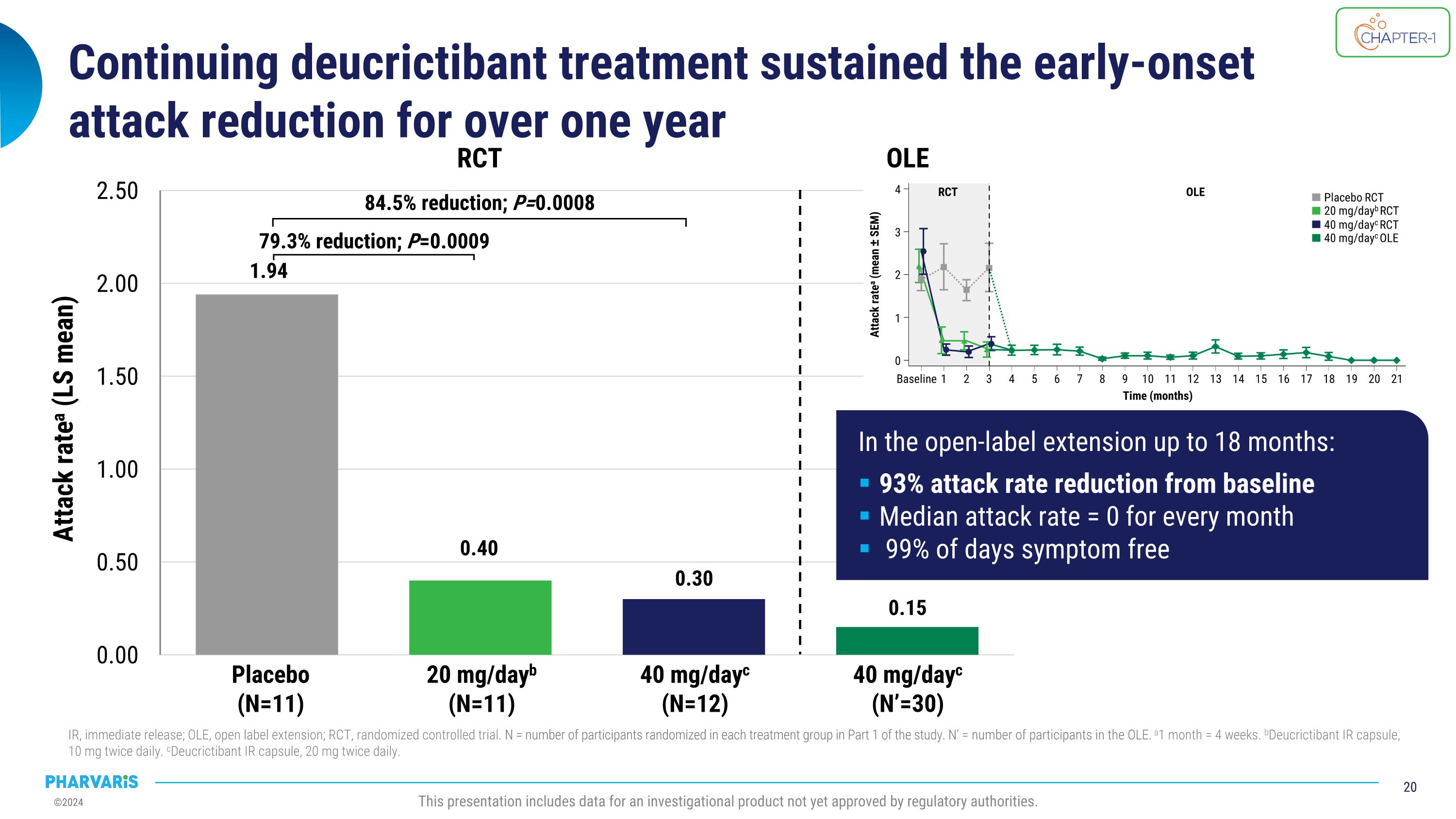
持续使用deucrictibant治疗能够延续早期发作的减少,持续超过一年IR,即刻释放;OLE,开放标签延展;RCT,随机对照试验。N = 在研究的第一部分中每个治疗组中随机分配的参与者数量。N' = OLE中参与者的数量。a1个月 = 4周。bDeucrictibant IR胶囊,10毫克,每天两次。cDeucrictibant IR胶囊,20毫克,每天两次。本次演示包括尚未获得监管机关批准的研究产品的数据。安慰剂(N=11)20毫克/天b(N=11)40毫克/天c(N=12)RCT 40毫克/天c(N'=30)OLE 降低了79.3%;P=0.0009 降低了84.5%;P=0.0008 发作率a(LS均值)在延展期达到18个月时:相对于基线,发作率降低了93% 平均每个月的发作率 = 0 99%的天数没有症状
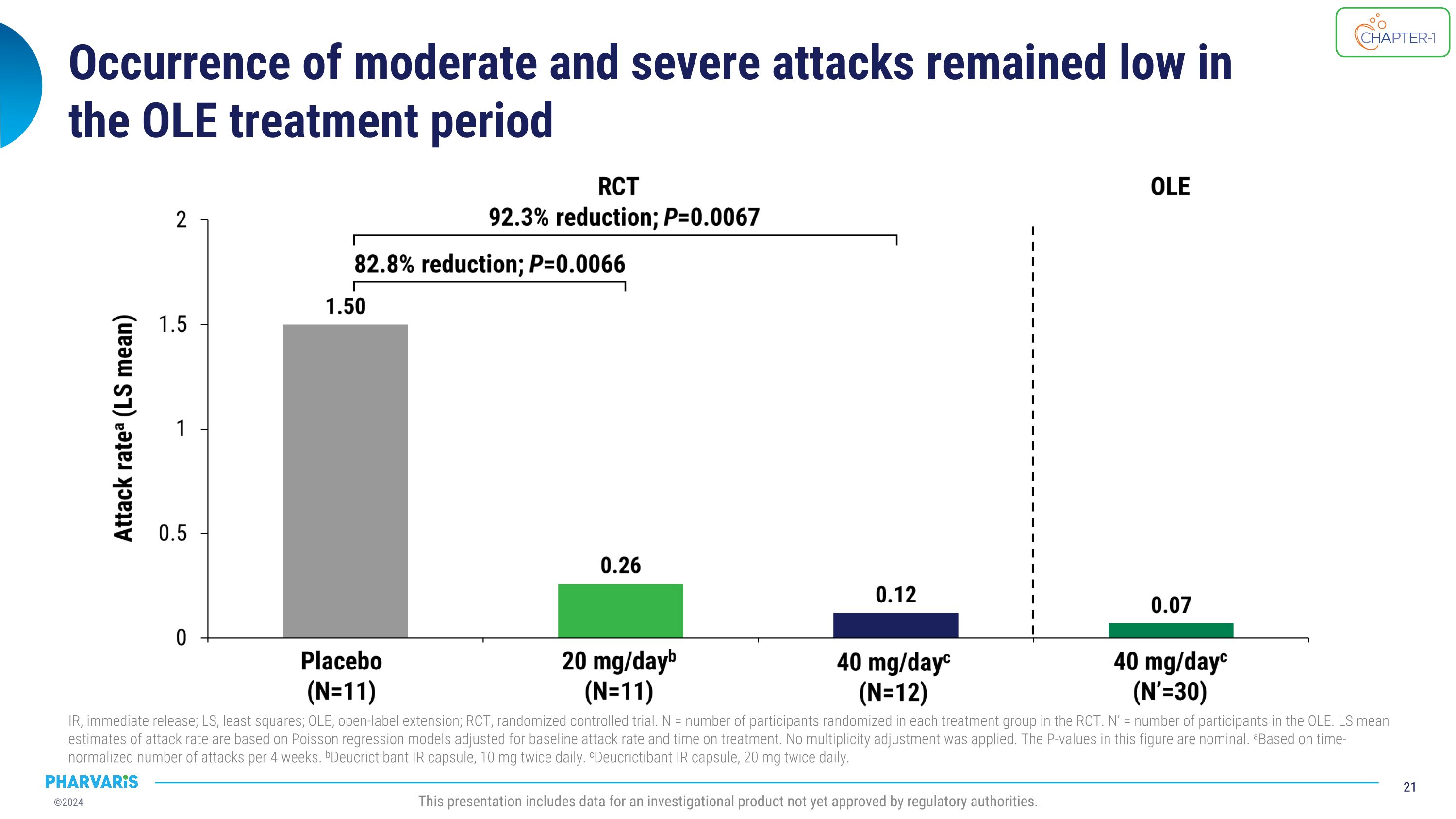
在OLE治疗期间,中等和严重发作的发生率保持较低水平。 IR,立即释放; LS,最小二乘法; OLE,开放标签延长; RCt,随机对照试验。 N = 在RCt中每个治疗组中随机分配的参与者数量。 N' = OLE中的参与者数量。 根据基线发作率和治疗时间进行调整的Poisson回归模型的LS均值估计。 没有应用多重性调整。 本图中的P值是名义的。 根据每4周的时标准化发作次数。 b10毫克两次每日口服的Deucrictibant IR胶囊。 c20毫克两次每日口服的Deucrictibant IR胶囊。 此展示包括尚未获得监管机构批准的调查产品的数据。
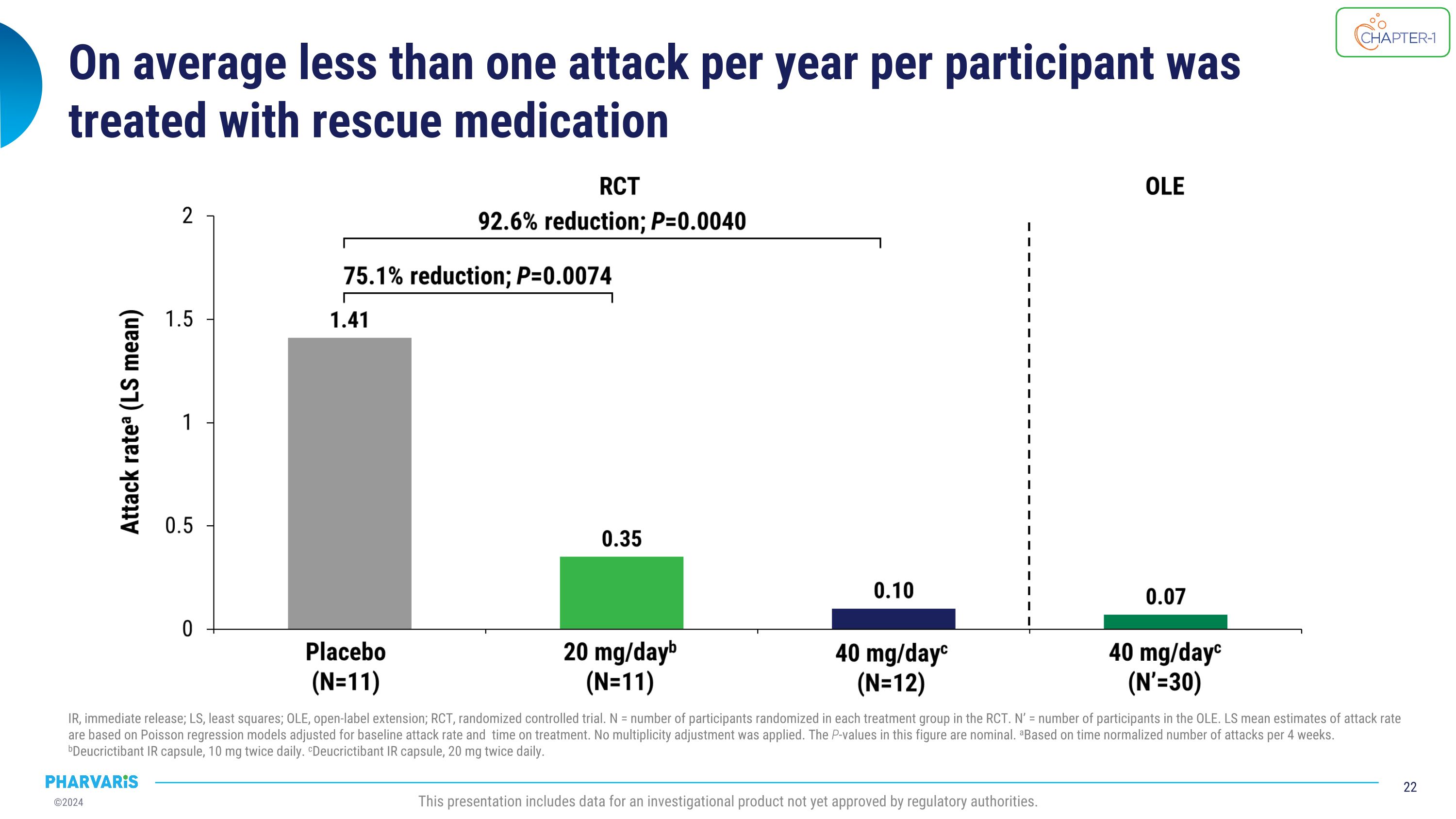
每位参与者每年平均不到一次的发作使用紧急救助药物IR治疗,即刻释放;LS,最小二乘法;OLE,开放式延伸;RCt,随机对照试验。 N = 在RCt中每个治疗组中随机分配的参与者人数。 N' = 开放式延伸中的参与者人数。根据泊松回归模型调整基线发作率和治疗时间计算的LS平均发作率估计。未应用多重性调整。本图中的P值为名义上的。a基于每4周标准化攻击次数。b迪克西特巴特IR胶囊,每天10毫克,每天两次。c迪克西特巴特IR胶囊,每天20毫克,每天两次。此展示包含尚未获得监管机构批准的研究产品数据。
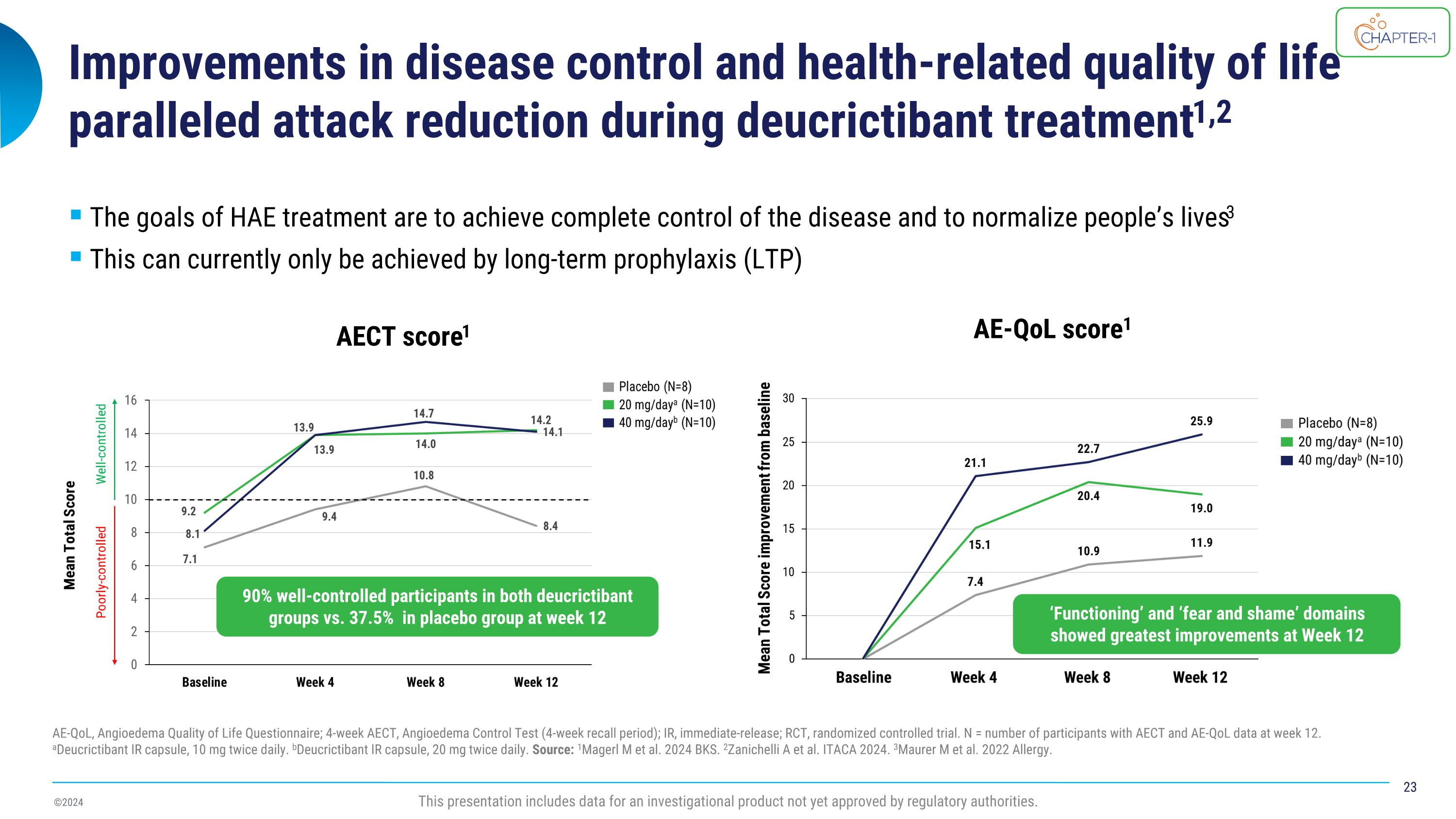
在deucrictibant治疗期间,疾病控制和与健康相关的生活质量的改善与攻击次数的减少相平行1,2 AE-QoL、血管性水肿生活质量问卷;4周AECt、血管性水肿控制测试(4周回顾期);IR,即时释放;RCt,随机对照试验。N = 12周时具有AECt和AE-QoL数据的参与者数。aDeucrictibant IR胶囊,每天10毫克2次。bDeucrictibant IR胶囊,每天20毫克2次。来源:1Magerl等。2024 BKS。2Zanichelli A等。ITACA 2024。3Maurer等。2022年过敏。HAE治疗的目标是实现疾病的完全控制,并使人们的生活恢复正常3目前只能通过长期预防(LTP)来实现AE Ct得分1 AE-QoL得分1此演示包括尚未获得监管机构批准的一种调查产品的数据。第12周,双方deucrictibant组的受控率达到90%,安慰剂组为37.5%“功能”和“恐惧与羞耻”领域在第12周显示出最大的改善
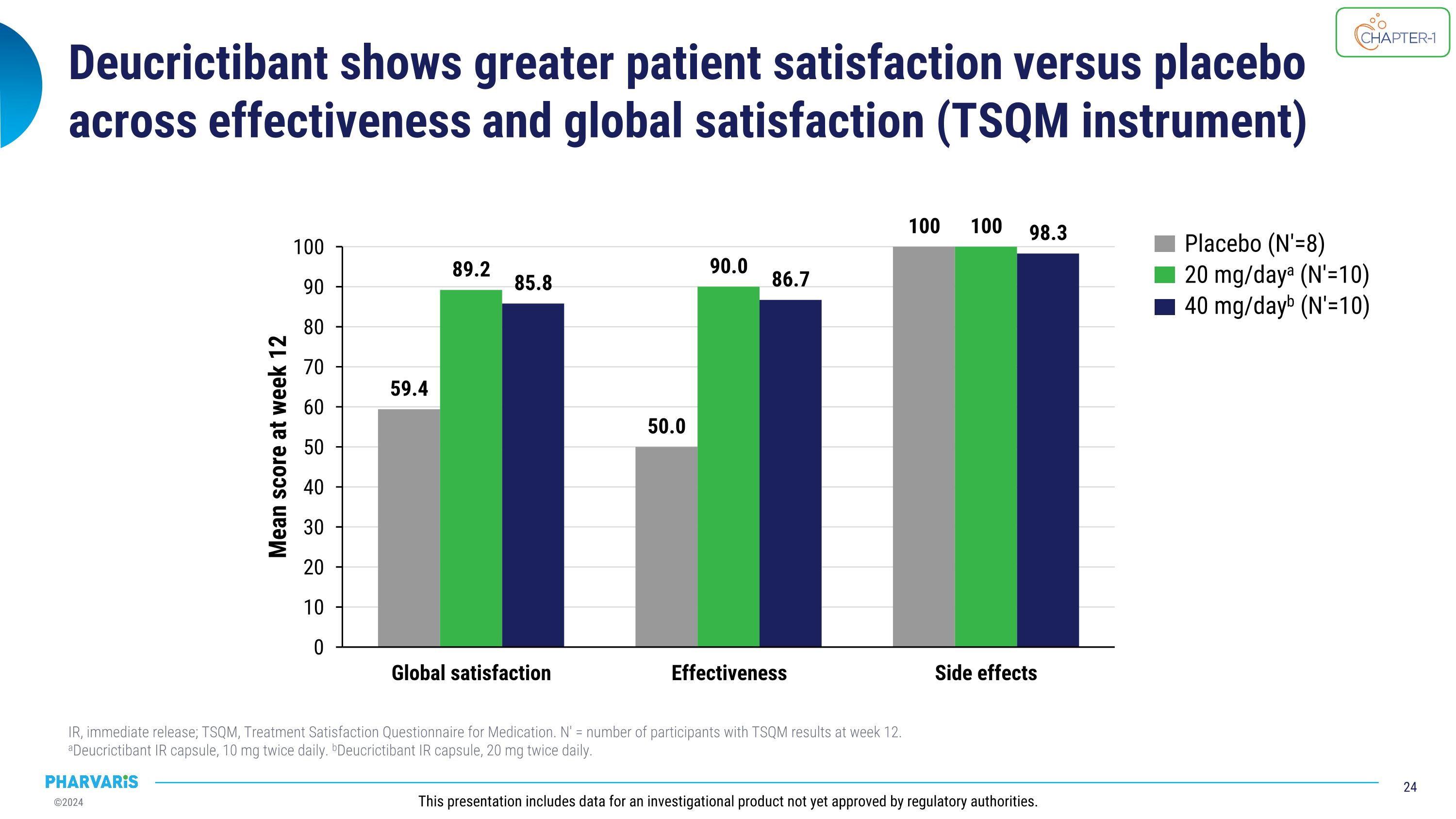
Deucrictibant在效果和全球满意度(TSQm工具)方面显示出比安慰剂更高的患者满意度。即刻释放(IR); TSQm,药物治疗满意度问卷。N′ = 12周时具有TSQm结果的参与者人数。 aDeucrictibant IR胶囊,每日两次10毫克。bDeucrictibant IR胶囊,每日两次20毫克。此演示包括尚未获得监管机构批准的研究性产品数据。安慰剂(N′=8)每日20毫克a (N′=10)每日40毫克b(N′=10)
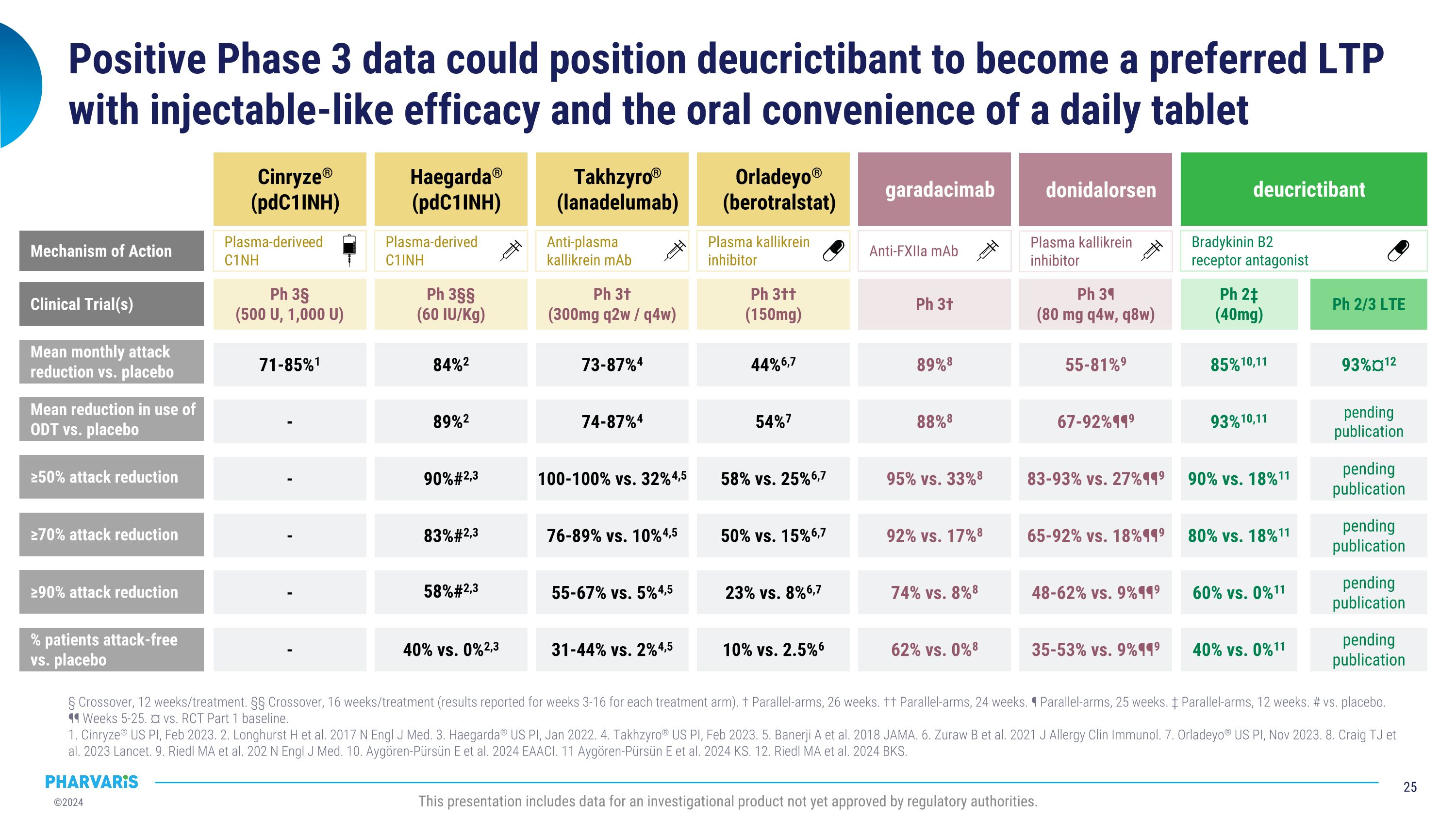
Phase 3积极的数据可能使Deucrictibant成为首选的注射效力和每天一片便捷的口服药片LTP。 12周/治疗的交叉 16周/治疗的交叉(对于每个治疗组的3-16周的结果报道)。 对照研究 26周。 对照研究 24周。 对照研究 25周。 对照研究 12周。 与安慰剂相比。 ¶¶ 第5-25周。 对照RCt第一阶段基线的比较。 1.Cinryze®美国药品说明书,2023年2月。 2.Longhurst H等人。2017 N Engl J Med。 3.Haegarda®美国药品说明书,2022年1月。 4.Takhzyro®美国药品说明书,2023年2月。 5.Banerji A等人。2018年JAMA。 6.Zuraw b等人。2021年J Allergy Clin Immunol。 7.Orladeyo®美国药品说明书,2023年11月。 8.Craig TJ等人。2023年《柳叶刀》。 9.Riedl MA等人。202 N Engl J Med。 10.Aygören-Pürsün E等人。2024年EAACI。 11.Aygören-Pürsün E等人。2024年KS。 12.Riedl MA等人。2024年BKS。 此报告包括未经监管机构批准的研究性产品数据。 与安慰剂相比,每月平均发作减少≥50%发作减少≥70% Cinryze® (pdC1INH) Haegarda® (pdC1INH) Takhzyro® (lanadelumab) Orladeyo®(berotralstat) garadacimab 89%8 95% vs. 33%8 92% vs. 17%8 74% vs. 8%8 62% vs. 0%8 71-85%1 - - - - 84%2 90%#2,3 83%#2,3 58%#2,3 40% vs. 0%2,3 73-87%4 100-100% vs. 32%4,5 76-89% vs. 10%4,5 55-67% vs. 5%4,5 31-44% vs. 2%4,5 44%6,7 58% vs. 25%6,7 50% vs. 15%6,7 23% vs. 8%6,7 10% vs. 2.5%6 ≥90%发作减少百分比与安慰剂相比抗FXIIa mAb 血浆激酶抑制剂抗血浆激酶抗体 血浆源性C1INH 血浆源性C1NH 作用机制 donidalorsen 55-81%9 83-93% vs. 27%¶¶9 65-92% vs. 18%¶¶9 48-62% vs. 9%¶¶9 35-53% vs. 9%¶¶9 血浆激酶抑制剂 deucrictibant 第3阶段† 第3阶段††(150mg) 第3阶段† (300mg q2w / q4w) 第3阶段§§ (60 IU/Kg) 第3阶段§ (500 U, 1,000 U) 临床试验* 第3阶段¶ (80 mg q4w, q8w) 第2阶段‡ (40mg) 第2/3阶段LTE 内啡肽B2受体拮抗剂85%10,11 90% vs. 18%11 80% vs. 18%11 60% vs. 0%11 40% vs. 0%11 93%¤12 未发布 未发布 未发布 未发布 对安慰剂使用ODt的平均减少率88%8 - 89%2 74-87%4 54%7 67-92%¶¶9 93%10,11 未发布

第三章和第四章的临床研究
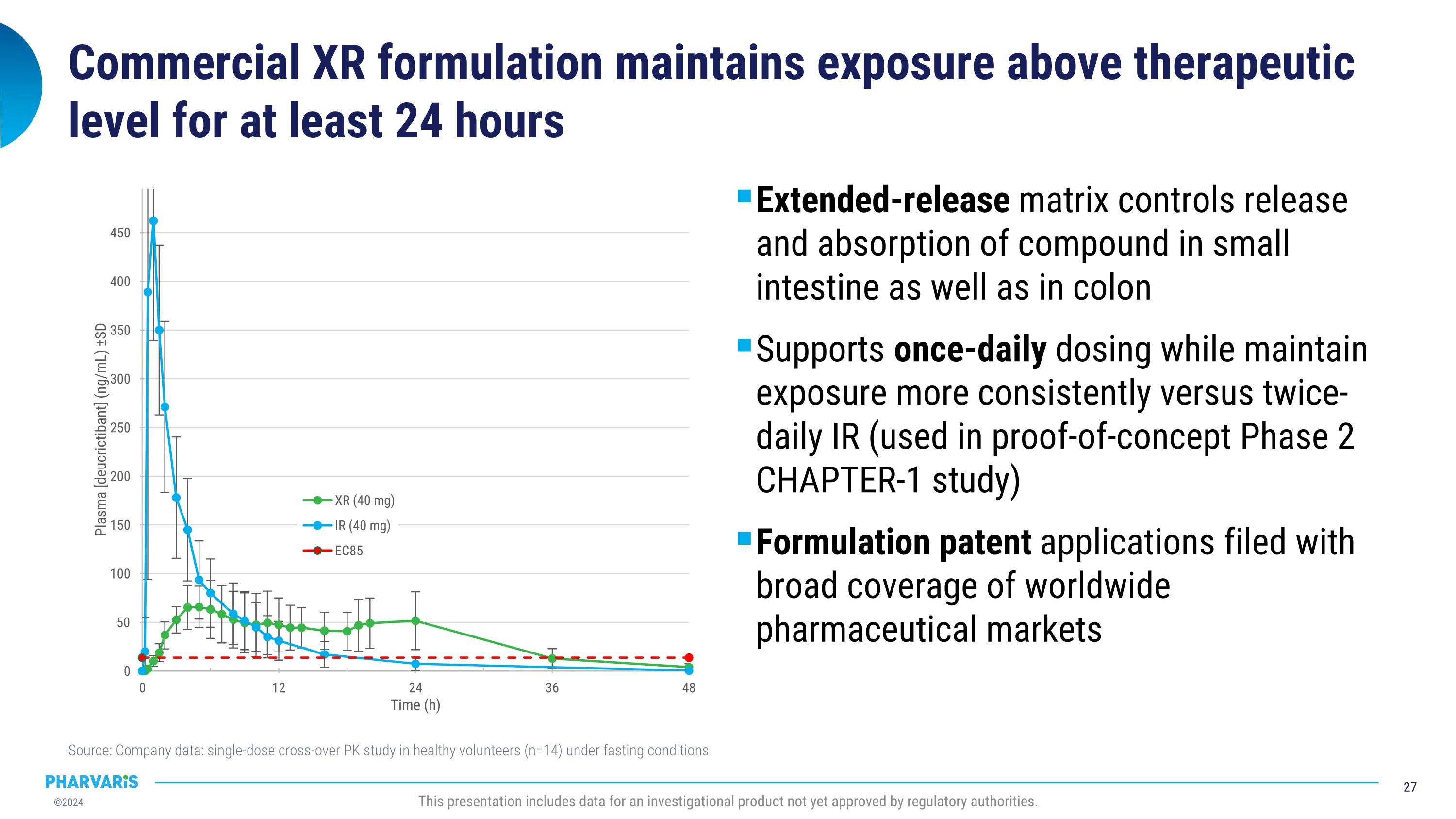
商业性XR剂型可保持治疗水平至少24小时 延长释放基质控制化合物在小肠和结肠内的释放和吸收 与两次IR(用于概念验证第2章第1研究)相比,支持每日一次的给药方式,同时更一致地维持暴露水平 药品专利申请涵盖了全球药品市场 来源:公司数据:健康志愿者(n=14)在空腹条件下的单剂交叉Pk研究 本报告包含尚未获得监管机构批准的调查产品的数据。

第三章研究:一项全球性的3期研究,旨在对HAE患者进行预防性治疗。目标招募约81名青少年和成年人,患有HAE的病人。计划于2024年底启动。研究目标:评估和描述研究者确认的HAE发作,在24周的治疗期间的发生情况;治疗相关不良事件的发生率;评估deucrictibant XR的药代动力学;评估参与者报告的生活质量的变化;进入开放标签延伸研究。此演示包含了尚未获得监管机构批准的一种调查产品的数据。
按需服用 Deucrictibant 速释胶囊

按需治疗(ODT)长期预防(LTP)Deucrictibant的临床开发用于ODt OLE:开放标签延长。LTE:长期延长。 来源:1NCT05047185。2NCT04618211。3NCT05396105。4NCT06343779。第22期完成第2/3期LTE3正在进行第3期关键4正在进行第21期部分1:随机对照主要分析(已完成) 部分2:开放标签延长(进行中) 第3期关键创业公司第3期OLE创业公司该展示包括尚未获得监管机构批准的一种调查性产品的数据。

症状演变至缓解和消退。症状进展临床试验终点跨越整个发作时间过程。AMRA,血管性水肿症状评分量表;EoP,进展结束;HAE,遗传性血管性水肿;IR,即时释放;PGI-C,患者整体变化自评量表;PGI-S,患者整体严重程度自评量表;1. ClinicalTrials.gov.口服PHA-022121用于治疗遗传性血管性水肿急性发作的剂量范围研究(RAPIDe-1)。网址:https://clinicaltrials.gov/study/NCT04618211。2024年8月访问;2. Maurer等人. AAAAI 2022,海报。3. Riedl等人. ACAAI 2023,海报。4. ClinicalTrials.gov.口服PHA-022121治疗遗传性血管性水肿急性发作的延展研究(RAPIDe-2)。网址:https://clinicaltrials.gov/study/NCT05396105。2024年8月访问;5. ClinicalTrials.gov.口服Deucrictibant软胶囊治疗青少年和成人遗传性血管性水肿急性发作的研究(RAPIDe-3)。网址:https://clinicaltrials.gov/study/NCT06343779。2024年8月访问。6. Maurer等人. EAACI 2024,海报。该报告包括尚未获得监管当局批准的调查产品数据。时间(比例不一致)临床表现Deucrictibant IR治疗进展结束症状缓解开始完全症状消退RAPIDe-11,2,3RAPIDe-35,6AMRA所有3项≤10PGI-S“没有”;AMRA所有3项≤10PGI-C“稍微好转”;AMRA-3≥30%减少主要终点PGI-C“稍微好转”症状显著缓解AMRA-3≥50%减少RAPIDe-24PGI-S“没有”;AMRA所有3项≤10PGI-C“稍微好转”AMRA≥30%减少;PGI-C“更好”;PGI-S减少≥1分;AMRA≥50%减少PGI-C“更好”;PGI-S减少≥1分;AMRA≥50%减少AMRA达到EoP的时间事后
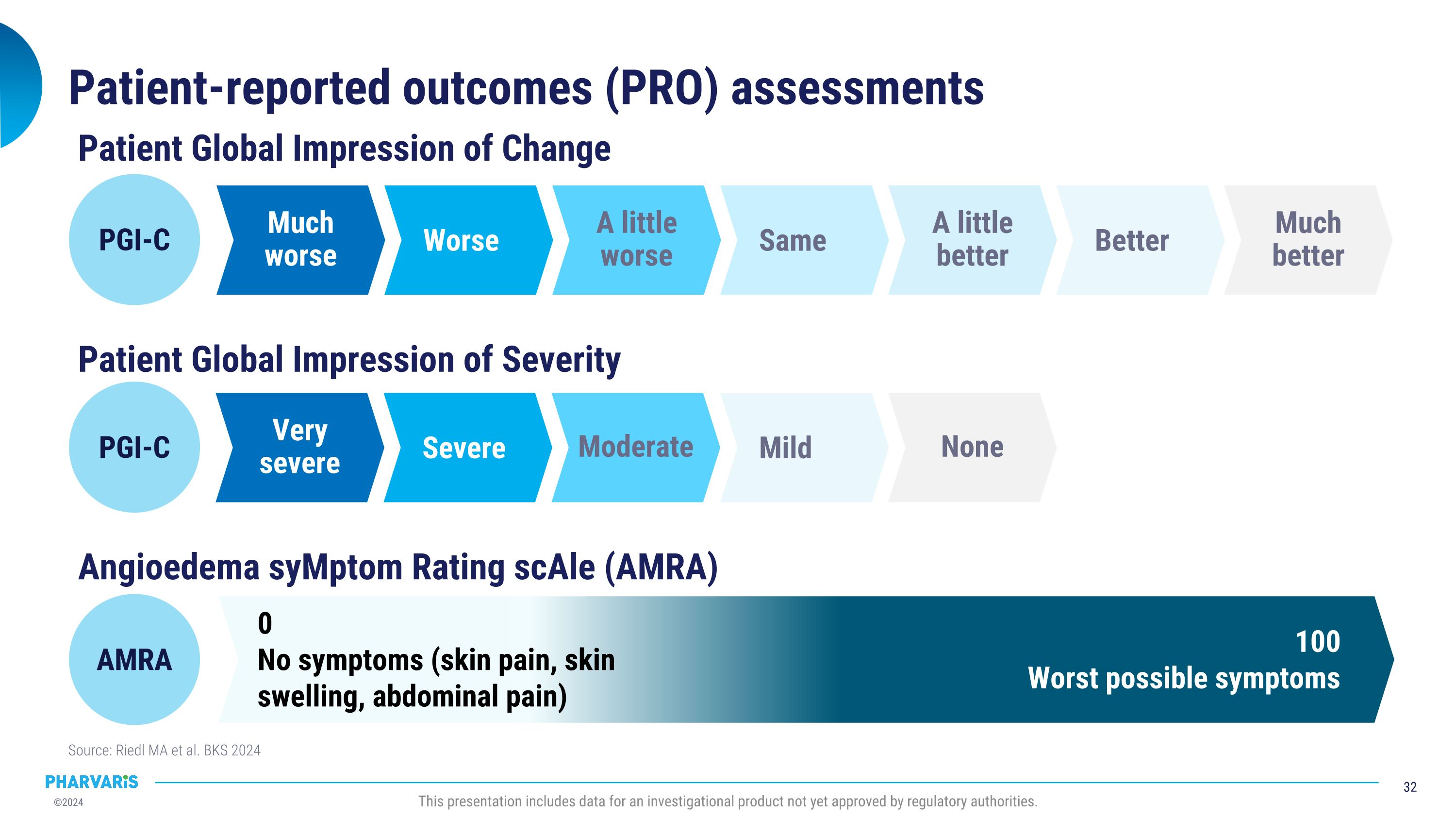
患者自评结果(PRO)评估来源:Riedl MA等。BKS 2024本演示文稿包括尚未获得监管机构批准的试验性产品的数据。患者整体改善评价 PGI-C 更坏 更差 稍差 与之同等 稍好 更好 显著好转 患者整体严重程度评价 非常严重 严重 中度 轻度 无 PGI-C 丘疹性水肿症状评分尺度(AMRA) 100 最严重的症状 0 没有症状(皮肤疼痛、皮肤肿胀、腹痛) AMRA

RAPIDe-1,一项关于HAE的季相2的随需应变性研究。症状恶化在25-26分钟内结束*(基于AMRA-3)†2 症状缓解发作在2.4小时内*(AMRA-3减少≥30%)1 救助药物使用减少5倍*1 81.7%的发作在24小时内达到症状缓解*(所有症状复合体中的TOS PRO为“好转或缓解”)†3 所有剂量下的Deucrictibant耐受良好1 *集合10、20、30毫克Deucrictibant治疗组 †基于事后分析 来源:1Maurer m等人 ACAAI 2023. 2 Riedl MA等人 ACAAI 2023. 3李H等人 EAC 2024. 达到主要终点:deucrictibant IR显著 减少发作症状与安慰剂相比*1 本报告包括尚未获得监管机构批准的正在研究中产品的数据。
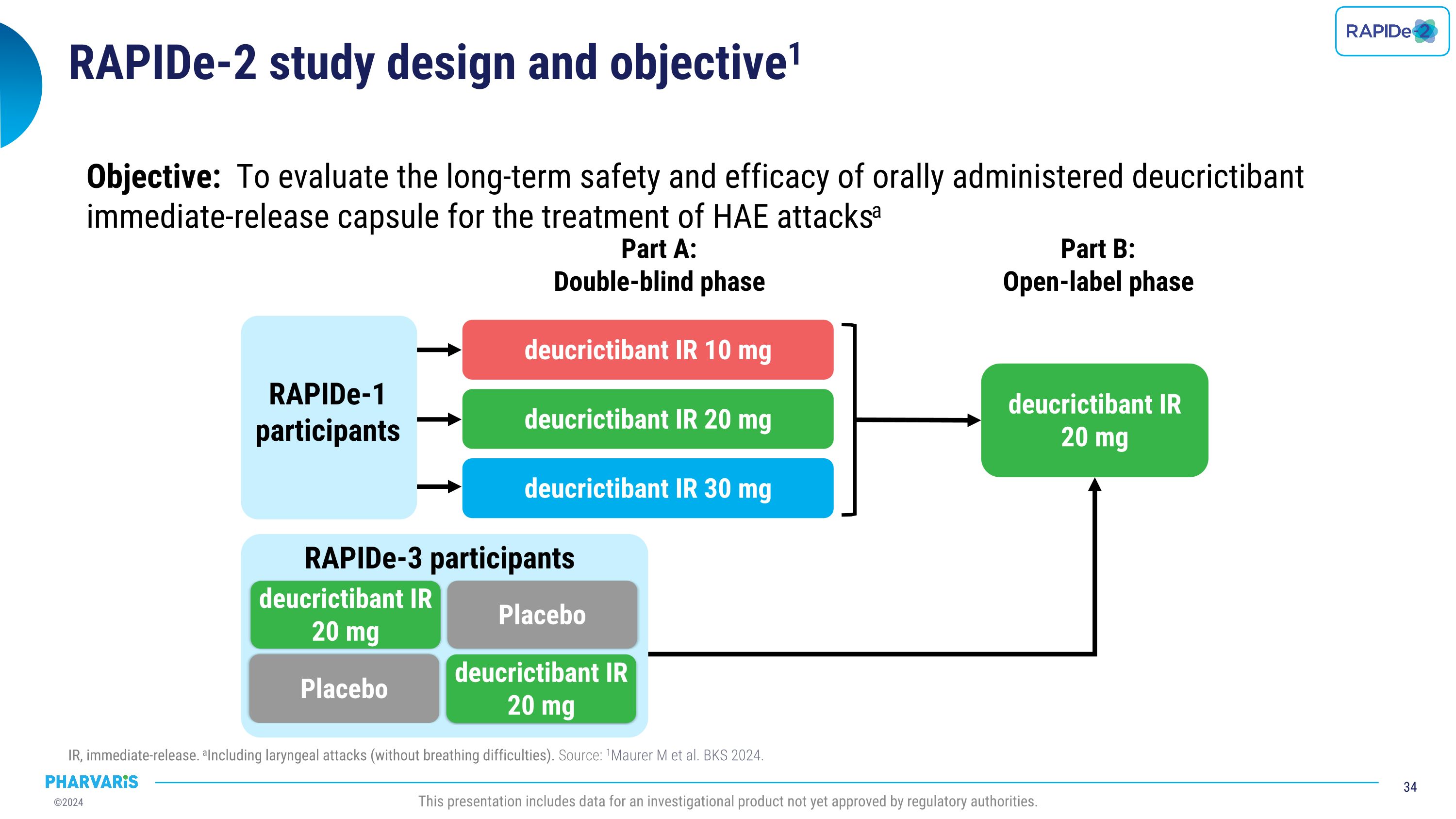
RAPIDe-2研究设计和目标1 IR,即时释放。包括喉头发作(没有呼吸困难)。来源:1Maurer m等人。BKS 2024。本报告包括尚未获得监管机构批准的一种研究产品的数据。目标:评估口服即时释放的deucrictibant胶囊用于HAE发作的长期安全性和有效性a部分A:双盲阶段B部分:开放标签阶段RAPIDe-1参与者deucrictibant IR 10毫克deucrictibant IR 20 mgdeucrictibant IR 30 mgdeucrictibant IR 20 mgRAPIDe-3参与者安慰剂deucrictibant IR 20 mg安慰剂deucrictibant IR 20 mg
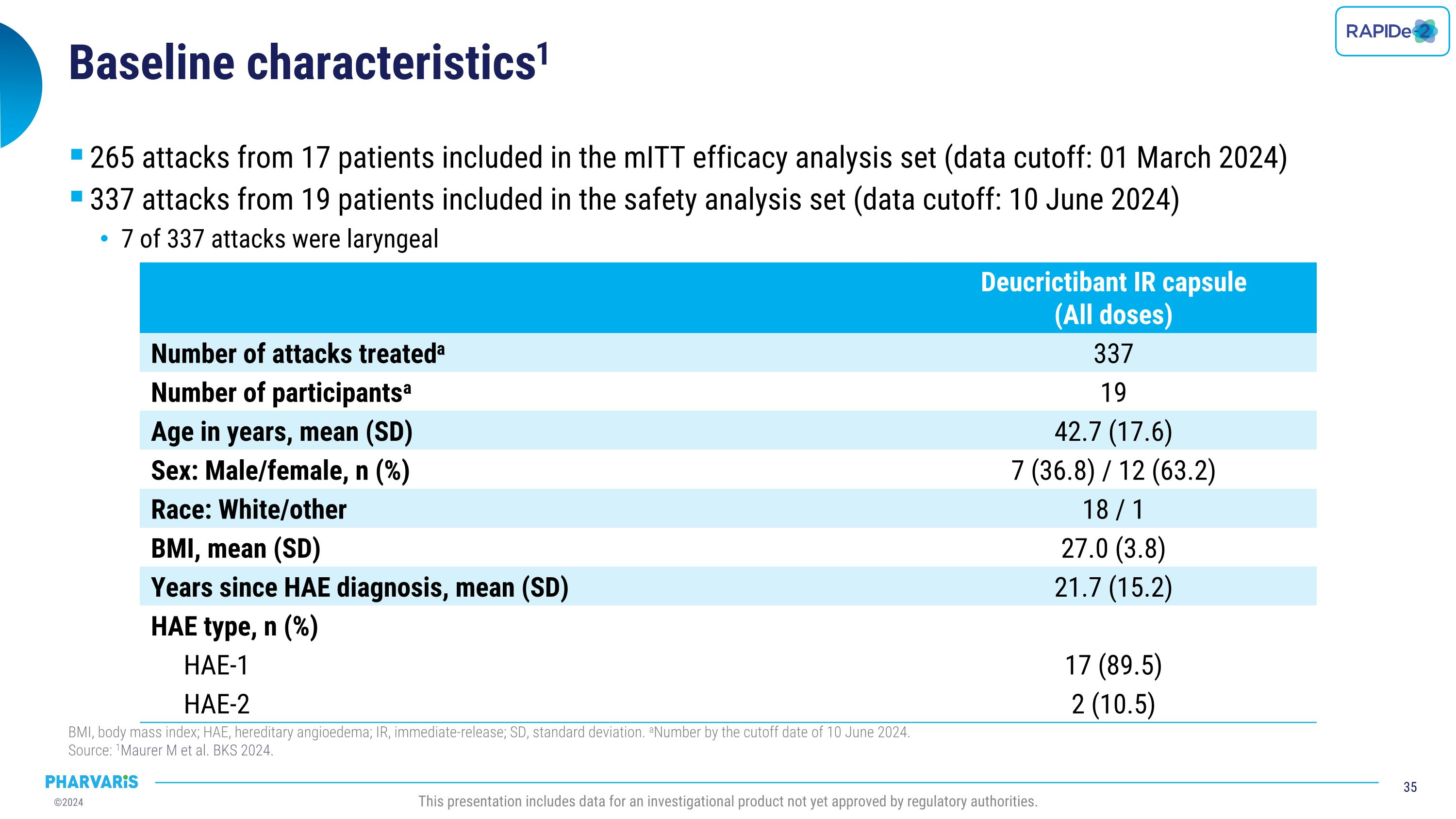
基线特征:mITt有效性分析集合中包括了17名患者的265次发作(数据截止日期:2024年3月1日),安全性分析集合中包括了19名患者的337次发作(数据截止日期:2024年6月10日),其中7次发作为喉部。BMI,身体质量指数;HAE,遗传性血管水肿;IR,即时释放;SD,标准偏差。截至2024年6月10日的数量。 来源:Maurer等人,BKS 2024。此报告包括尚未获得监管机构批准的调查产品的数据。Deucrictibant IR胶囊(所有剂量)治疗的发作次数:337,患者人数:19,年龄,均值(SD):42.7(17.6),性别:男性/女性,数量(%):7(36.8)/12(63.2),种族:白人/其他,18/1,BMI,均值(SD):27.0(3.8),自HAE诊断以来的年数,均值(SD):21.7(15.2),HAE类型,数量(%):HAE-1,17(89.5);HAE-2,2(10.5)
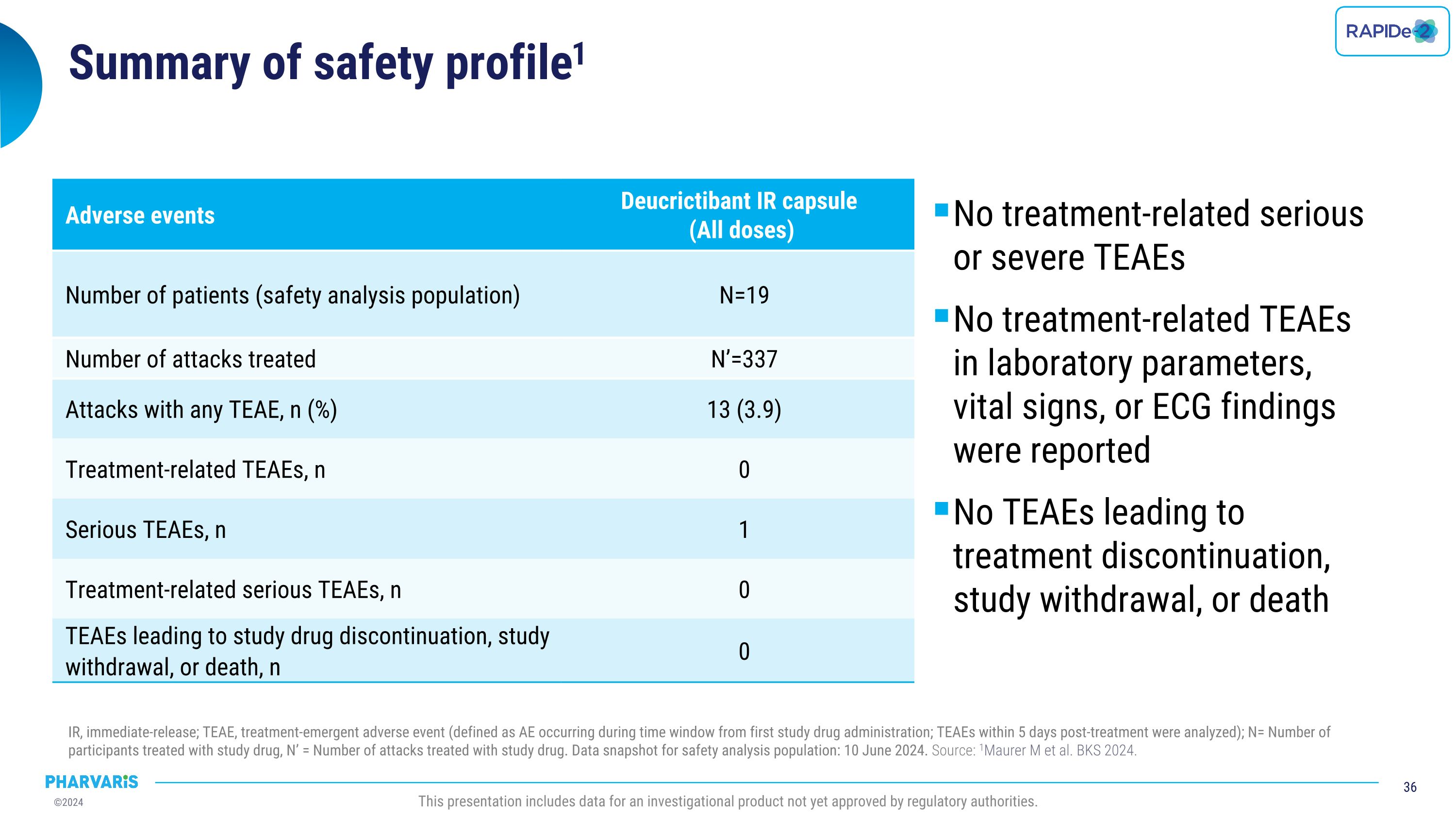
安全概况总结1 未出现与治疗相关的严重或严重的治疗相关不良事件 未报告与实验室参数、生命体征或心电图结果相关的治疗相关不良事件 未出现因不良事件导致的治疗中断、研究退出或死亡 立即释放(IR);TEAE,治疗期新出现的不良事件(定义为首次接受研究药物给药后发生的不良事件;在发帖后5天内发生的TEAEs得以分析);N=接受研究药物治疗的参与者数量,N’=接受研究药物治疗的发作数量。安全分析人群的数据快照:2024年6月10日。来源: Maurer等人,BKS 2024。该报告包含尚未获得监管机构批准的调查产品的数据。 不良事件 德克瑙他胺立即释放胶囊(所有剂量) 患者数量(安全分析人群)N=19 接受治疗的发作数量N’=337 有任何TEAE的发作,n(%)13 (3.9) 与治疗相关的TEAEs,n 0 严重的TEAEs,n 1 与治疗相关的严重的TEAEs,n 0 TEAEs导致研究药物中断、研究退出或死亡,n 0
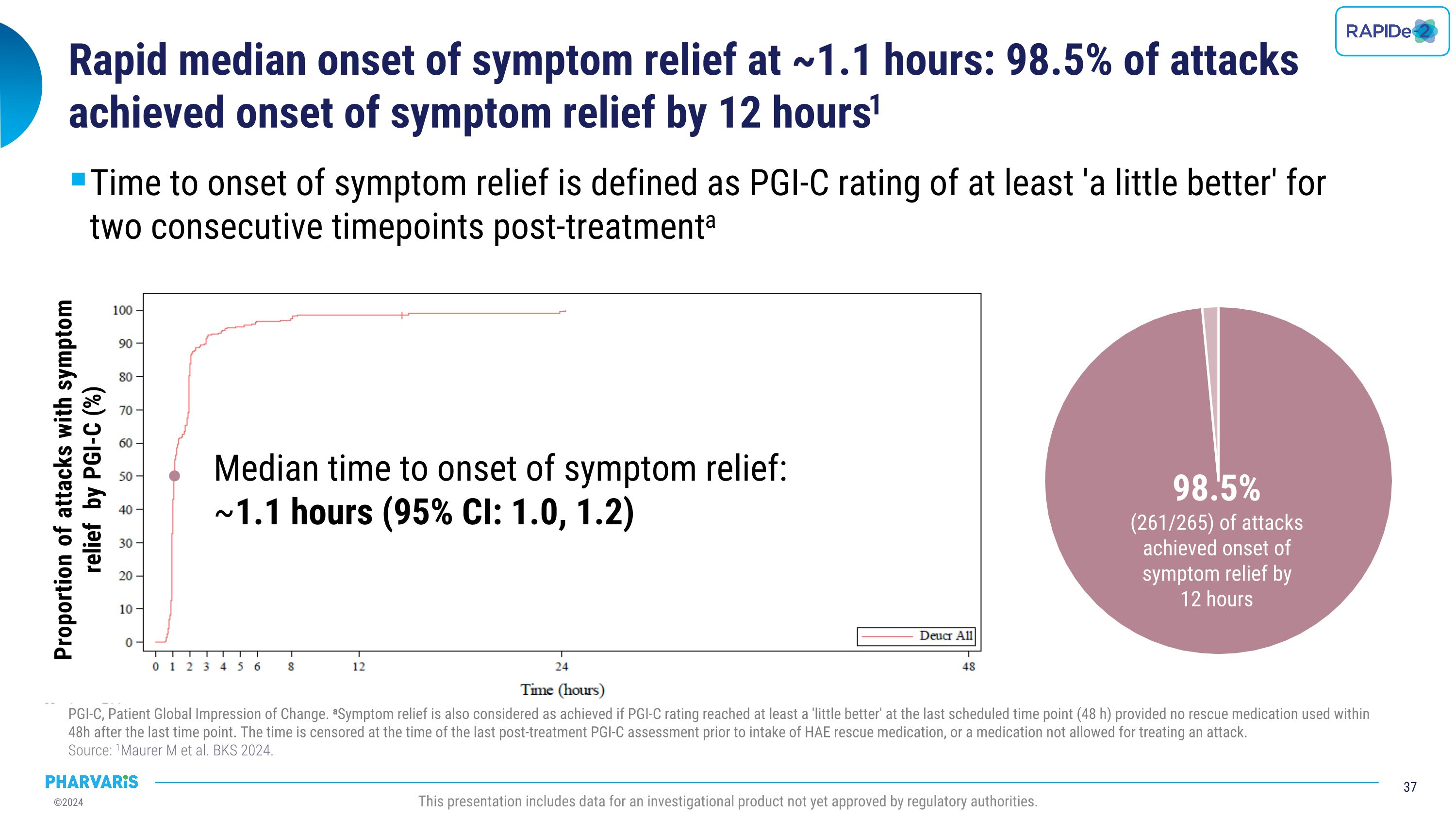
症状缓解的快速中位数发作时间为约1.1小时:98.5%的发作在12小时内实现了症状缓解。症状缓解发作时间被定义为连续的两个时间点治疗后的PGI-C评分至少为“稍微好转”。PGI-C代表患者整体状况的变化。如果最后一个预定时间点(48小时)内未使用救助药物,并且在最后一次时点之后的48小时内未使用救助药物,那么也认为已经实现了症状缓解。时间以治疗后最后一次PGI-C评估之前使用HAE救助药物的时间为截止点,或者使用了一种不被允许用于治疗发作的药物。 来源:1Maurer m et al. BKS 2024. 此演示包括一种尚未获得监管机构批准的研究性产品的数据。根据PGI-C评分,症状缓解的比例为(%)症状缓解的中位数发作时间为:约1.1小时(95% CI:1.0, 1.2)
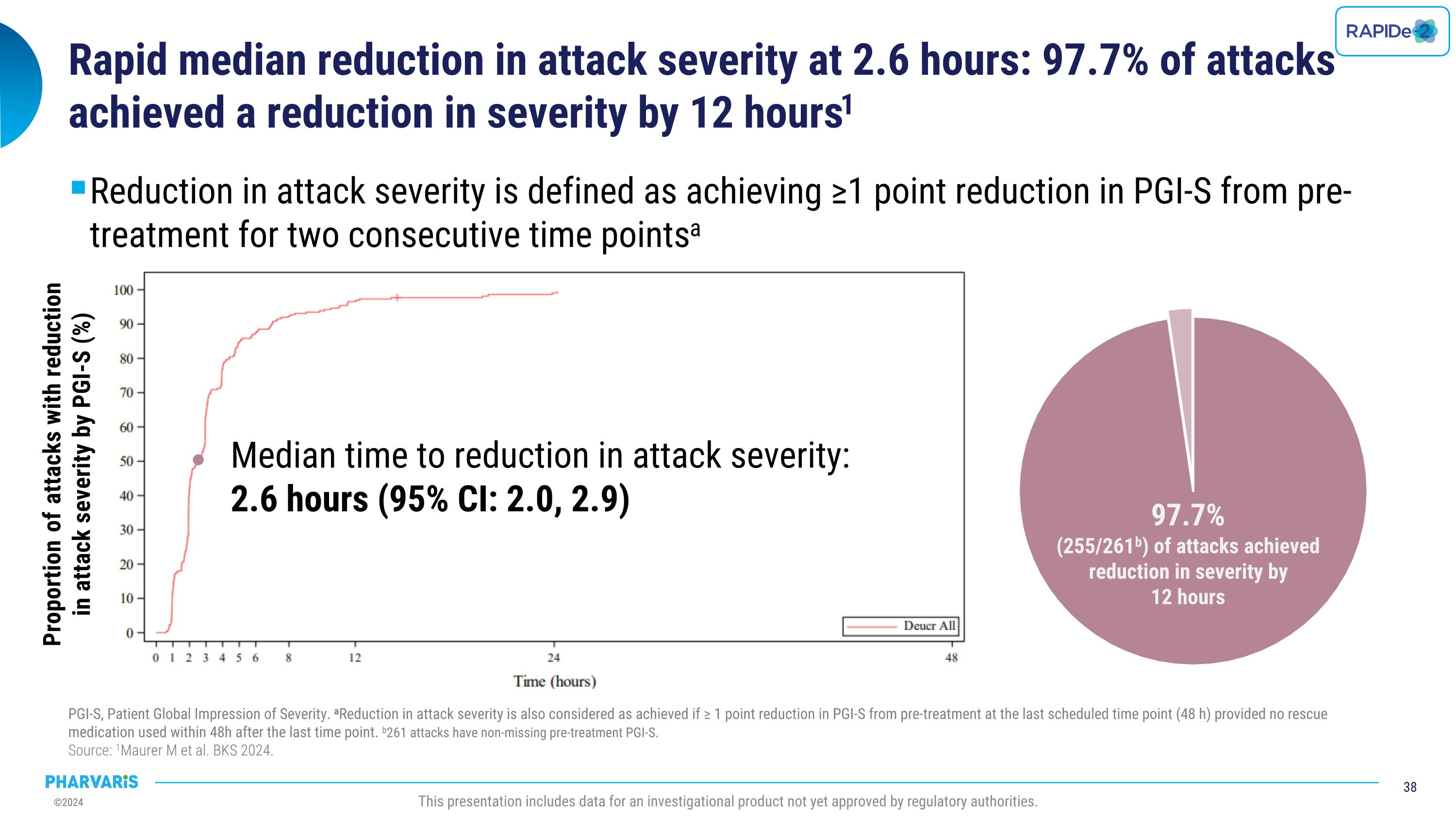
2.6小时内攻击严重程度快速中位数降低:97.7%的攻击在12小时内实现了严重程度的降低。攻击严重程度的降低被定义为在两个连续时间点上达到PGI-S前治疗的≥1分减少。PGI-S,患者全球印象严重程度。如果最后计划的时间点(48小时)内未使用救援药物,且在最后一个时间点后48小时内未使用救援药物,则也可以认为攻击严重程度降低≥1分。261次攻击有未缺失的前治疗PGI-S值。 来源:1Maurer m等人,BKS 2024。本报告包括尚未获得监管机构批准的研究产品的数据。降低攻击严重程度的中位时间: 2.6小时(95% CI:2.0, 2.9)具有攻击严重程度降低的比例按照PGI-S进行(%)
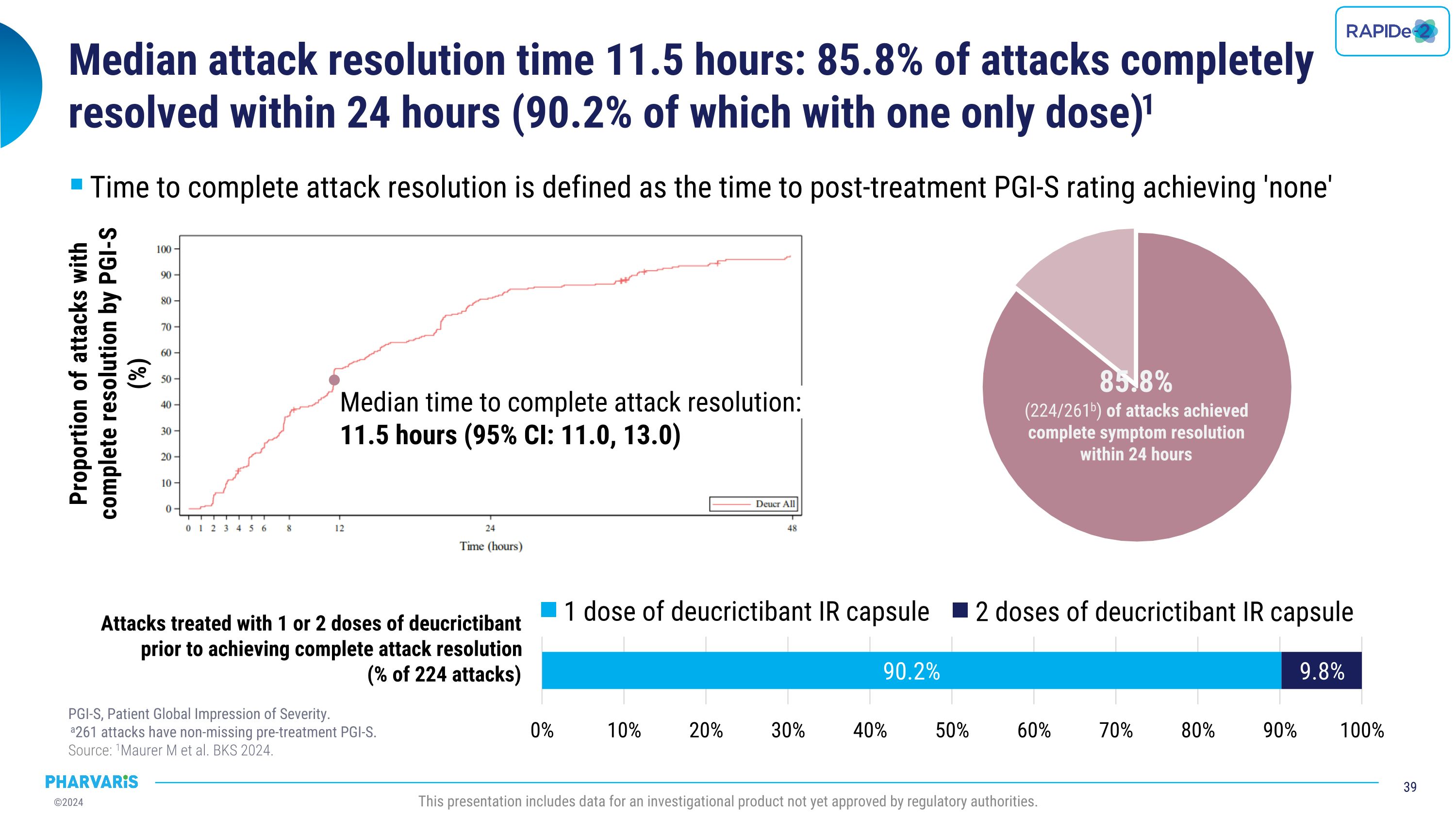
中单攻击解决时间的中位数为11.5小时:85.8%的攻击在24小时内完全解决(其中有90.2%的攻击仅需要一种药物)。攻击解决的时间被定义为治疗后的PGI-S评分达到“无”。共有261次攻击的预治疗PGI-S评分未缺失。来源:Maurer等人,《BKS 2024》,此展示包含尚未获得监管机构批准的研究性产品的数据。攻击完全解决的中位数时间:11.5小时(95% CI: 11.0, 13.0)PGI-S评分达到完全解决的攻击比例(%):1剂脱克瑞替邦IR胶囊 2剂脱克瑞替邦IR胶囊在完全解决攻击之前接受1或2剂脱克瑞替邦胶囊治疗的攻击的比例(224次攻击的百分比)
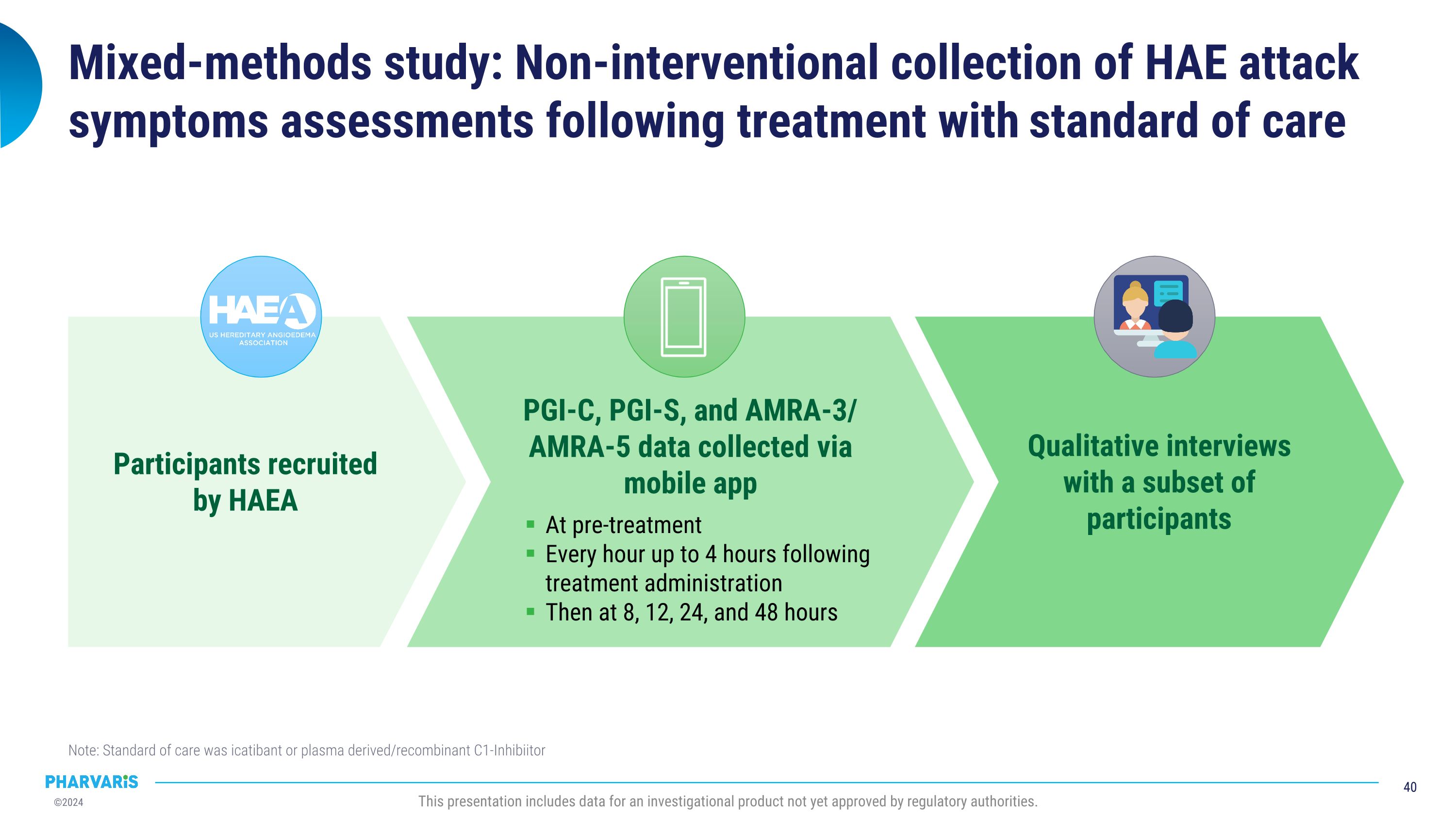
混合方法研究:标准护理治疗后,非干预性收集HAE发作症状评估,注意:标准护理为icatibant或血浆衍生/重组C1抑制剂。此演示包括尚未获得监管机构批准的调查产品的数据。通过HAEA PGI-C、PGI-S和AMRA-3/AMRA-5数据在移动应用程序上招募参与者。治疗前每小时进行治疗后4小时的监测然后在8、12、24和48小时时进行定性访谈与部分参与者
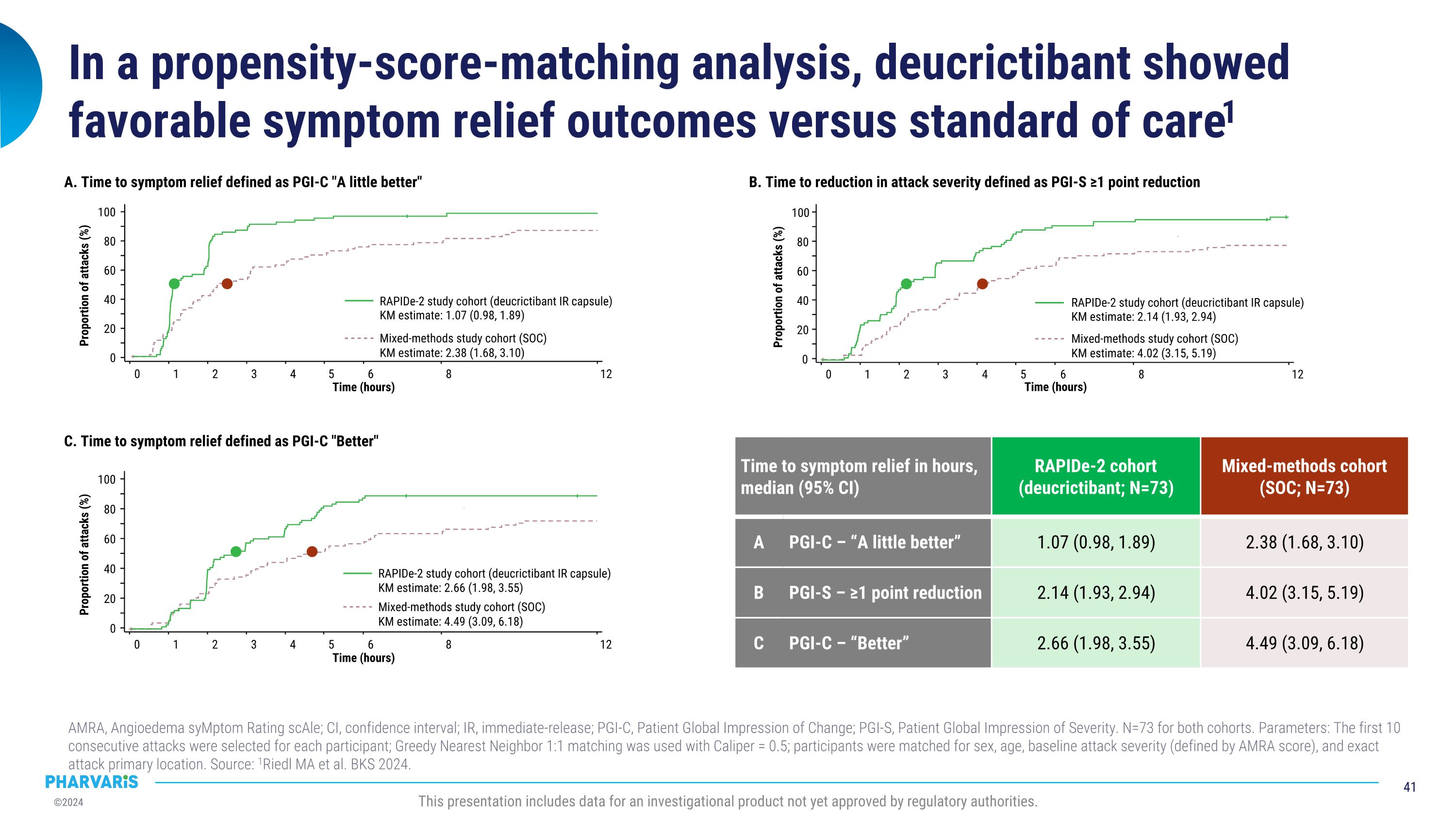
在倾向分数匹配分析中,与标准护理相比,deucrictibant显示出良好的症状缓解效果1。本演示文稿包括监管机构尚未批准的研究产品的数据。AMRA,血管性水肿症状评级量表;CI,置信区间;投资者关系,即时释放;PGI-C,患者全球变化印象;PGI-S,患者对严重程度的全球印象。两个队列的 N=73。参数:为每位参与者选择了前 10 次连续攻击;使用 Caliper = 0.5 的 Greedy Nearest Neighbor 1:1 配对;根据性别、年龄、基准攻击严重程度(由 AMRA 分数定义)和确切的攻击主要位置对参与者进行匹配。资料来源:1Riedl MA 等人。BKS 2024。A. 症状缓解时间定义为 PGI-C “好一点” 0 1 2 3 4 6 12 时间(小时)0 20 40 60 80 100 发作比例(%)混合方法研究队列(SOC)Km 估计:2.38(1.68、3.10)Rapide-2 研究队列(去氯替班投资者关系胶囊)Km 估计值:1.07(0.98,1.89)5 C。症状缓解时间定义为 PGI-C “更好” 发作比例 (%) 0 8 1 2 5 3 4 6 12 时间(小时)0 20 40 60 80 100 混合方法研究队列 (SOC) Km 估计值:4.49 (3.09, 6.18) Rapide-2 研究队列(deucrictibant IR 胶囊)Km 估计值:2.66(1.98,3.55)b。攻击严重程度降低定义为 PGI-S 降低 ≥1 点攻击比例 (%) 0 1 2 5 3 4 6 12 时间(小时)0 20 40 60 80 100 混合方法研究队列 (SOC) Km 估计值:4.02 (3.15、5.19) Rapide-2 研究队列(deucrictibant IR 胶囊)Km 估计值:2.14(1.93,2.94)8 出现症状的时间以小时为单位缓解,中位数(95% 置信区间)Rapide-2 队列(deucrictibant;N=73)混合方法队列(SOC;N=73)A PGI-C — “好一点” 1.07(0.98,1.89)2.38(1.68,3.10)b PGI-S — 降幅≥1点 2.14(1.93,2.94)4.02(3.15,5.19)) C PGI-C — “更好” 2.66 (1.98, 3.55)4.49 (3.09、6.18)

RAPIDe-3临床研究
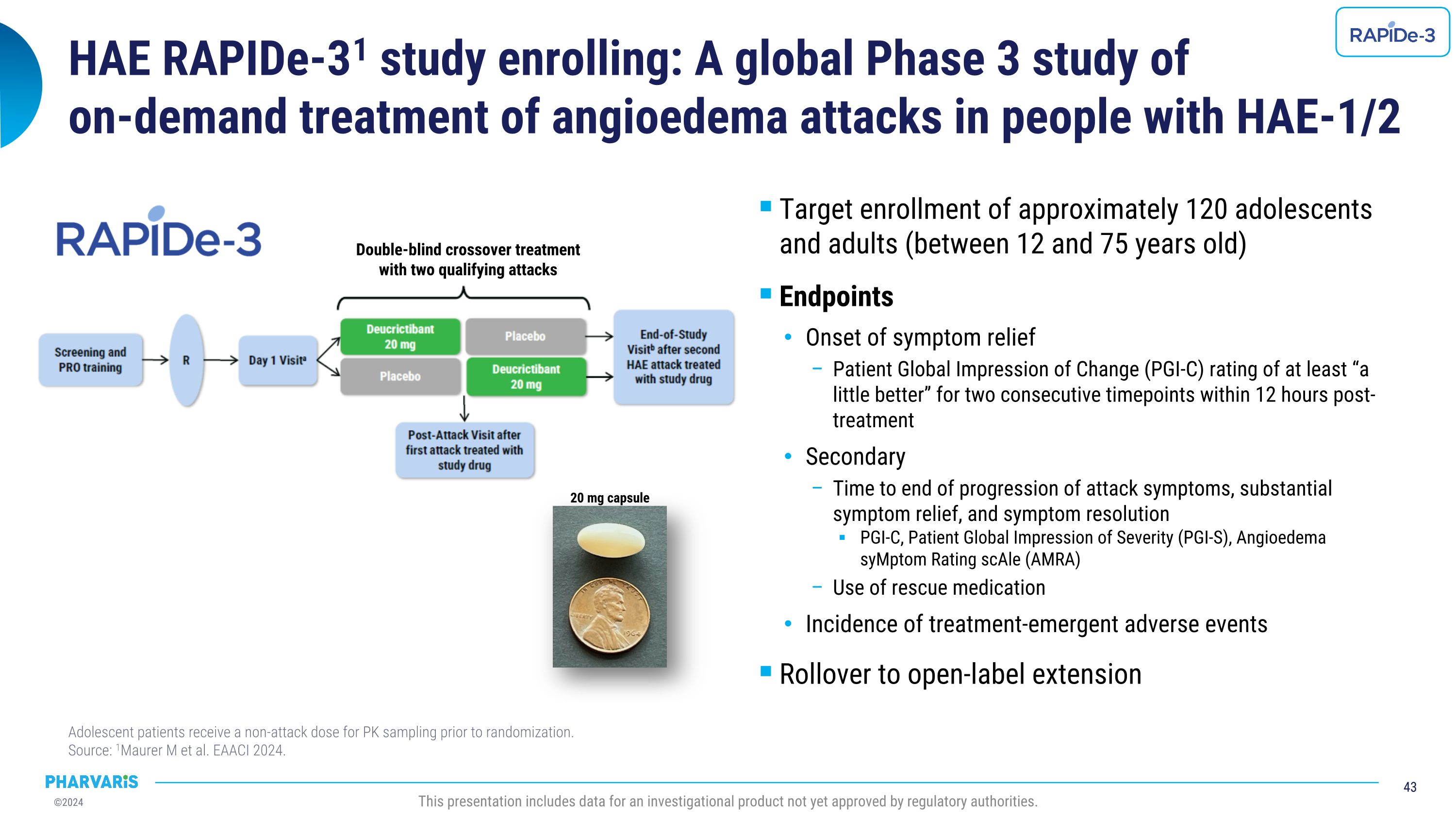
HAE RAPIDe-31研究正在招募:一项针对HAE-1/2患者的全球性3期研究,研究内容为按需治疗血管性水肿发作,并包括约120名12至75岁的青少年和成年人。终点评估包括症状缓解的起始时间、患者整体改善印象(PGI-C)评分在12小时内至少连续2次达到“稍有好转”,次要终点评估包括发作症状进展结束时间、明显的症状缓解和症状缓解,PGI-C、患者整体严重程度评估(PGI-S)、血管性水肿症状评分量表(AMRA)、急救药物使用、治疗相关不良事件的发生率,青少年患者在随机化之前需接受非发作剂量用于药代动力学采样。 来源:1Maurer m et al. EAACI 2024. 20毫克胶囊。此演示文稿包括尚未获得监管机构批准的待批治疗产品数据。双盲交叉治疗,涵盖两次符合资格的发作。
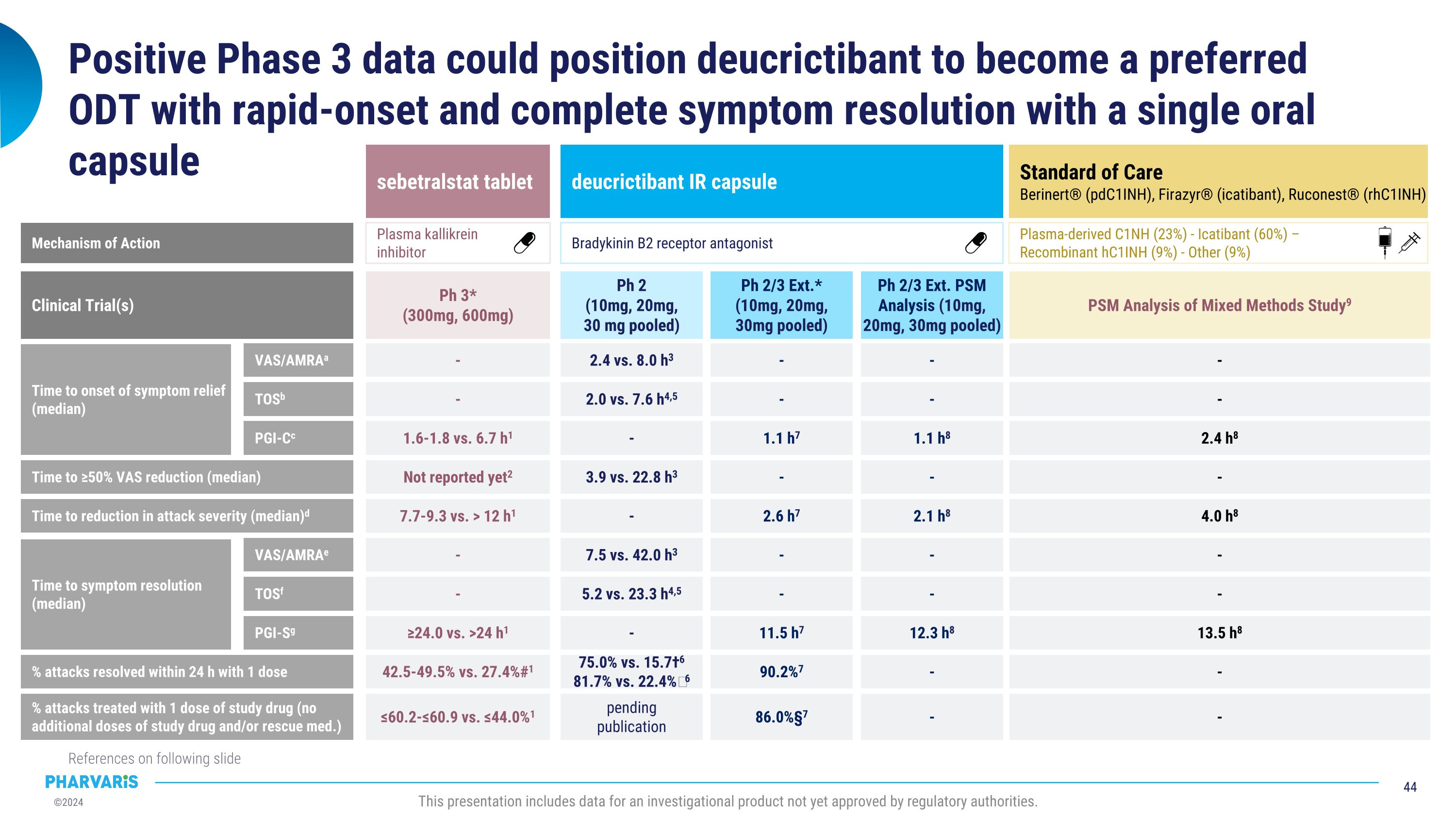
血浆源性C1NH(23%) - Icatibant(60%) - 重组hC1INH(9%) - 其他(9%)积极的3期数据可能让deucrictibant成为首选ODt,并通过一颗口服胶囊实现快速缓解症状和完全缓解症状。以下幻灯片上有参考文献。本演示文稿包含尚未获得监管机构批准的研究性产品的数据。症状缓解的时间(中位数) 标准治疗 Berinert®(pdC1INH),Firazyr®(icatibant),Ruconest®(rhC1INH) - - 2.4小时8 - 4.0小时8 - - 13.5小时8 - 混合方法研究的PSm分析9 临床试验 时间达到VAS降低50%(中位数) 攻击严重程度降低时间(中位数) 症状缓解时间(中位数) 攻击缓解百分比(1剂量内24小时内) - 用一剂量治疗攻击的百分比(无额外剂量的研究药物和/或救护药物) VAS / AMRAa TOSb PGI-Cc VAS / AMRAe TOSf PGI-Sg 动作机制 sebetralstat片剂 deucrictibant IR胶囊 2.4小时vs.8.0小时3 - 2.0小时vs.7.6小时4,5 - - 1.1小时7 3.9小时vs.22.8小时3 - - 2.6小时7 7.5小时vs.42.0小时3 - 5.2小时vs.23.3小时4,5 - - 11.5小时7 75.0% vs. 15.7†6 81.7% vs. 22.4%‖6 90.2%7 - - 1.6-1.8小时vs.6.7小时1 尚未报告2 7.7-9.3小时vs.> 12小时1 - - ≥24.0小时vs.> 24小时1 42.5-49.5% vs. 27.4%#1 Ph 2(10毫克,20毫克,30毫克混合) Ph 2/3 Ext.*(10mg, 20mg, 30mg混合) Ph 3*(300mg, 600mg)待发表 86.0%§7 ≤60.2-≤60.9% vs. ≤44.0%1 脑缺血 B2受体拮抗剂 血浆激肽清蛋白酶抑制剂 - - 1.1小时8 - 2.1小时8 - - 12.3小时8 - Ph 2/3 Ext. PSm分析(10mg,20mg,30mg混合) -

ODt比较数据参考 * 用于治疗药物的发作包括非喉部和喉部的发作。#通过PGI-S评估症状缓解。†通过VAS / AMRA评估症状缓解。‖通过TOS评估症状缓解。a.通过VAS / AMRA定义为“从治疗前评分减少30%以上的VAS-3”在3个中减轻的症状的开始时间解释为“VAS / AMRA的缓解症状开始时间定义为“基线受影响的所有症状群在两个或多个连续时间点上首次达到至少对所有其他症状群没有新出现症状的少量改善””,如果改善在两个连续时间点上持续。”在4,5. c.通过PGI-C定义为“症状缓解的开始时间如在时间事件分析中评估的那样。”缓解症状的开始被定义为在试剂首次给药后的12小时内,在7个和8个时间点以及在1个时间点之内,使用了7点病人整体变化评估量表(PGI-C)的评分(评分范围从“好多”到“糟糕多”),评分范围达到了两个或更多连续时间点。””在1个和7个时间点的至少有连续的两个时间点”以及在试剂给药后的12小时内下降了7,8. d.通过PGI-S评估为“发作严重程度的降低被定义为在首次给药后的12小时内,在1个时间点上改善的5点病人整体严重程度评估量表(PGI-S)的评分(评分从“无”到“非常严重”)达到了两个或更多连续时间点。””在7个和8个试剂给药后的12小时内,从治疗前获得了≥1分缓解严重程度的病人整体严重程度评估量表(PGI-S)到达了连续的两个时间点。”’e.通过VAS / AMRA定义为“所有3个单独的VAS项目≤10。”在3个中解释的症状缓解的开始时间解释为“TOS根据‘基线受影响的所有症状群首次达到‘好多或缓解’并且在任何其他症状群中没有新症状报告的时间点’。””在.4,5 g.通过PGI-S评估解释为“在治疗后24小时达到PGI-S评分为“无””在1个和7个中的连续两个时间点。”点,.1. Riedl MA等 2024年N Engl J Med。 2. https://www.clinicaltrialsregister.eu/ctr-search/trial/2021-001226-21/DE(于2024年9月2日访问)。 3. Maurer m等 2023年AAAAI。 4. Riedl MA等 2023年C1INH研讨会。 5. RAPIDe-1 Phase 2 Top-line data presentation,https://ir.pharvaris.com/static-files/733117c4-4632-4bd6-a930亿.9484c46e063c(于2024年9月2日访问)。 6. Li HH等2024年EAC。 7. Maurer m等2023年BKS。 8. Riedl MA等2024年BKS。 9. Mendivil等2023年UCARE此演示包括尚未获得监管当局批准的研究用产品的数据。

我们的策略是成为HAE市场的领导者,注:这是一个愿景,需要通过第三阶段临床数据来确认 这份演讲包括了尚未获得监管机构批准的研究性产品的数据 1 2 4 3 赢得口服LTP市场 成为首选LTP利用 B2R拮抗剂MoA的组合 成为ODt LTP的标准护理 在HAE社区进行深度合作的基础上开始

超越HAE
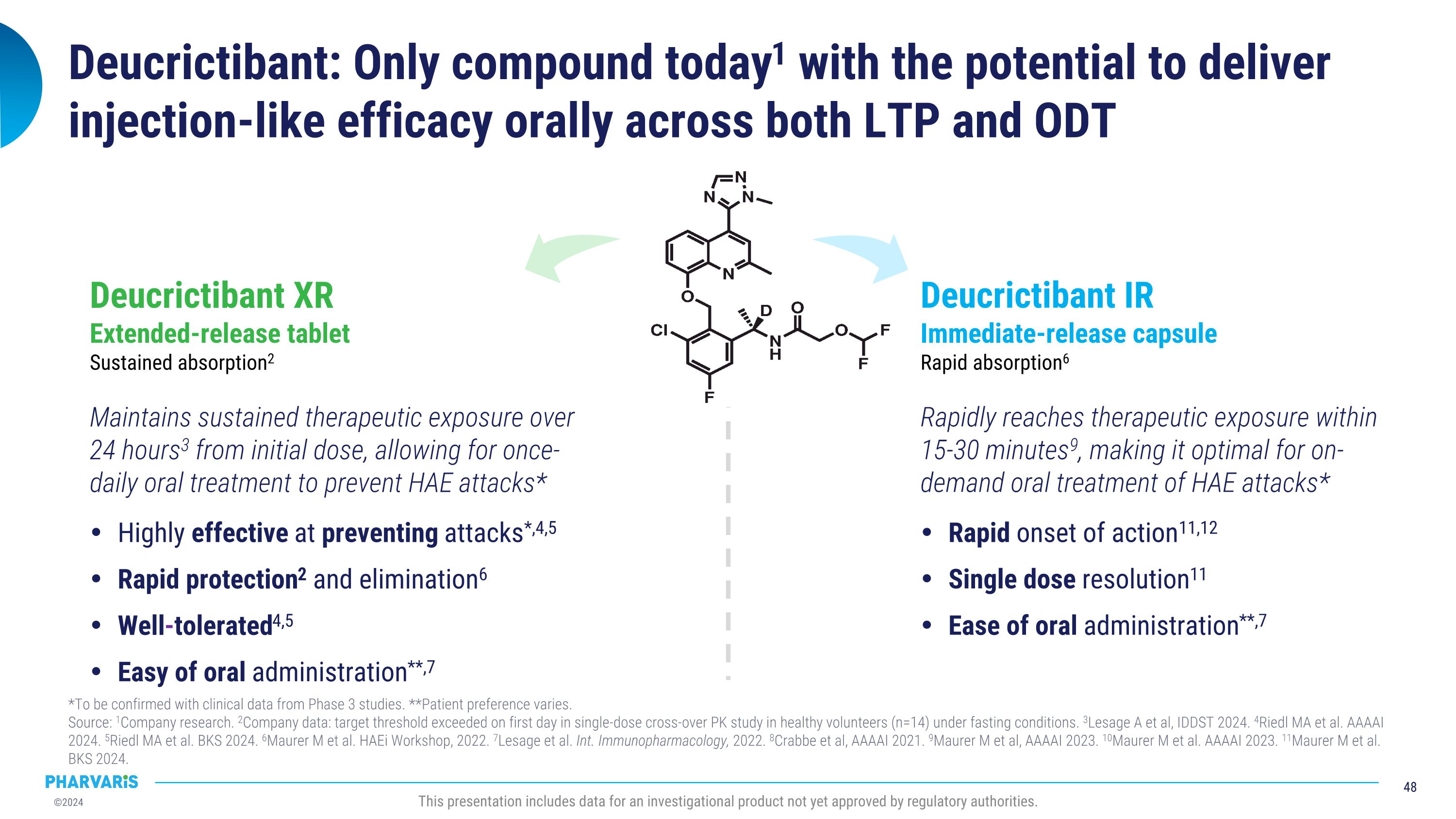
说明:今日只有compound1有潜力在LTP和ODt两方面实现口服注射般的疗效*需通过第3期临床数据确认。**患者偏好因人而异。 来源:1公司研究。2公司数据:单剂量交叉PK研究中,健康志愿者(n=14)在空腹条件下首日达到目标阈值。3Lesage A等人,IDDSt 2024. 4Riedl MA等人,AAAAI 2024. 5Riedl MA等人,BKS 2024. 6Maurer中单等人,HAEi Workshop,2022. 7Lesage等人,Int. Immunopharmacology,2022. 8Crabbe等人,AAAAI 2021. 9Maurer中单等人,AAAAI 2023. 10Maurer中单等人,AAAAI 2023. 11Maurer中单等人,BKS 2024. 本演示包括尚未获得监管机构批准的一种调查性产品的数据。Deucrictibant XR 延长释放片 持续吸收2 从初始剂量开始,维持持续治疗曝光,每24小时3次,可实现一天一次的口服治疗,预防HAE发作*在预防发作*4,5方面效果显著,保护快2和消除6良好耐受性4,5口服易**,7 Deucrictibant IR 即时释放胶囊 快速吸收6 15-30分钟9内迅速达到治疗曝光,最适合HAE发作的即时口服治疗* 快速起效11,12单剂量解决方便11口服易**,7
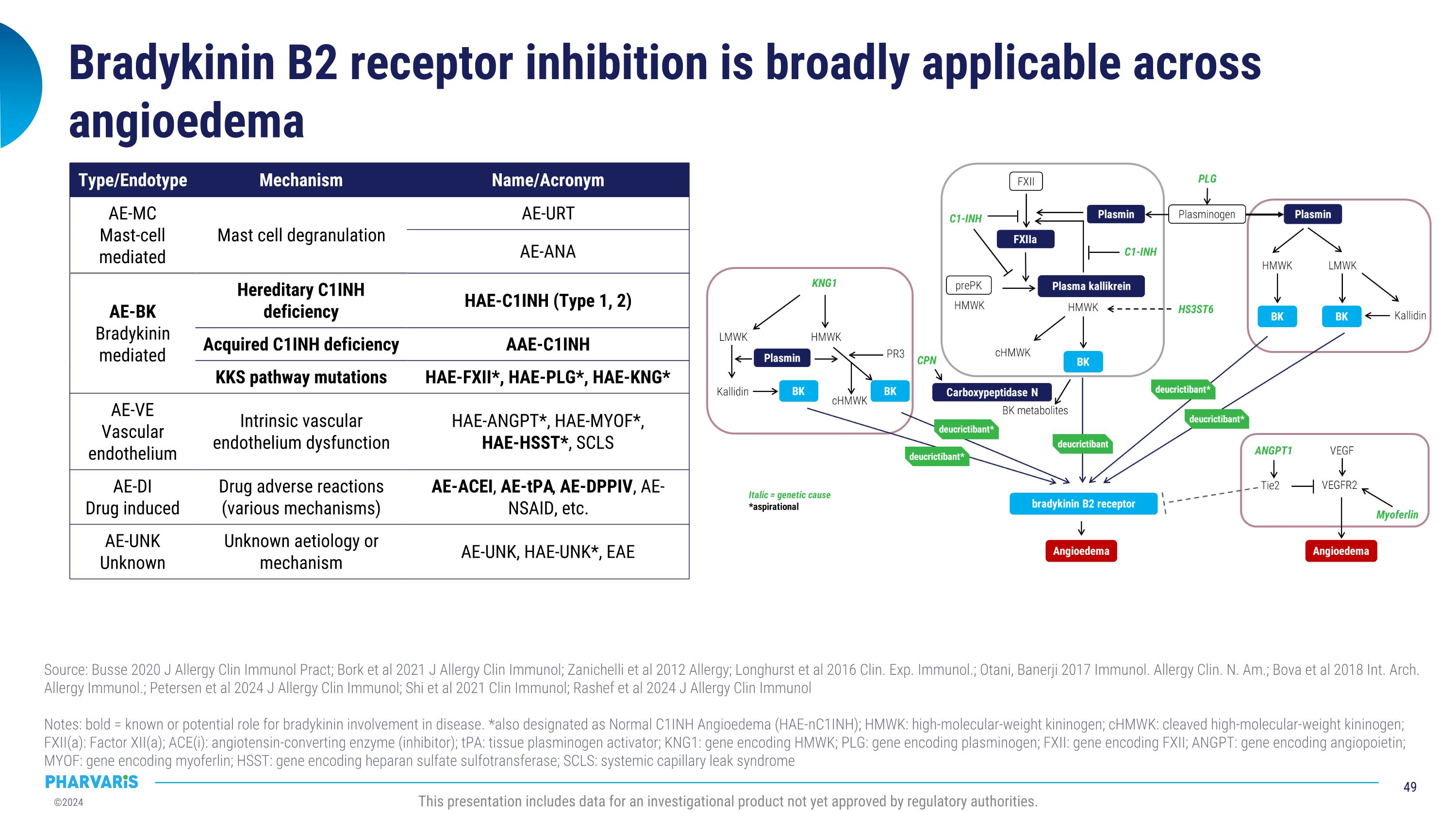
布雷地昆B2受体抑制在血管性水肿上具有广泛适用性来源:布斯2020年《过敏与临床免疫学实践杂志》;博克等2021年《过敏与临床免疫学杂志》;扎尼基利等2012年《过敏症期刊》;朗赫斯特等2016年《临床与实验免疫学杂志》;奥塔尼、巴内尔吉2017年《免疫与过敏症临床北美版》;博瓦等2018年《国际过敏与免疫学档案》;彼得森等2024年《过敏与临床免疫学杂志》;实等2021年《临床免疫学杂志》;拉希弗等2024年《过敏与临床免疫学杂志》备注:粗体=已知或潜在的布雷地昆参与疾病的作用。*也被指定为正常C1INH血管性水肿(HAE-nC1INH);HMWK:高分子量激肽原;cHMWK:裂解的高分子量激肽原;FXII(a):第XII因子(a);ACE(i):血管紧张素转换酶(抑制剂);tPA:组织纤溶酶原激活物;KNG1:编码HMWK的基因;PLG:编码纤溶酶原的基因;FXII:编码FXII的基因;ANGPT:编码血管生成素的基因;MYOF:编码myoferlin的基因;HSST:编码硫酸肝素硫转移酶的基因;SCLS:全身毛细血管漏综合征类型/终止型机制名称/缩写AE-MC肥大细胞介导肥大细胞脱颗粒AE-URtAE-ANA AE-Bk布雷地昆介导家族性C1INH缺乏症HAE-C1INH(类型1、2)获得性C1INH缺乏症AAE-C1INH KKS通路突变HAE-FXII*,HAE-PLG*,HAE-KNG* AE-VE血管内皮固有血管内皮功能障碍HAE-ANGPT*,HAE-MYOF*,HAE-HSST*,SCLS AE-DI药物引起药物不良反应(各种机制)AE-ACEI,AE-tPA,AE-DPPIV,AE-NSAID,以太经典 AE-UNk未知未知的病因或机制AE-UNk,HAE-UNK*,EAE该报告包含一个尚未获得监管机构批准的调查产品的数据。
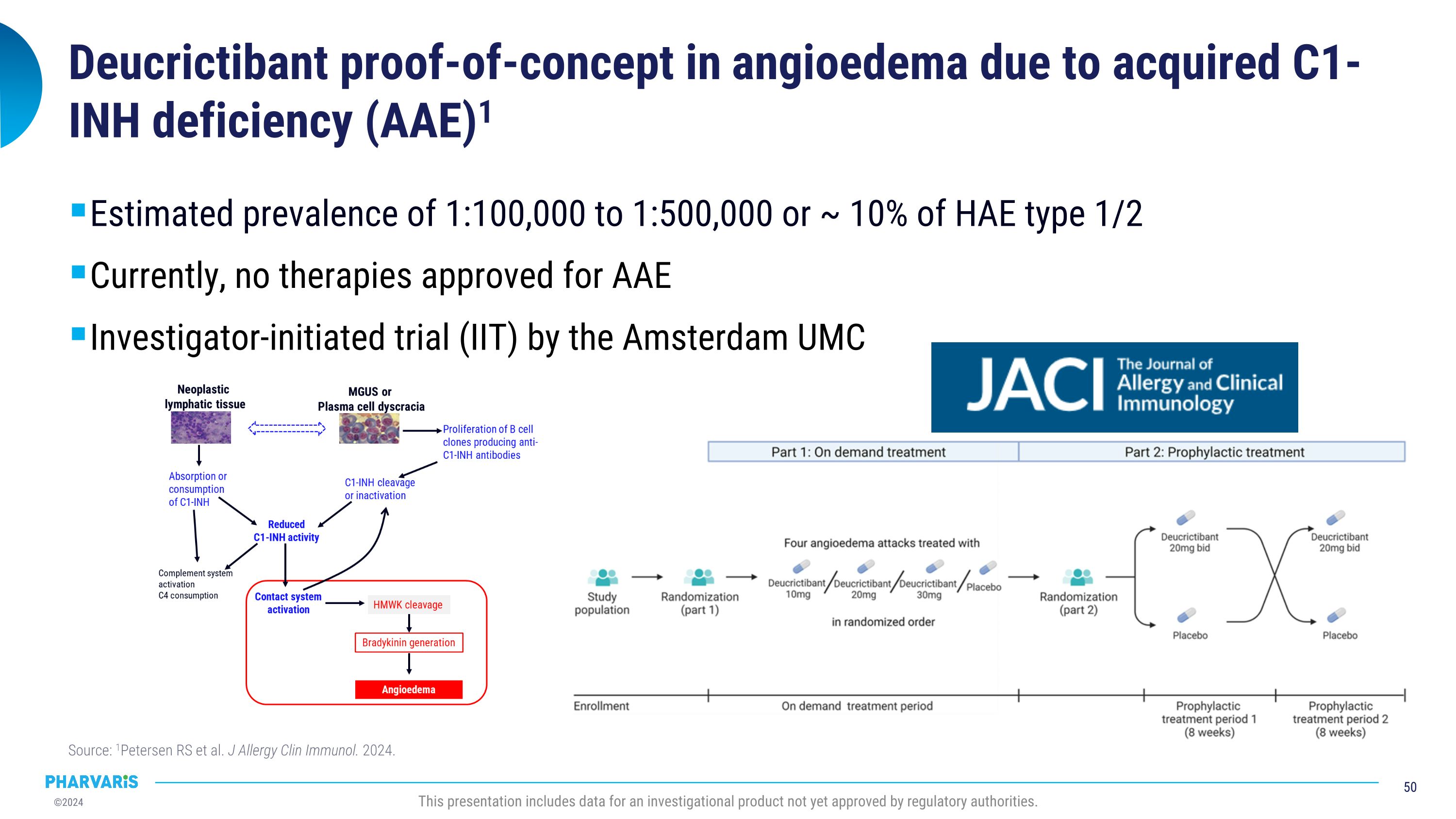
通过获得性C1-INH缺乏引起的血管性水肿的自证概念板块(AAE)的病例研究1,估计患病率为100,000至500,000(或HAE类型1/2的约10%)。目前,尚无治疗AAE的批准疗法。阿姆斯特丹大学医疗中心的研究组发起的试验(IIT)。资料来源:1Petersen RS等人。《过敏与免疫》杂志。2024年。本报告显示了尚未获得监管机构批准的一种调查产品的数据。
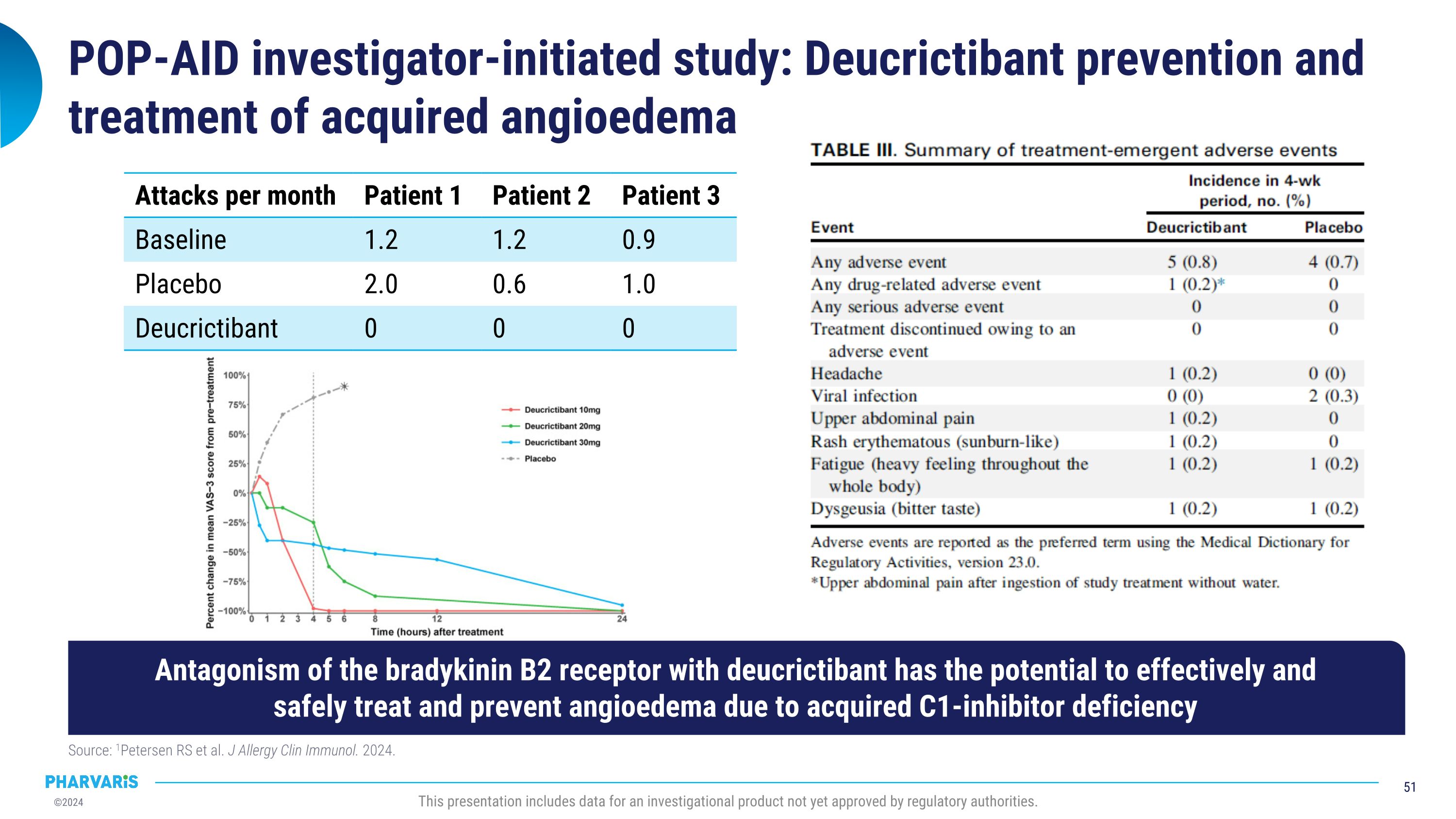
POP-AID调查员发起的研究:Deucrictibant预防和治疗获得性血管性水肿来源:1Petersen RS等人。J Allergy Clin Immunol. 2024.此演示包括尚未获得监管机构批准的调查性产品的数据。每月发作次数 患者1 患者2 患者3 基线 1.2 1.2 0.9 安慰剂 2.0 0.6 1.0 Deucrictibant 0 0 0 通过Deucrictibant对激肽酶B2受体的拮抗作用,具有潜力有效且安全地治疗和预防获得性C1-抑制剂缺陷引起的血管性水肿

罕见的过敏与免疫疾病(商业)Bk介导的疾病(研发)Bk介导的血管性水肿:nC1,AAE Pharvaris希望借助其基础的B2R专业知识,为HAE之外的疾病开发治疗方案:HAE Type 1/2。此演示包括尚未获得监管机构批准的调查性产品的数据。

www.pharvaris.com 纳斯达克: PHVS 本报告包含尚未获得监管机构批准的调查产品的数据。

PHVS有野心将deucrictibant的潜力发展成为偏好的治疗bradykinin介导疾病的选择 来源:1Riedl MA等。BKS 2024。2Maurer m等。BKS 2024。3公司研究。4Petersen RS等。J Allergy Clin Immunol。2024。5Lesage等。Int。Immunopharmacology, 2022年 长期HAE延展数据1,2巩固了我们对deucrictibant成为HAE AAE管理的首选选择的信心 基于社区的兴趣3和初始令人感兴趣的数据4,PHVS计划在AAE nC1中推进deucrictibant的开发 利用B2受体作用机制5,潜在应用于正常C1-INH遗传性血管性水肿