国立研究開発法人国立がん研究センター
エーザイ株式会社
発表のポイント
- エーザイの標的タンパク質分解誘導薬 E7820 のがん種横断的な薬効評価を、患者由来のがん組織を免疫不全マウスに移植した患者由来組織移植(PDX)モデル(膵がん、胆道がん、胃がん、子宮体がん)で実施し、全体では 38.1%、胆道がんでは 58.3%、子宮体がんでは 55.6%で腫瘍の縮小を観察しました。
- PDX モデルは治療効果の予測精度が高く、臨床データと PDX モデルの反応性の間に高い類似性があることから、本研究結果は胆道がんおよび子宮体がんにおける E7820 の腫瘍縮小効果を示唆しています。
- PDX モデルの全エクソンシークエンスを行い、E7820 の有効性予測バイオマーカーとして期待できる遺伝子変異を同定しました。
- 本研究成果は、査読付き学術誌「npj Precision Oncology」に掲載されました。
- 本研究で明らかとなった E7820 の有効性が期待されるがん種とバイオマーカーの情報に基づいて、国立がん研究センター中央病院と東病院で、日本人における忍容性を含む安全性評価と探索的な有効性評価を目的とした医師主導治験を開始します。
- 創薬開発に国立がん研究センターの J-PDX(日本人がん患者由来組織移植モデル)ライブラリーを用いることで、がん種毎の薬効評価と有効性予測バイオマーカーの同定、さらには臨床試験の立ち上げまでを一気通貫で速やかに実現することが可能となりました。今後、このような事例を積み重ね、新規抗がん剤開発を加速させる創薬研究システムとしての確立をめざします。
 概要
概要
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:中釜 斉、以下国立がん研究センター)とエーザイ株式会社(本社:東京都文京区、代表執行役 CEO:内藤 晴夫、以下エーザイ)は、新規抗がん剤開発を加速させる創薬研究システムの確立をめざし、国立研究開発法人日本医療研究開発機構(AMED)の医療研究開発革新基盤創成事業(CiCLE)の支援により、「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」を 2021 年より実施しています。
本研究において、国立がん研究センターとエーザイは、エーザイ創製の新薬候補E7820について、国立がん研究センター研究所(所長:間野 博行)が構築している日本人がん患者由来の腫瘍組織を免疫不全マウスに移植した動物モデルであるJ-PDXのライブラリーを用いて非臨床試験を行い、42のPDX注1モデル(膵がん12モデル、胆道がん12モデル、胃がん9モデル、子宮体がん9モデル)で薬効を評価しました。
その結果、E7820 100 mg/kg投与によって42モデル中16モデル(38.1%)、胆道がんでは12モデル中7モデル(58.3%)、子宮体がんでは9モデル中5モデル(55.6%)で、腫瘍の縮小が観察されました。PDXモデルは治療効果の予測精度が高く、臨床データとPDXモデルの反応性の間に高い類似性があることから、本研究の結果は胆道がんおよび子宮体がんにおいてE7820の腫瘍縮小効果を示唆しています。
さらに、E7820の腫瘍縮小効果と相関するバイオマーカー注2を探索するため、PDXモデルの全エクソンシークエンス注3を実施したところ、腫瘍縮小効果が認められたPDXモデルにおいては、BRCA1、BRCA2またはATMといった、DNA修復機構の一つである相同組換え修復(HRR)関連遺伝子注4の変異が高頻度に認められ、当該遺伝子変異がE7820の有効性のバイオマーカーとなる可能性が示唆されました。
本研究成果は、査読付き学術誌「npj Precision Oncology」に掲載されました。
これらの結果に基づき、国立がん研究センター中央病院(病院長:瀬戸 泰之)および東病院(病院長:土井 俊彦)は、固形がんに対するE7820の日本人における安全性および有効性を評価する第Ⅰ相医師主導治験注5(NCCH2303)を開始しました。本試験において、E7820の忍容性注6の確認および推奨用法・用量を決定した後、国立がん研究センターとエーザイは、特定のがん種やバイオマーカーを有する固形がんに対する有効性を確認する第Ⅱ相、さらには承認申請用試験の実施を検討し、薬事承認をめざしてまいります。また、本研究で構築したシステムを、新規抗がん剤開発を加速させる創薬研究システムとして確立をめざします。
背景
PDXモデルは、がん患者さんの腫瘍組織を免疫不全マウスに直接移植することによって作成するがんモデルの一つで、非臨床試験や研究に活用されています。PDXモデルは、元のがん患者さんの腫瘍の不均一性と遺伝子変異の多くを維持しており、従来用いられてきた細胞株や、細胞株をマウスに移植したモデルマウスと比較して、治療効果の予測精度が高く、臨床データとPDXモデルの反応性の間に高い類似性があることが報告されています。
国立がん研究センター研究所は、臨床情報を付帯した日本人がん患者由来のJ-PDXライブラリーを2020年に構築し、がん種横断的に651モデルのPDXを保有し(2024年7月3日時点)、創薬開発での活用が進んでいます。
エーザイは、がん領域を戦略的重要領域の一つとし、グローバルに承認を取得した微小管ダイナミクス阻害剤エリブリンメシル酸塩(製品名:ハラヴェン)とマルチキナーゼ阻害剤レンバチニブメシル酸塩(製品名:レンビマ)に関する経験を活かしながら、Deep Human Biology Learning創薬体制のもとで新たな標的や作用機序を有する革新的新薬を創出し、がんの治癒の実現に向けて貢献することをめざしています。
E7820は、選択的なタンパク質分解に関わるDCAF15とスプライシング因子RBM39を結合させる分子糊として作用し、RBM39を選択的に分解するスルホンアミド系抗がん剤です。本作用によってRNAスプライシング注7の異常が誘導され、がんの増殖を抑える効果が期待されます。海外ではE7820を用いた臨床試験の実績があります。
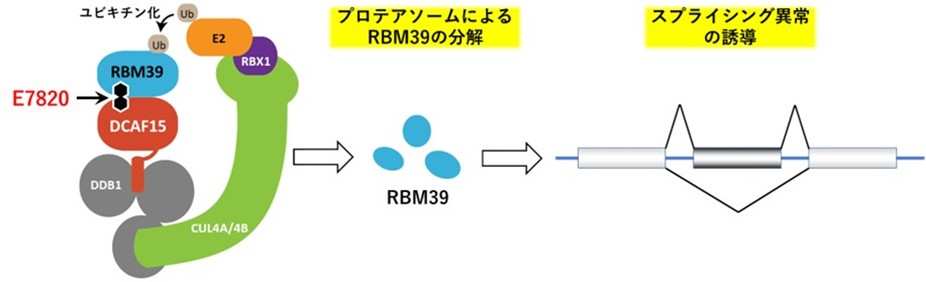
図1 E7820は、スプライシング因子RBM39をユビキチンリガーゼDCAF15と結合させます。ユビキチンリガーゼ複合体に取り込まれたRBM39はユビキチン化され、プロテアソームによって分解されます。RBM39の分解によってスプライシング異常が誘導され、抗腫瘍効果が発揮されます。
国立がん研究センターとエーザイは、「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」において、エーザイ創製の新薬候補品に対して、J-PDXを用いて臓器横断的に非臨床試験を行い、希少がんならびに難治性がんを対象に医師主導治験を実施し、臨床での有用性を確認するとともに、承認申請をめざしています(図2)。さらに、治療前後の腫瘍組織からPDXを樹立し、薬剤応答性ならびにがんゲノムの比較解析を行い、新規創薬ターゲットの探索と薬剤耐性機序の解明に取り組み、新たな創薬への展開について検討を進めています。これらの取り組みにより、新規抗がん剤開発を加速させる創薬研究システムの確立をめざしています。
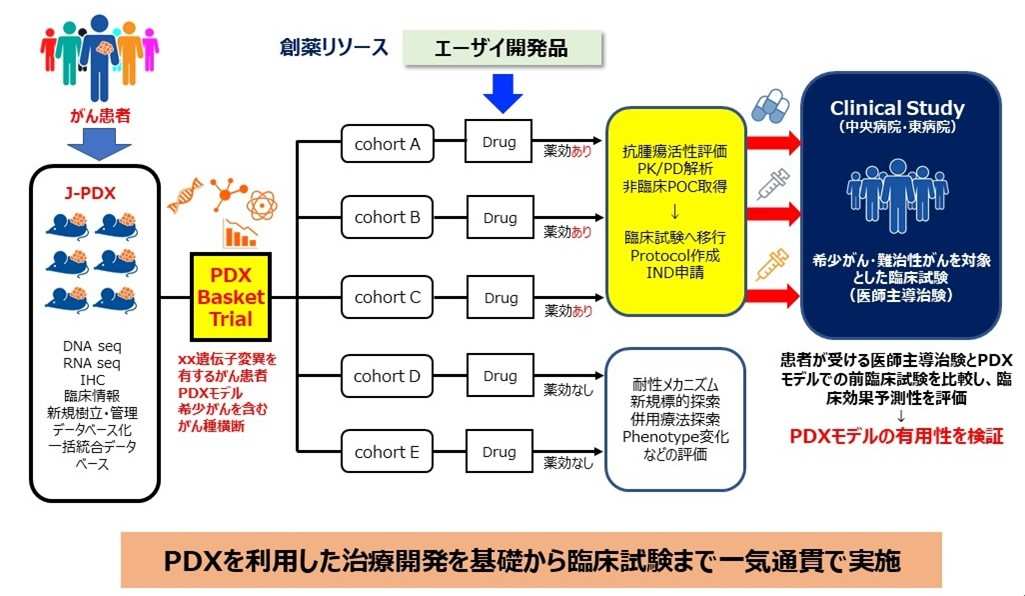
図2 国立がん研究センターとエーザイとの研究開発概要
* 2021年5月14日プレスリリース
国立研究開発法人国立がん研究センターとエーザイ株式会社が治療効果予測能が高いPDXとがんゲノム
データを用いた「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」を開始
研究成果
PDXマウスモデルを用いたE7820の薬効評価スクリーニング
42のPDXモデル(膵がん12モデル、胆道がん12モデル、胃がん9モデル、子宮体がん9モデル)に、E7820を100 mg/kgもしくは200 mg/kgを21日間連日経口投与し、スクリーニング評価を実施しました。
その結果、腫瘍の有意な縮小(薬剤投与した群における腫瘍体積の増加率<-30%)が観察されました(図3a)。全奏効率は、本剤100 mg/kg投与で38.1%(16例)、200 mg/kg投与で54.8%(23例)でした。100 mg/kg投与で最も奏効率が高かったのは胆道がん(58.3%)、次いで子宮体がん(55.6%)、胃がん(33.3%)でした。最も奏効率が低かったのは膵がんの8.3%で、がん種によって効果が異なることが分かりました(図3b)。
![big]() a
a![big]() b
b![big]() c
c図3 PDXマウスモデルを用いたE7820の薬効評価スクリーニングと全エクソン解析によりE7820の薬剤感受性を示すがん種やバイオマーカーが同定されました。
HRR関連遺伝子異常はE7820感受性のPDXで高頻度に観察される
E7820感受性に関連する分子マーカーを同定するために、全エクソンシークエンスおよび全トランスクリプトーム解析注8を実施しました。全エクソンシークエンスによる変異解析により、BRCA1、BRCA2またはATMといったHRR関連遺伝子の変異が薬の効果が認められたPDXにおいて高頻度に認められました(図3a)。変異のあるPDXと変異のないPDXのE7820感受性を比較すると、ATM変異は感受性群に有意に濃縮されており(p=4.5×10-3, FDR=0.14)、BRCA2変異も感受性群に濃縮されている傾向にありました(p=4.8×10-2, FDR=0.51)(図3c)。対照的に、TP53は非感受性群で有意に変異が認められましたが(p=5.9×10-3, FDR=0.14)、この濃縮は膵がんにおけるTP53の高変異陽性率に関連している可能性が考えられました。
E7820の長期投与は相同組換え修復欠損(homologous recombination deficiency: HRD)陽性細胞の増殖阻害をもたらす
最近の報告では、E7820がいくつかのHRR遺伝子のRNAスプライシングに影響を与えることが示されていましたが、HRR経路の機能喪失であるHRDがE7820の反応性を予測するバイオマーカーとなることは示されていませんでした。PDXモデルによるスクリーニングでは、HRD陽性腫瘍に顕著な腫瘍縮小が認められたことから、本化合物に長期的に曝露されると、増殖抑制が生じるのではないかと予想しました。そこで、BRCA2をノックアウトした大腸がん細胞株(DLD1-BRCA2-KO)またはノックアウトしていない親株(DLD1-P)を短期培養(3日間)または長期培養(12日間)して薬効を評価しました。 DLD1-BRCA2-KO細胞は、DLD1-P細胞に比べ、12日目のE7820に対して高い感受性を示しました(図4a)。
DNA損傷応答に関与する他の遺伝子がE7820に対する感受性に影響を及ぼすかどうかをさらに調べるため、DLD1-P細胞においてATM、ATRまたはBAP1遺伝子をノックアウトし、次いで薬物投与したとこころ、DLD1-P細胞はE7820に感受性を示すようになることが明らかになりました(図4b)。
![big]() 図4 (a)(b) HRD陽性細胞に対して、E7820の長期投与は増殖阻害をもたらします。(c) BRCA2の機能不全がある細胞ではE7820によるDNA二本鎖切断が増加します。
図4 (a)(b) HRD陽性細胞に対して、E7820の長期投与は増殖阻害をもたらします。(c) BRCA2の機能不全がある細胞ではE7820によるDNA二本鎖切断が増加します。BRCA2の機能不全はE7820によるDNA二本鎖切断を増加させる
DLD1-BRCA2-KOはE7820に感受性を示したことから、E7820の曝露はDNA損傷を引き起こす可能性があると考えました。DNA二本鎖切断のマーカーであるγH2AXの発現を、E7820またはPARP阻害剤注9であるオラパリブで72時間培養した細胞で評価したところ、E7820(1μM)投与はオラパリブ(1μM)投与よりも多くのγH2AXの出現を誘導しました(図4c)。
E7820投与に関連するトランスクリプトームの変化
E7820がどのようにDNA二本鎖切断を誘導するかを明らかにするために、全トランスクリプトーム解析を行い、6つのがん細胞株でE7820処理により共通して発現上昇または発現低下する遺伝子を評価しました。その結果、1,655個の発現上昇遺伝子(fold change >1.1)と2,787個の発現低下遺伝子(fold change <0.9)が3つ以上の細胞株で観察されました。発現低下した遺伝子に濃縮していた細胞内パスウェイには、「ヌクレオチド除去修復」、「遺伝性乳がん関連シグナル」、「DNA損傷反応におけるBRCA1関連」といったDNA損傷修復に関連するシグナル伝達経路が含まれていました(図5a)。これらの経路に関連する遺伝子として、PALB2、BRIP1、BRCA1、RAD50、MRE11、ATR、FANCファミリー遺伝子などのHRR関連遺伝子ならびに、XPCやERCC2のようなヌクレオチド除去修復(NER)に必須な遺伝子も含まれていました。次に、E7820によって誘導されるスプライシング異常を調べたところ、DLD1-PとDLD1-BRCA2-KOの両方において、イントロンの保持が薬剤投与で最も増加したスプライシング異常であり、最も減少したスプライシング異常はシングルエクソンスキッピングでした(図5b)。また、薬剤投与により発現低下したDNA修復に関連する41遺伝子のうち25遺伝子(61%)に、イントロンの保持が誘導されていました(図5c)。
![big]()
図5 E7820投与に関連するトランスクリプトームの変化を解析すると、DNA損傷修復に関連するシグナル伝達経路に関わる遺伝子の発現低下やイントロン保持の誘導がみられました。
mRNAのミスプライシングは、対応する成熟タンパク質の翻訳に重大な影響を与えます。そこで、DLD1-BRCA2-KO細胞におけるFANCD2とFANCAのタンパク質レベルを測定しました(図5d)。E7820投与により、FANCD2およびFANCAタンパク質のレベルは、時間依存的に顕著に低下しました。重要なことに、FANCD2/FANCAタンパク質レベルの減少は、γH2AXの蓄積とカスパーゼ-3の切断(細胞のアポトーシスの特徴)と一致していました。
PDX(patient-derived xenograft)モデルを用いた創薬利用について
これまでの抗がん剤開発での課題の一つには、治療効果予測に用いる細胞株による実験モデルでの予測能が低いことが挙げられます。一方でPDXは、がん患者さんのがん組織を免疫不全マウスに移植し腫瘍を再現する動物モデルで、がん組織の特徴を保持できるため、高い再現率を有するとの報告があり、創薬利用が急速に進んでいます。国立がん研究センターでは、子宮がん肉腫患者さんから作製したPDXモデルでの抗HER2療法の効果予測と臨床で有効性が一致していることを確認しています。*
国立がん研究センターが構築した日本人がん患者由来の大規模PDXライブラリー「J-PDX」は、1. 臓器横断的にPDXを樹立し、メジャーながんに加え、希少がん(骨肉腫・横紋筋肉腫など)、アジアに多いがんにも注力したこと、2. 手術検体だけでなく薬剤耐性期の検体からもPDXを樹立したこと、3. 治療歴を含む詳細な臨床情報を付帯したPDXであることが特徴で、新規抗がん剤開発での活用促進、開発の加速が期待されます。
* 2023年4月10日プレスリリース
子宮がん肉腫でトラスツズマブ デルクステカンによる抗HER2療法の有効性を確認 PDXモデルでの効果予測とも一致し希少がんの治療開発への道を開く
発表論文
雑誌名: npj Precision Oncology
タイトル: A molecular glue RBM39-degrader induces synthetic lethality in cancer cells with homologous recombination repair deficiency
著者: Shinji Kohsaka, Shigehiro Yagishita, Yukina Shirai, Yusuke Matsuno, Toshihide Ueno, Shinya Kojima, Hiroshi Ikeuchi, Masachika Ikegami, Rina Kitada, Ken-ichi Yoshioka, Kohta Toshimitsu, Kimiyo Tabata, Akira Yokoi, Toshihiko Doi, Noboru Yamamoto, Takashi Owa, Akinobu Hamada, Hiroyuki Mano
| 国立がん研究センター |
| 研究所 | 細胞情報学分野 | 分野長 | 高阪 真路 |
| 研究所 | 細胞情報学分野 | ユニット長 | 上野 敏秀 |
| 研究所 | 細胞情報学分野 | 主任研究員 | 池上 政周 |
| 研究所 | 細胞情報学分野 | 任意研修生 | 白井 由紀奈 |
| 研究所 | 細胞情報学分野 | 任意研修生 | 小島 進也 |
| 研究所 | 細胞情報学分野 | 任意研修生 | 来田 里奈 |
| 研究所 | 分子薬理研究分野 | 分野長 | 濱田 哲暢 |
| 研究所 | 分子薬理研究分野 | ユニット長 | 柳下 薫寛 |
| 研究所 | ゲノム安定性制御研究ユニット | ユニット長 | 吉岡 研一 |
| 研究所 | ゲノム安定性制御研究ユニット | 学振研究員 | 松野 悠介 |
| 研究所 | ゲノム安定性制御研究ユニット | 外来研究員 | 松尾 理加 |
| 研究所 | | 所長 | 間野 博行 |
| 中央病院 | 先端医療科 | 科長 | 山本 昇 |
| 東病院 | 先端医療科 | 科長 | 土井 俊彦 |
| エーザイ株式会社 |
| DHBL Cell Lineage & Differentiationドメイン | 研究員 | 利光 孝太 |
| DHBL Cell Lineage & Differentiationドメイン | 研究員 | 田端 君代 |
| DHBL Cell Lineage & Differentiationドメイン | ヘッド | 横井 晃 |
| チーフサイエンティフィックオフィサー | 常務執行役 | 大和 隆志 |
DOI: 10.1038/s41698-024-00610-0
掲載日: 2024年5月24日
URL: (外部サイトにリンクします)
固形がんに対するE7820の日本人における安全性および有効性を評価する国内医師主導第I相治験について
本試験は、用量確認パートにおいて標準治療に不応または不耐の固形がん患者さんを対象にE7820の日本人における忍容性、薬物動態などを確認します。引き続き、拡大パートにおいて、胆道がん、子宮体がん、相同組換え修復遺伝子変異を有する固形がん患者さんを対象に用量確認パートで忍容性が確認された用法・用量で探索的にE7820の有効性と安全性評価を実施します。エーザイから治験薬の提供を受けて実施します。海外においては、E7820を用いた臨床試験の実施成績があり、1日1回連日経口投与における最大耐量(MTD)は100 mgとされています。
試験名
固形がんに対するE7820の日本人における安全性および有効性を評価する国内医師主導第I相治験
(治験実施計画書番号:NCCH2303、試験略称:CIRCUS)
使用される新薬(治験薬)
E7820(経口薬:スルホンアミド系スプライシング制御薬)
治験に参加いただける患者さんの身体状況(患者選択基準)
1. 文書による同意が得られる
2. 固形がんであり、切除不能な進行・再発と診断されている
3. 標準治療がない、または標準治療に不応もしくは不耐であると診断されている
4. 治験への登録時において、年齢が18歳以上
5. 各臓器機能が規定内に保たれている
注:上記の患者選択基準は概要であり、上記に該当していてもこの治験に参加できないことがありますので、ご了承ください。
研究代表者
山本 昇 (国立がん研究センター中央病院 先端医療科 科長)
医師主導治験(CIRCUS試験)参加施設一覧
国立がん研究センター中央病院(東京都中央区築地5-1-1)
国立がん研究センター東病院(千葉県柏市柏の葉6-5-1)
臨床研究実施計画・研究概要公開システム
jRCT番号:jRCT2031240210
本治験の詳細は、臨床研究実施計画・研究概要公開システムよりご確認ください。
(外部サイトにリンクします)
研究費
本試験は下記事業の支援を受けて行われます。
日本医療研究開発機構 医療研究開発革新基盤創成事業(CiCLE)(JP20pc0101051)
今後の展望
企業での創薬開発に国立がん研究センターのJ-PDXライブラリーを用いることで、新規薬剤候補に対する薬効評価と有効性予測バイオマーカーの同定、さらには臨床試験の立ち上げまでを速やかに実現することが可能となりました。本試験において、E7820の忍容性を含む安全性の確認および推奨用量を決定した後、国立がん研究センターとエーザイは、特定のがん種やバイオマーカーを有する固形がんに対する有効性を確認する第Ⅱ相さらには承認申請用試験の実施を検討し、薬事承認をめざしてまいります。
また、本研究で構築したシステムを、新規抗がん剤開発を加速させる創薬研究システムとして確立をめざします。
用語解説
注1 PDX(patient-derived xenograft):マウスモデル
がん患者さんの腫瘍組織を免疫不全マウスに直接移植することによって作成する、がんモデルの一つです。
注2 バイオマーカー
タンパク質や遺伝子などの分子で、病気の存在や、治療法選択などの指標となるものです。
注3 全エクソンシークエンス
ヒトゲノムのうちタンパク質をコードするエクソン領域を選択的に濃縮し、効率的に解析する手法です。
注4 相同組換え修復(homologous recombination repair)
DNA二本鎖切断修復における主要な機構の一つであり、姉妹染色分体を鋳型にして修復を行います。
注5 医師主導治験
新しい薬が承認され、保険で使えるようになるためには新薬の臨床開発(治験)が必要です。有望な医薬品でありながら、企業主導では治験が実施されない医薬品について、製薬企業の協力を得て、医師自らが治験を行うことを医師主導治験といいます。
注6 忍容性
忍容性とは治験薬が投与された場合に生じる副作用が、人において許容される程度か否かを表す言葉です。具体的には治験薬を人に投与した場合に、許容し難いと考えられる副作用の発症頻度やその重症度などを参考に検討されます。
注7 RNAスプライシング
RNAスプライシングは、mRNA前駆体からイントロンを除去して成熟mRNAを産生する、遺伝子発現に必須の機構です。
注8 全トランスクリプトーム解析
細胞中に存在する全ての遺伝子転写産物(トランスクリプトーム)の配列・発現量を解析する手法です。
注9 PARP阻害剤
DNA修復など細胞内で重要な役割を果たす酵素のポリアデノシン5'二リン酸リボースポリメラーゼ(PARP:poly ADP-ribose polymerase)を阻害することで、相同組換え修復遺伝子に変異を有する腫瘍細胞で合成致死を誘導します。
お問い合わせ先
● 非臨床試験に関するお問い合わせ
国立研究開発法人国立がん研究センター
研究所 細胞情報学分野
高阪 真路(こうさか しんじ)
電話番号: 03-3542-2511(代表)
Eメール: skohsaka@ncc.go.jp
● 医師主導治験に関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 国際研究支援室
電話番号: 03-3547-5201(内線2686)
Eメール: ncch2303_office@ml.res.ncc.go.jp
● 広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号: 03-3542-2511(代表)
Eメール: ncc-admin@ncc.go.jp
エーザイ株式会社
PR 部
電話番号: 03-3817-5120
國立癌症研究中心是國家研究開發法人。
樂金製藥股份有限公司
發佈積分
- 通過將患者來源的癌組織移植到免疫缺陷小鼠上,對目標蛋白質降解誘導劑E7820在多種癌症類型中進行藥效評估,觀察到整體瘤體縮小率爲38.1%,膽道癌爲58.3%,子宮體癌爲55.6%。
- PDX模型具有高度預測治療效果的準確性,並且臨床數據與PDX模型的反應性之間具有高度的相似性。因此,該研究結果暗示了E7820在膽道癌和子宮體癌中的腫瘤縮小效果。
- 通過對PDX模型的全外顯子測序,確定了可以作爲E7820有效性預測生物標記的基因突變。
- 本研究成果已發表在同行評審的學術期刊《npj Precision Oncology》上。
- 基於揭示的 E7820 在特定癌症類型及生物標誌物上的有效性,國立腫瘤研究中心中央醫院和東方醫院將開始醫生主導的臨床試驗,旨在評估其包括耐受性在內的安全性以及探索性有效性評估。
- 通過利用國立腫瘤研究中心的 J-PDX(日本人癌症患者來源的移植組織模型)庫,可以快速實現對每種癌症的藥效評估和有效性預測生物標誌物的確定,甚至啓動臨床試驗。我們將繼續積累此類案例,以加速新型抗癌藥物的開發,實現作爲藥物研究系統的確立。
 概要
概要
國立癌症研究中心(位於東京中央區,理事長:齋釜斉)與艾茲賽公司(總部:東京文京區,首席執行官:內藤晴夫),在日本醫療研究開發機構(AMED)的醫療研究開發革新基盤創生事業(CiCLE)的支持下,從2021年開始開展「加速罕見和難治性癌症的抗癌治療藥物開發的藥物研究方法」的研究。
在本研究中,國立癌症研究中心和艾茲賽公司使用國立癌症研究中心研究所(所長:間野博行)構建的J-PDX庫,藉助日本人癌症患者來源的腫瘤組織移植到免疫缺陷小鼠中的動物模型,進行了42個PDX模型的非臨床試驗(注1)。
結果顯示,E7820以100 mg/kg的劑量給藥在42個模型中觀察到16個模型(38.1%)中腫瘤縮小,膽道癌的7個模型中有5個模型(58.3%)縮小,子宮體癌的9個模型中有5個模型(55.6%)縮小。PDX模型具有很高的治療效果預測準確性,並且與臨床數據有高度一致性,因此本研究的結果暗示了E7820對膽道癌和子宮體癌的腫瘤縮小效果。
此外,爲了尋找與E7820的腫瘤縮小效果相關的生物標誌物(注2),對PDX模型進行了全外顯子測序(注3)。結果發現,在觀察到腫瘤縮小效果的PDX模型中,高頻率發現了相同重組修復(HRR)相關基因(注4)如BRCA1、BRCA2或ATM的突變,暗示這些基因突變可能是E7820有效性的生物標誌物。
本研究成果已發表在經過同行評議的學術期刊「npj Precision Oncology」。
基於這些結果,國立癌症研究中心中央醫院(院長:瀬戸泰之)和東日本醫院(院長:土井俊彥)已開始評估E7820在日本人固體腫瘤中的安全性和有效性的第Ⅰ相醫生主導治療實驗注5(NCCH2303)。在這項研究中,等確認了E7820的耐受性注6並確定了推薦的用法和劑量後,國立癌症研究中心和艾茲賽將考慮進行第Ⅱ相研究以確認對特定癌症類型或具有生物標誌物的固體腫瘤的有效性,進而考慮進行申請批准的試驗,以爭取藥物批准。此外,我們將努力確立該研究所建立的系統作爲加速新抗癌劑開發的創藥研究系統。
背景
PDX模型是一種將癌症患者的腫瘤組織直接移植到免疫缺陷小鼠中從而創建的癌症模型,已廣泛用於非臨床試驗和研究中。與傳統的細胞系或細胞系移植到小鼠模型相比,PDX模型保留了原始腫瘤的不均勻性和大部分基因突變,且其治療效果預測準確性較高,與臨床數據和PDX模型的響應性之間存在高度相似性。
國立癌症研究中心研究所於2020年建立了帶有日本癌症患者臨床信息的J-PDX庫,目前擁有651個模型的PDX(截至2024年7月3日),正在推進在藥物發現中的應用。
艾茲賽將癌症領域視爲戰略重要領域之一,並結合已在全球獲得批准的微管動力學抑制劑爾必利(商品名:Halaven)和多激酶抑制劑雷帕替尼(商品名:Lenvima)的經驗,在Deep Human Biology Learning創藥體系下,創造具有新靶點和作用機制的創新新藥,爲實現癌症治癒做出貢獻。
E7820作爲一種與選擇性蛋白降解相關的DCAF15和剪接因子RBM39結合的分子粘合劑,在選擇性降解RBM39的亞硫酰胺類抗癌藥物中發揮作用。這種作用會誘導RNA剪接注7的異常,並有望抑制癌症的增殖。E7820在海外已經進行了臨床試驗。

圖1 E7820將剪接因子RBM39與泛素連接酶DCAF15結合在一起。被泛素連接酶複合體招募的RBM39會被泛素化並通過蛋白酶體降解。RBM39的降解導致剪接異常,併發揮抗腫瘤效果。
國立腫瘤研究中心與艾澤藥業在"加速罕見癌症和難治性癌症的抗癌劑治療開發的創藥研究方法"中,使用J-PDX在非臨床試驗中進行器官間的跨越性研究,以對艾澤藥業的新候選藥物進行檢測,並進行醫生主導的臨床試驗,以確認其在罕見癌症和難治性癌症中的臨床有效性,並尋求批准(見圖2)。此外,還建立PDX模型,從治療前後的腫瘤組織中提取,並進行藥物反應性以及癌症基因組的比較分析,以探索新的藥物靶點並闡明藥物耐藥機制,推動新創藥的開發。通過這些工作,旨在建立加速抗癌劑開發的創藥研究系統。

圖2 國立腫瘤研究中心與艾澤藥業的研究開發概要
* 2021年5月14日新聞發佈
國立研究開發法人國立腫瘤研究中心與艾澤藥業株式會社利用具有高治療效果預測能力的PDX和癌症基因組數據,開展"加速罕見癌症和難治性癌症的抗癌劑治療開發的創藥研究方法"
根據研究成果,國立研究開發法人國立腫瘤研究中心與艾澤藥業株式會社啓動了"加速罕見癌症和難治性癌症的抗癌劑治療開發的創藥研究方法"
研究成果
使用PDX小鼠模型進行E7820藥效評價篩選
對42個PDX模型(胰腺癌12個模型、膽管癌12個模型、胃癌9個模型、子宮體癌9個模型),連續21天口服給予E7820 100毫克/公斤或200毫克/公斤,並進行篩選評估。
結果顯示,觀察到腫瘤顯著縮小(藥物給予組腫瘤體積增加率<-30%)(見圖3a)。全身有效率爲,該藥物100毫克/公斤給予時爲38.1%(16例),200毫克/公斤給予時爲54.8%(23例)。100毫克/公斤給予時膽管癌的全身有效率最高(58.3%),其次是子宮體癌(55.6%),胃癌(33.3%)。而最低的是胰腺癌的8.3%,顯示了不同癌種效果不同(見圖3b)。
![大]() a
a![大]() b
b![大]() c
c通過使用PDX小鼠模型評估E7820的藥力篩選和全外顯子分析,鑑定了E7820敏感性的腫瘤類型和生物標誌物。
HRR相關基因異常在E7820敏感性的PDX中經常觀察到。
爲了鑑定與E7820敏感性相關的分子標記,我們進行了全外顯子測序和全轉錄組分析注8。突變分析通過全外顯子測序發現,在對藥物效果得到確認的PDX中,HRR相關基因BRCA1、BRCA2或者ATM的突變經常觀察到(圖3a)。與沒有突變的PDX比較E7820敏感性,發現ATM突變顯著富集在敏感性組中(p=4.5×10-3, FDR=0.14),BRCA2突變也有富集的趨勢(p=4.8×10-2, FDR=0.51)(圖3c)。相比之下,在非敏感性組中,TP53突變被發現有顯著關聯(p=5.9×10-3, FDR=0.14),這種富集可能與胰腺癌中TP53的高變異陽性率有關。
長期投與E7820可以抑制同源重組修復缺陷(homologous recombination deficiency: HRD)陽性細胞的增殖。
最近的報道表明,E7820會影響一些HRR基因的RNA剪接,但尚未發現HRD作爲HRR通路功能喪失的生物標誌物,可以預測E7820的反應性。通過PDX模型篩選,發現HRD陽性腫瘤明顯縮小,因此我們預測長期暴露於該化合物會導致抑制增殖。因此,我們對去除BRCA2基因的結腸癌細胞系(DLD1-BRCA2-KO)和未去除基因的親代細胞系(DLD1-P)進行了短期培養(3天)和長期培養(12天),以評估藥物效果(圖4a)。DLD1-BRCA2-KO細胞在12天的E7820處理中表現出較高的敏感性,與DLD1-P細胞相比(圖4a)。
爲了進一步研究其他與DNA損傷應答相關的基因是否影響對E7820的敏感性,我們去除了DLD1-P細胞中的ATM、ATR或者BAP1基因,然後進行藥物處理,結果表明DLD1-P細胞表現出對E7820的敏感性(圖4b)。
![大]() 對於圖4(a)(b)HRD陽性細胞,長期使用E7820會導致增殖受阻。(c)BRCA2功能異常的細胞中,E7820會增加DNA雙鏈斷裂。
對於圖4(a)(b)HRD陽性細胞,長期使用E7820會導致增殖受阻。(c)BRCA2功能異常的細胞中,E7820會增加DNA雙鏈斷裂。BRCA2功能異常會導致E7820誘導DNA雙鏈斷裂增加。
由於DLD1-BRCA2-KO對E7820表現出敏感性,因此推測E7820的暴露可能引起DNA損傷。通過對暴露於E7820(1μM)或是PARP抑制劑奧拉帕尼(1μM)的細胞進行72小時培養,並評估γH2AX標記物的表達,結果顯示,E7820處理誘導了比奧拉帕尼更多的γH2AX出現(見圖4c)。
與E7820治療相關的轉錄組變化。
爲了闡明E7820是如何誘導DNA雙鏈斷裂的,我們進行了全轉錄組分析,評估了在6種癌細胞株中經E7820處理後共同上調或下調的基因。結果顯示,在3種以上的細胞株中觀察到了1,655個上調基因(倍數變化 >1.1)和2,787個下調基因(倍數變化 <0.9)。在下調的基因中,濃縮了與細胞內通路相關的DNA損傷修復信號傳導途徑,包括「核苷酸切除修復」、「遺傳性乳腺癌相關信號」和「BRCA1相關的DNA損傷反應」(見圖5a)。這些與通路相關的基因包括PALB2、BRIP1、BRCA1、RAD50、MRE11、ATR、FANC家族基因等與HRR相關的基因,以及XPC和ERCC2等核苷酸切除修復(NER)所必需的基因。接着,我們研究了E7820誘導的錯誤剪接,結果顯示,在DLD1-P和DLD1-BRCA2-KO中,各種藥物處理中最大程度增加的是內含子保留的剪接異常,而最大程度減少的則是單外顯子剪接異常(見圖5b)。此外,在薬劑處理後,下調錶達的與DNA修復相關的41個基因中有25個基因(61%)誘導了內含子保留(見圖5c)。
![大]()
通過分析與E7820治療相關的轉錄組變化,觀察到與DNA損傷修復相關的信號傳導途徑的基因下調和內含子保留的誘導。
mRNA的錯誤剪接會嚴重影響相應成熟蛋白的翻譯。因此,我們測定了DLD1-BRCA2-KO細胞中FANCD2和FANCA的蛋白水平(見圖5d)。E7820處理導致FANCD2和FANCA蛋白水平顯著隨時間下降。值得注意的是,FANCD2/FANCA蛋白水平的降低與γH2AX的積累和Caspase-3的裂解(細胞凋亡的特徵)相一致。
關於使用PDX(患者來源的異種移植)模型進行藥物開發利用
過去抗癌藥物開發的一個問題是,使用細胞株進行實驗模型的預測能力較低。而PDX是一種將患者的腫瘤組織移植到免疫缺陷小鼠體內重現腫瘤的動物模型,能夠保持腫瘤組織的特徵,具有較高的再現率,因此藥物開發利用正在迅速發展。國立癌症研究中心確認,使用從子宮癌肉瘤患者中製作的PDX模型預測抗HER2治療的效果與臨床有效性一致。
國立癌症研究中心構建的日本人癌症患者來源的大規模PDX庫「J-PDX」具有以下特點:1. 跨器官建立PDX,在主要腫瘤之外,還注重罕見腫瘤(如骨肉瘤、橫紋肌肉瘤等)和亞洲常見腫瘤;2. 建立PDX不僅來自手術標本,還來自藥物耐藥期的標本;3. 是附帶詳細的臨床信息,包括治療歷史的PDX。因此,它有望促進新型抗癌藥物的開發利用,加快開發進程。
* 2023年4月10日新聞稿
確認子宮癌肉瘤中特羅瑞珠單抗和德魯卡替坦的抗HER2療法的有效性,與PDX模型的效果預測一致,爲罕見癌症的治療開發開闢了道路
發表論文
雜誌名:npj Precision Oncology
標題:一種分子粘合物RBM39降解劑在具有同源重組修復缺陷的癌細胞中誘導合成致死效應
作者:Shinji Kohsaka,Shigehiro Yagishita,Yukina Shirai,Yusuke Matsuno,Toshihide Ueno,Shinya Kojima,Hiroshi Ikeuchi,Masachika Ikegami,Rina Kitada,Ken-ichi Yoshioka,Kohta Toshimitsu,Kimiyo Tabata,Akira Yokoi,Toshihiko Doi,Noboru Yamamoto,Takashi Owa,Akinobu Hamada,Hiroyuki Mano
| 國立癌症研究中心 |
| 研究所 | 細胞信息學領域 | 分野負責人 | 高阪真路 |
| 研究所 | 細胞信息學領域 | 部門長 | 上野 敏秀 |
| 研究所 | 細胞信息學領域 | 主任研究員 | 池上 政周 |
| 研究所 | 細胞信息學領域 | 任意培訓生 | 白井由紀奈 |
| 研究所 | 細胞信息學領域 | 任意培訓生 | 小島進也 |
| 研究所 | 細胞信息學領域 | 任意研修生 | 來田裏奈 |
| 研究所 | 分子藥理研究領域 | 領域負責人 | 浜田哲暢 |
| 研究所 | 分子藥理研究領域 | 單位經理 | 柳下薰寬 |
| 研究所 | 基因穩定性控制研究單位 | 單位經理 | 吉岡研一 |
| 研究所 | 基因穩定性控制研究單位 | 學振研究員 | 松野 悠介 |
| 研究所 | 基因組穩定性控制研究單元 | 外來研究員 | 松尾 理加 |
| 研究所 | | 所長 | 間野博行 |
| 中央醫院 | 先端醫療科 | 科長 | 山本昇 |
| 東醫院 | 先端醫療科 | 科長 | 土井 俊彥 |
| 樂金製藥股份有限公司 |
| DHBL Cell Lineage & Differentiation領域 | 研究員 | 利光 孝太 |
| DHBL Cell Lineage & Differentiation領域 | 研究員 | 田端 君代 |
| DHBL細胞譜系和分化領域 | 頭 | 橫井晃 |
| 首席科學官 | 常務執行官 | 大和隆志 |
DOI: 10.1038/s41698-024-00610-0
發佈日期: 2024年5月24日
URL鏈接:(打開外部網站)
關於評估E7820在日本人中對實體腫瘤的安全性和有效性的國內醫生主導的I期臨床試驗
本試驗將對日本人實體腫瘤患者,在劑量確認階段,確認E7820在無法耐受或不耐受標準治療的患者中的耐受性、藥物動力學等。隨後,在擴大階段,將以確認了劑量確認階段中的耐受性的用法和用量,探索性地評估E7820的有效性和安全性,針對膽道癌、子宮體癌、具有同源重組修復基因突變的實體腫瘤患者。該試驗將由艾爾澤提供藥物支持。在海外,已有使用E7820進行臨床試驗的數據,最大耐受劑量(MTD)在每日連續口服100毫克。
試驗名稱
關於評估E7820在日本人中對實體腫瘤的安全性和有效性的國內醫生主導的I期臨床試驗
(治験実施計畫書番號:NCCH2303、試験略稱:CIRCUS)
使用的新藥(試驗藥)
E7820(口服藥:磺胺基製片劑)
可以參加臨床試驗的患者的身體狀況(患者選擇標準)
1. 可以獲得書面同意
2. 被診斷爲晚期/復發的無法切除的實體瘤
3. 被診斷爲無標準治療或不耐受標準治療
4. 在登記時年滿18歲
5. 各器官功能保持在規定範圍內
注:上述患者選擇標準僅爲概述,即使符合上述條件,也可能無法參加本臨床試驗,請諒解。
研究負責人
山本昇(國家癌症研究中心中央醫院先進醫療科科長)
醫生主導的臨床試驗(CIRCUS試驗)參與機構列表
國家癌症研究中心中央醫院(東京都中央區築地5-1-1)
國立癌症研究中心東醫院(千葉縣柏市柏之葉6-5-1)
臨床研究實施計劃和研究概要公開系統
jRCT編號:jRCT2031240210
請通過臨床研究實施計劃和研究概要公開系統詳細了解本試驗內容
(將鏈接至外部網站)
研究費
本試驗得到了以下業務的支持。
日本醫療研究開發機構醫療研究開發革新基礎創造事業(CiCLE)(JP20pc0101051)
展望未來
通過使用國立癌症研究中心的J-PDX圖書館進行企業的新藥開發,我們能夠迅速實現對新藥候選的藥效評估和有效性預測生物標記的鑑定,甚至啓動臨床試驗。在本試驗中,一旦確認了E7820的耐受性和安全性,並確定了推薦劑量,國立癌症研究中心和艾茲捷將考慮對具有特定腫瘤類型或生物標記的實體腫瘤驗證其有效性,包括進行第二期甚至批准申請試驗,並致力於藥品註冊。
此外,我們旨在將在本研究中建立的系統作爲加快新抗癌藥物開發的創藥研究系統確立起來。
術語解釋
注1:PDX(患者衍生異種移植):小鼠模型
通過將腫瘤組織直接移植到免疫缺陷的小鼠中來創建的一種腫瘤模型。
注2 生物標誌物
蛋白質和基因等分子,用於指示疾病的存在和治療選擇等指標。
注3 全外顯子測序
選擇性地濃縮編碼蛋白質的外顯子區域,以便高效地進行分析的方法。
注4 同源重組修復(homologous recombination repair)
DNA雙鏈斷裂修復的一種主要機制,利用姐妹染色分體作爲模板進行修復。
注5 醫生主導的臨床試驗
新藥獲得批准並可在保險中使用,需要進行新藥臨床開發(臨床試驗)。對於有希望的藥物,如果企業主導的臨床試驗無法進行,製藥公司將協助並進行醫師主導的試驗。
注6 忍受性
忍受性是指用於臨床試驗藥物的副作用在人體內是否可以被接受的程度。具體來說,參考治療藥物在人體內的給藥後,可能被認爲難以接受的副作用發生頻率及其嚴重程度等進行評估。
注7 RNA剪接
RNA剪接是從mRNA前體中去除內含子以產生成熟mRNA的基因表達機制,是必不可少的。
注8 全轉錄組分析
全轉錄組分析是分析細胞中存在的所有基因轉錄產物(轉錄組)的序列和表達量的方法。
注9 PARP抑制劑
通過抑制在細胞內發揮重要作用的酵素聚腺苷5'二磷酸核糖聚合酶(PARP:聚腺苷二磷酸核糖聚合酶),誘導具有同源重組修復基因突變的腫瘤細胞產生合成致死作用。
聯繫方式
● 非臨床試驗相關諮詢
國立癌症研究中心
研究所 細胞信息學領域
高阪 真路(高坂 真路)
電話號碼:03-3542-2511(代表)
電子郵件:skohsaka@ncc.go.jp
● 關於醫生主導的臨床試驗的諮詢
國立癌症研究中心
中央醫院臨床研究支持科研計劃推進部國際研究支持室
電話號碼:03-3547-5201(分機2686)
電子郵件:ncch2303_office@ml.res.ncc.go.jp
● 宣傳聯繫處
國立癌症研究中心
計劃戰略局宣傳企劃室
電話號碼:03-3542-2511(總機)
電子郵件:ncc-admin@ncc.go.jp
樂金製藥股份有限公司
公關部
電話號碼:03-3817-5120
 概要
概要







