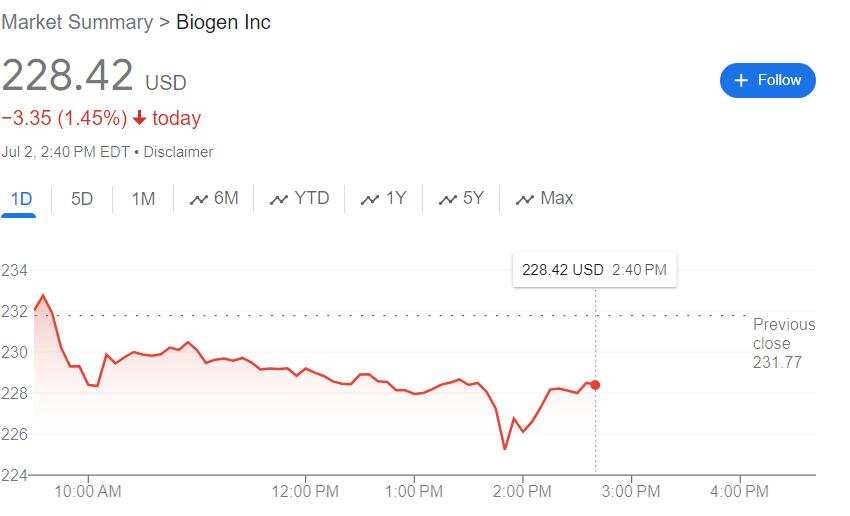
美國FDA批准爲禮來以Kisunla爲商品名donanemab在美國出售該藥掃清障礙,它將成爲在美上市第二種的減緩腦萎縮疾病藥物。其美國競品Leqembi的開發商渤健盤中一度跌近3%。
美國醫藥巨頭禮來治療阿爾茲海默症的新藥掃清了在美上市的障礙,股價盤中大幅收窄跌幅。
美東時間7月2日週二美股午盤,早盤刷新日低時跌逾3.9%的禮來(Eli Lilly & Co.)加速反彈,日內跌幅收窄到1%以內,一度僅跌0.26%。
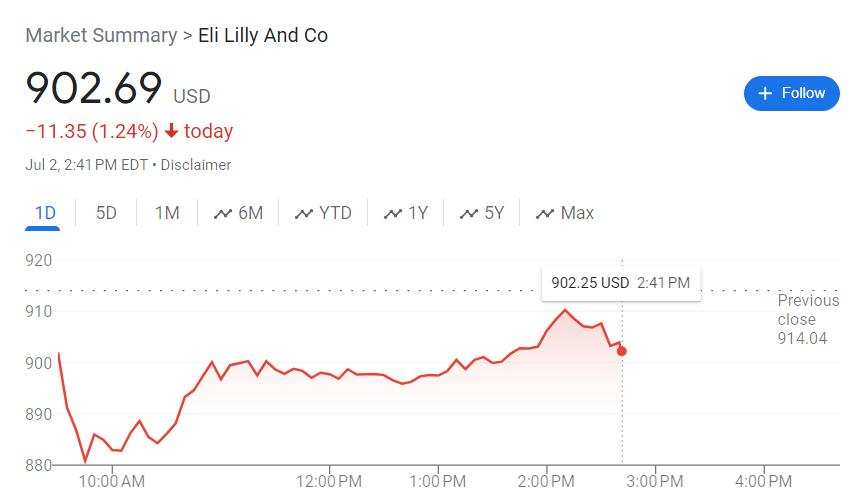
週二午盤時段,美國監管機構食藥監局(FDA)正式批准禮來的新藥donanemab用於治療早期阿爾茨海默症(AD)的成年患者。獲批意味着,禮來能以Kisunla爲商品名donanemab在美國出售這款新藥,它將成爲在美上市的第二種獲批治療減緩腦萎縮疾病藥物。
本次FDA批准基於一項大規模的三期雙盲安慰劑對照試驗。試驗收錄了1736 名早期 AD 患者,他們每四周接受一次 donanemab、即Kisunla注射或安慰劑治療,最長治療時間72周。試驗主要結果是綜合AD評分量表 (iADRS) 評分的最小二乘均值 (LSM) 變化,分數越低表示損害越嚴重。在低/中相關病理蛋白tau 人群中,到76 周時,接受Kisunla治療者的iADRS 評分相對於基線的 LSM 變化爲 -6.02,在安慰劑組中則爲-9.27。
Kisunla是一種每四周注射一次、一次劑量350 mg/20 mL 的單克隆抗體靜脈注射劑,適用於有輕度認知障礙 (MCI) 患者以及進入輕度癡呆階段、已確認腦中存在病理分子澱粉樣蛋白的AD患者。禮來對Kisunla定價爲每瓶 695.65 美元,12個月的治療費用爲3.2萬美元。
有業內媒體指出,Kisunla全球首個也是唯一一個有證據支持當大腦中澱粉樣斑塊被清除時停止治療的澱粉樣蛋白靶向治療藥物。這一證據支持結論可以降低治療成本,並減少藥物注射次數。
有媒體評論稱,Kisunla獲批對禮來及其投資者來說是巨大的勝利,三年多前,這種藥物在臨床試驗中顯示了治療AD的前景,此後投資者一直熱切期待它上市,監管方這期間曾多次延遲批准。獲批還標誌着,市面上有了第二種可減緩600萬美國人腦部疾病發病的藥物。
Kisunla此次獲批不算意外。三週前的6月10日,FDA的專家委員會就以11票全票贊成認可該藥物的有效性,對於ARIA副作用等問題,同樣11票贊成認定該藥物對病患利大於弊,獲益大於風險。療效數據如下,治療76周iADRS延緩下降22%,CDR-SB評分延緩下降29%。
當時媒體指出,Kisunla獲批後,將直接同衛材(Eisai Co.)/渤健(Biogen)聯合開發的去年初在美國上市藥物Leqembi 競爭。Leqembi 也適用於早期AD患者,即存在輕度認知障礙或處於輕度癡呆狀態的AD患者。
本週二Kisunla獲批後禮來盤中收窄跌幅的同時,渤健午盤刷新日低,日內跌幅擴大到近2.9%。