4月7日深夜,北京市醫療保障局突然發佈“關於對《北京市醫療保障局等9部門北京市支持創新醫藥高質量發展若干措施(2024)(徵求意見稿)》公開徵求意見的公告”。此次徵求意見稿公開徵集時間僅3個工作日。臨床研究第一條明確提出將臨床試驗啓動整體用時壓縮至28周內。
與此同時,廣州、珠海兩地也發佈了促進鼓勵生物醫藥產業高質量發展相關政策。
從政策導向來看,形成了一個廣東給錢,北京給加速度的格局。分析人士認爲,這應該不是巧合。在美國生物安全法持續發酵之際,這一利好也能起到較好的對沖作用。
北京重磅利好
4月7日深夜,北京醫保局突然發佈創新藥重磅利好。公告稱,根據國務院批覆《支持北京深化國家服務業擴大開放綜合示範區建設工作方案》和我市《關於生物醫藥全產業鏈開放實施方案》等文件精神,爲加速醫藥健康產業創新,助力發展新質生產力,滿足人民群衆防病治病需求,北京市醫療保障局等9部門制定了《北京市支持創新醫藥高質量發展若干措施(2024)(徵求意見稿)》,現向社會公開徵求意見,歡迎社會各界提出意見建議。公開徵集意見時間爲:2024年4月7日至2024年4月9日,因時間緊急,公開徵集意見時間縮短爲3個工作日。
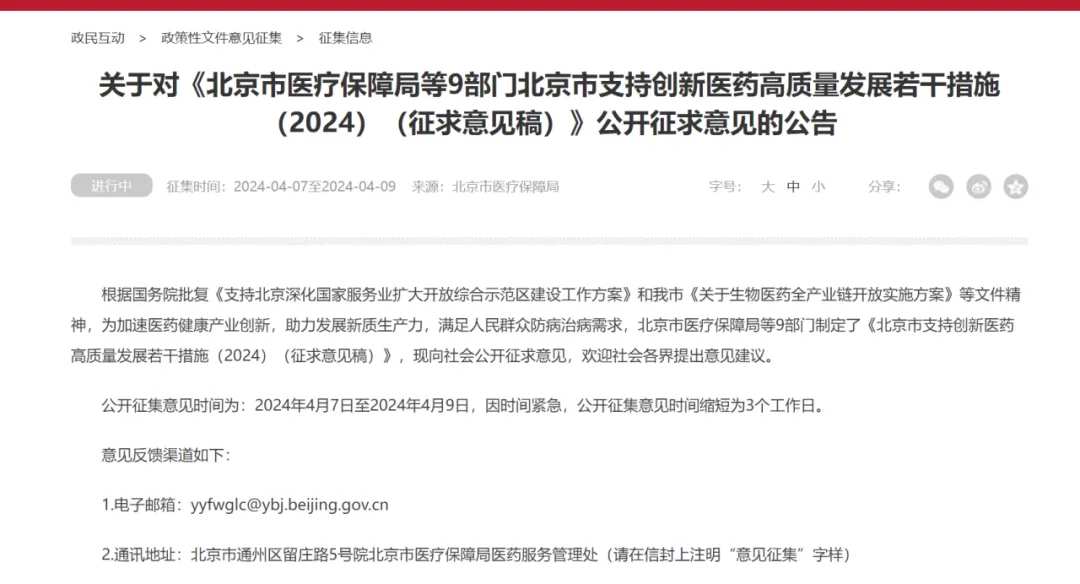
送審稿共八部分32條:包括:着力提升創新醫藥臨床研究質效(4條)、助力加速創新藥械審評審批(4條)、大力促進醫藥貿易便利化(3條)、加力促進創新醫藥臨床應用(8條)、努力拓展創新醫藥支付渠道(3條)、鼓勵醫療健康數據賦能創新(5條)、強化創新醫藥企業投融資支持(3條)和保障措施(2條)。
在產品研發、臨床試驗、審評審批、生產製造、流通貿易、臨床應用等環節,通過政策協同,支持創新醫藥發展;推動醫療健康數據賦能創新,豐富應用場景,依託人工智能、健康大模型等,支持醫療健康產業數字化、智能化升級;推動本市生物醫藥產業和保險金融業協同發展,完善創新藥械配備使用和多元支付體系,切實減輕人民群衆醫療費用負擔,不斷滿足人民群衆日益增長的健康需求。
值得注意的是,此次北京的政策明顯起到了“加速包”的作用。文件顯示,推動實施“藥品補充申請審評時限從200日壓縮至60日、藥品臨床試驗審批時限從60日壓縮至30日”的國家創新試點;將臨床試驗啓動整體用時壓縮至28周以內;建立對外交流平台,優化藥品出口流程,2024年推動5個品種“走出去”;爭取國家相關部門支持,前置評估、優化流程,建立臨床急需進口藥械審批綠色通道,2024年力爭推動10個臨床急需品種進口。
廣東兩地同頻共振
除了北京之外,廣州黃埔區和珠海也同時出臺了類似的政策。
廣州開發區管委會、廣州市黃埔區人民政府昨日印發廣州開發區(黃埔區)促進生物醫藥產業高質量發展辦法的通知。對創新藥、改良型新藥和生物類似藥,在國內臨床試驗研發費用投入1000萬元以上的,根據其臨床研發進度,分階段最高按實際投入臨床研發費用的40%給予資助:完成Ⅰ、Ⅱ、Ⅲ期臨床試驗的,經認定,分別給予最高1000萬元、2000萬元、3000萬元扶持,單個企業每年最高資助1億元。
鼓勵醫療機構提升新藥臨床試驗能力,對符合國家藥物臨床試驗質量管理規範(GCP)的臨床試驗機構,每新增1個GCP專業學科給予30萬元扶持,單個機構每年最高150萬元。對取得國家藥監局(NMPA)藥物臨床批件的藥物,每個批件最高資助50萬元。
對獲得藥品註冊證書的藥品(不同規格視爲同一個品種),每個品種給予最高1000萬元一次性資助。對已上市藥品通過仿製藥質量和療效一致性評價或被列爲參比製劑的(不同規格視爲同一個品種),每個品種給予100萬元資助。單個企業每年最高資助2000萬元。
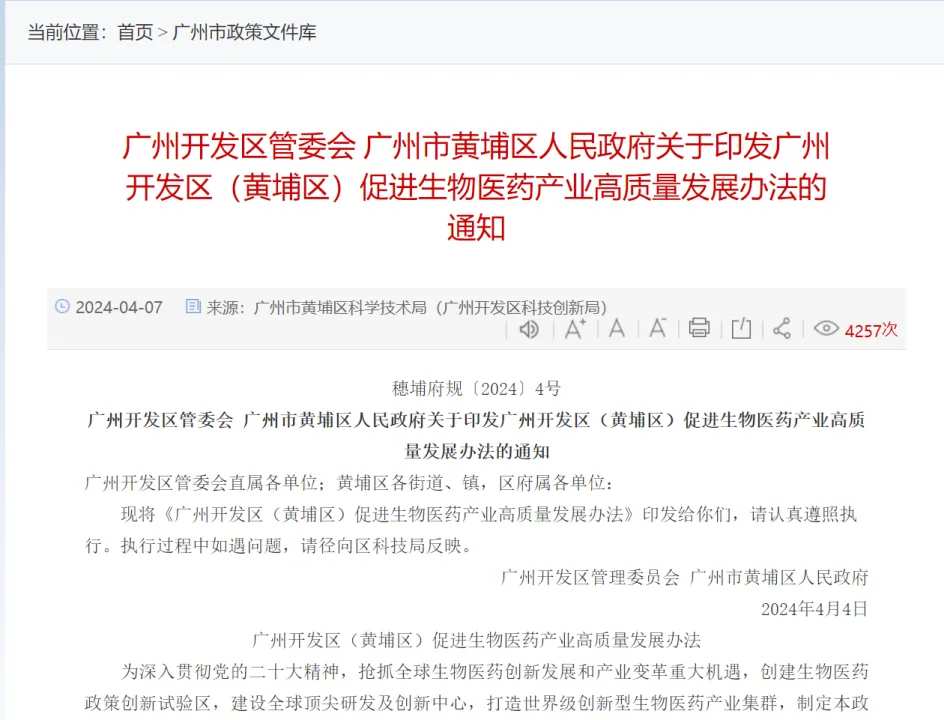
珠海市工業和信息化局亦發佈《珠海市促進生物醫藥與健康產業高質量發展若干措施(徵求意見稿)》。該意見稿同樣是強化了資金扶持。對化學藥品1-2類、生物製品(按藥品管理的診斷試劑除外)、中藥(中藥創新藥、中藥改良型新藥),根據研發各階段成果給予獎勵。
對完成I、II、III期臨床試驗階段(完成關鍵性臨床試驗可根據實際情況判定視爲完成I、II或III期臨床),分別給予最高300萬元、500萬元和1000萬元一次性獎勵。對獲得藥品註冊證書並實現銷售的,按藥品註冊分類標準給予最高1000萬元獎勵。
對創新型高端製劑(包括納米粒、微球、脂質體、控釋、緩釋劑型以及微針等創新劑型)單品種首個註冊證書再給予100萬元獎勵。對創新藥研發期間獲得突破性療法和附條件批准的,再給予100萬元獎勵。單個企業每年新藥研發相關獎勵最高不超過2000萬元。

由此,三地針對創新藥發佈的重大利好形成了一個“廣東給錢,北京加速”的格局。
影響多大?
那麼,利好究竟會有多大呢?
首先,北京給了不少政策,廣東給了不少錢,在這種示範之下,預計後續各地會陸續出臺類似的政策利好。畢竟,創新藥屬於新質生產力範疇,這對整個板塊來說是實實在在的利好;
其次,自1月美國《生物安全法案》被提出以來,國內創新藥板塊被打壓得很慘。4月4日,Endpoints發表的一篇報道再次激起市場波瀾。原文指出,美國生物安全法案(The Biosecure Act)所覆蓋的企業名單可能會覆蓋更多的中國CRO/CDMO企業。上述政策利好出臺,能較好地對沖掉美國《生物安全法案》的衝擊。
東吳證券認爲,北京率先落地創新藥全產業鏈支持政策,廣州同步出臺創新藥支持政策通知,支持態度與網傳文件基本一致,此前上海將生物醫藥納入4個萬億元級產業集群之一,國家層面支持文件落地可以期待,創新藥產業發展的政策束縛將全面解綁;北京起草說明文件提出推動生物醫藥產業和保險金融業協同發展,完善創新藥械配備使用和多元支付體系,未來中國創新藥商業化環境將煥然新生。
編輯/tolk