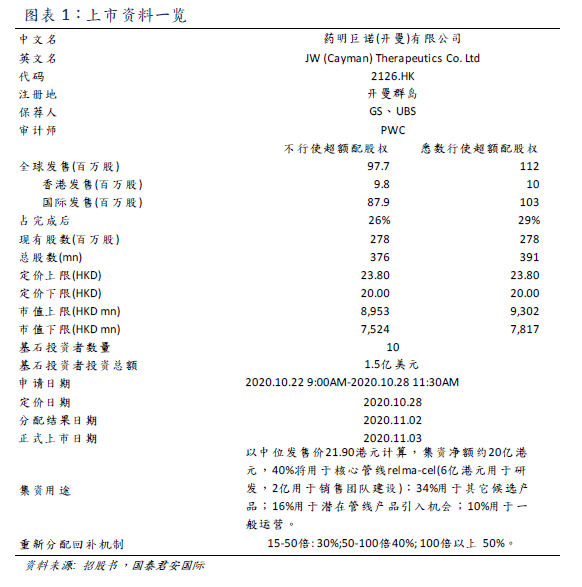
藥明巨諾-B(02126)是中國領先的細胞治療公司,目前處於臨牀階段。2016年由Juno和藥明康德合資成立,已經建立了一個專注血液癌症及實體瘤開發、製造和商業化突破性細胞免疫療法的一體化平臺。核心管線CD19靶點CAR-T療法relma-cel針對3L
DLBCL的新藥申請已經受NMPA受理,並獲得針對FL的突破性療法認定。
CAR-T療法市場前景廣闊細胞免疫療法是癌症治療的突破領域,能夠持久緩解其他治療手段難以治療的血液腫瘤(B細胞淋巴瘤和白血病)。F&S預計中國CAR-T市場規模將迅速增長,從2021年的人民幣6億元增加至2024年/2030年的54億/243億元。預計2019年Relma-cel的目標適應症(3L
DLBCL/FL/MCL)的目標患者人數分別為28,700/5,200/3,400人。以relma-cel提交NDA的三線瀰漫性大淋巴細胞癌(3L
DLBCL)測算,2021-2022年目標銷售患者在1,000-2,000人。
Relma-cel極有潛力成為國內FIC/BIC的CAR-T療法藥明巨諾通過License-in方式取得了Juno較好的CAR,採用了更新一代的CAR-T結構,ITMA(CD3聚合體)未直接與T細胞共激域鏈接,避免了T細胞超活化,使得relma-cel有望擁有更高的安全性。Relma-cel
在療效與國際現有已經上市的兩款CAR-T療法相若的情況下,安全性數據明顯好於這兩者。目前國內尚未有CAR-T產品上市,競品方面復星凱特的產品亦同樣提交NDA獲受理,諾華的產品處於三期,但復星凱特為License-in凱特的CAR-T
Yescarta產品,預計安全性均劣於relma-cel。這使得relma-cel大概率成為國內FIC且是同類最佳的CAR-T療法。國泰君安證券預計relma-cel有望2021年獲批上市,佔取CAR-T市場頭部份額。
銷售享有先發優勢
公司在臨牀試驗階段,已經積累了部分領先醫院的醫生資源。有助於未來的商業推廣。此外,公司計劃初步打造60-70人的銷售團隊,覆蓋50家頂尖醫院。未來三年預計將擴充銷售團隊至100-120人,覆蓋100家腫瘤醫院。
產能充足,高生產成功率奠定成本優勢
 公司目前每年可以支撐5,000名患者的治療藥物生產,將足以滿足公司近幾年的發展需求。同時,relma-cel的製造成功率更高。整個DLBCL註冊臨牀試驗期間生產relma-cel的成功率為100%,高於Yescarta、Kymriah及Tecartus在註冊臨牀試驗期間的總體制造成功率分別為99%、91%至93%及96%。CAR-T療法作為定製性很高的個性化治療方案,由於無法大規模生產攤薄成本,生產成功率將直接影響生產成本。Relma-cel更高的成功率將帶來成本領先優勢,助力贏得未來的CAR-T市場競爭。
公司目前每年可以支撐5,000名患者的治療藥物生產,將足以滿足公司近幾年的發展需求。同時,relma-cel的製造成功率更高。整個DLBCL註冊臨牀試驗期間生產relma-cel的成功率為100%,高於Yescarta、Kymriah及Tecartus在註冊臨牀試驗期間的總體制造成功率分別為99%、91%至93%及96%。CAR-T療法作為定製性很高的個性化治療方案,由於無法大規模生產攤薄成本,生產成功率將直接影響生產成本。Relma-cel更高的成功率將帶來成本領先優勢,助力贏得未來的CAR-T市場競爭。
催化劑:1).
新引入項目 2). Relma-cel 2L DLBCL進展 3). CAR-T實體瘤應用。風險:1). 臨牀進展慢於預期 2).
市場拓展速度慢於預期。
公司簡介
藥明巨諾是中國領先的細胞治療公司,目前處於臨牀階段。2016年由Juno和藥明康德合資成立,已經建立了一個專注血液癌症及實體瘤開發、製造和商業化突破性細胞免疫療法的一體化平臺。核心管線CD19靶點CAR-T療法relma-cel針對3L
DLBCL的新藥申請已經受NMPA受理,並獲得針對FL的突破性療法認定。
快速增長的CAR-T治療市場
腫瘤免疫治療的主要類別包括細胞免疫治療、檢查點抑制劑、治療性癌症疫苗及細胞因子。由於腫瘤免疫治療能夠提供持久的緩解,且部分晚期癌症患者對此通常具有良好的耐受性,該治療的發現及發展已成為全球癌症療法的重要里程碑。
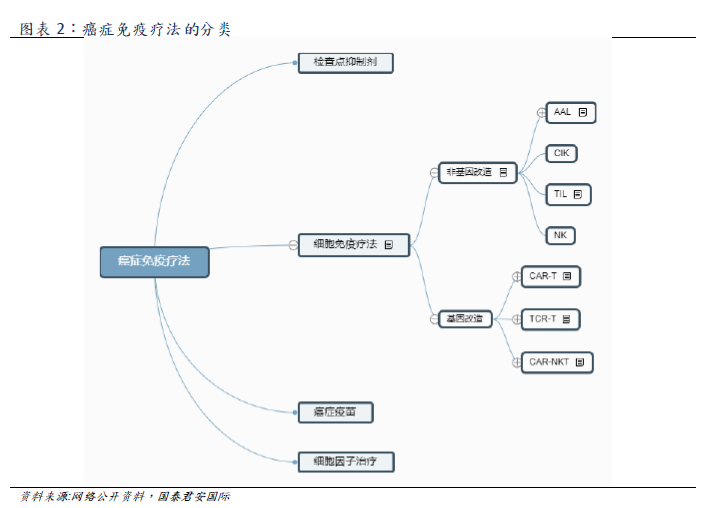
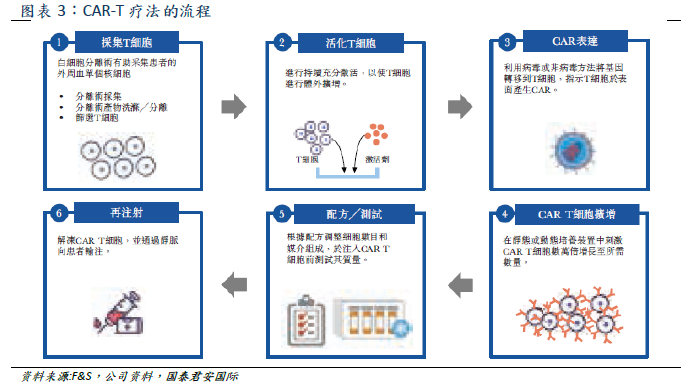
細胞免疫療法是腫瘤免疫療法中的一種,細胞療法可以分為7類(如上圖所示)。其中主要的幾種類別包括基因改造型的CAR-T、TCR-T和非基因改造型的NK、TIL。CAR-T通過外周血獲取患者T細胞,經過基因改造使T細胞擁有靶向腫瘤相關抗原(TAA)並殺死癌細胞的能力(T細胞表面插入嵌和抗原受體CAR可與腫瘤細胞表面抗原結合,從而激活T細胞消除腫瘤),再通過體外擴增,靜脈輸回患者。CAR-T療法具有特異性、適應性、長效持久性等優勢,且對復發難治患者有效、療程較短、適用於高齡人羣。
目前全球市場僅有兩款CAR-T產品獲批,為凱特和吉利德聯合開發的Yescarta和諾華的Kymriah。F&S數據2019年CAR-T市場規模約734百萬美元,
預計2024/2030 年將達47 億/181 億美元,
2019-2024/2024-2030的複合年增長率為45.3%/25.0%。中國市場目前尚無已經批准的CAR-T產品,預計隨着新產品推出,中國市場規模將在2021年達到人民幣6億,2024/2030年達到人民幣54億/243億元,2024-2030複合年增長率為28.7%。
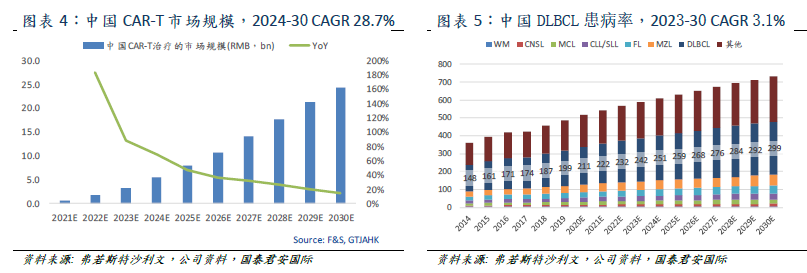
臨牀研究顯示CAR-T療法能夠持久緩解其他治療手段難以治療的B細胞淋巴瘤及白血病。淋巴瘤是涉及免疫系統淋巴囊腫的血液腫瘤癌症,90%為非霍奇金淋巴瘤(NHL)。最常見的NHL亞型是DLBCL、FL、MZL、CLL/SLL以及MCL,僅DLBCL約佔NHL發病率的40%。F&S預計中國DLBCL患者2023年/2030年將達24.2萬人/29.9萬人,2023-2030年複合年均增速3.1%。考慮到中國前線治療的有效性,3LDLBCL/FL/MCL在中國的目標患者人數為28,700/5,200/3,400人。
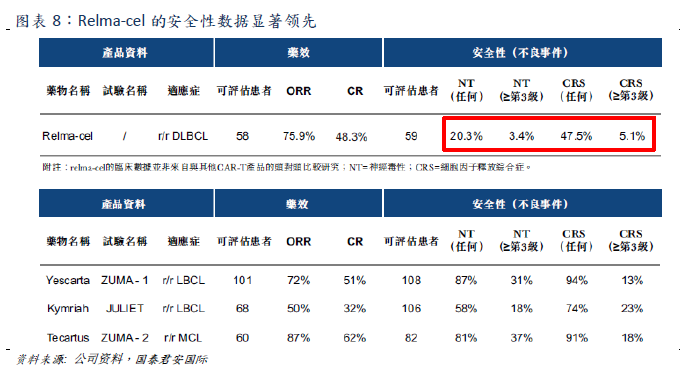
Relma-cel安全性優勢顯著,極有潛力成為同類最佳的CAR-T療法
CD19和BCMA是CAR-T領域兩大熱門靶點。目前全球獲批的兩款CAR-T產品均為CD19靶點。目前中國有11款處於臨牀階段的CD19靶點CAR-T產品,其中藥明巨諾和復星凱特(從凱特引進的Yescarta)的產品已經遞交新藥申請。諾華的也處於三期臨牀。BCMA靶點方面,全球尚無產品獲批,國內共4款產品處於臨牀階段,傳奇生物進展最快,處於臨牀II期。CAR-T療法的主要副作用包括細胞因子釋放綜合症CRs,B細胞發育不良和神經毒性。其中CRs是常見的CAR-T副作用,主要由巨噬細胞釋放包含IL-1和IL-6的大量細胞因子,引發炎症,導致發熱、低血壓、呼吸障礙、癲癇、昏迷甚至死亡。這導致已經上市的兩款CAR-T產品遭到FDA黑框警告。一部分患者需要在重症監護室進行CRs治療,這導致採用CAR-T療法的隱性成本增加。研究表明針對IL-1和IL-6靶點可以治療CRs,也已經被FDA納入CAR-T治療指引。國泰君安證券認為降低不良事件發生率是目前贏得市場的關鍵因素。

CAR-T的主要結構CAR設計分為三個部分,一是識別TAA的單鏈可變區scFv,二是跨膜結構TM,三是細胞內結構域。從CAR結構的改變可以分為五代。第一代CAR直接將抗原結合域直接與TCR恆定鏈CD3ζ融合,通過CD3ζ來啟動激活級聯反應。第二代CAR將T細胞共激域CD28或4-1BB融合到CAR的細胞內片段,改善T細胞的激活、增殖、存活。第三代CAR在第二代的基礎上再加入一個T細胞共激域4-1BB,改善CAR-T細胞的長期持久性,促進CD8+
T細胞記憶。第四代CAR在第二代的基礎上引入了一個共表達的細胞因子,比如IL-12等,能夠觸發原本由細胞因子誘導的信號,進一步加強T細胞應答。第五代CAR同樣基於第二代,添加了激活其它信號通路的共刺激結構域,如IL-2Rβ可以胞內結合SAAT3/5的結構域。
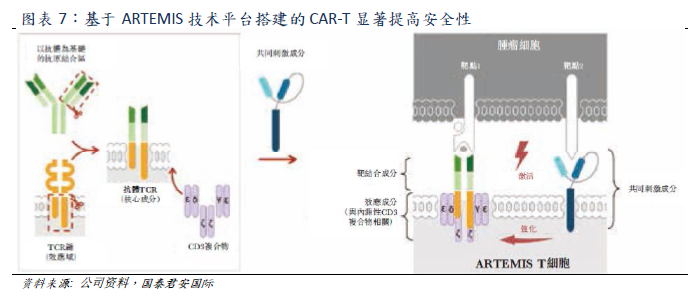
Yescarta和Kymriah均屬於第二代CAR結構,分別採用CD28和4-1BB共激域。而藥明巨諾的核心候選產品relma-cel基於ARTEMIS技術平臺搭建的CAR結構與前兩者完全不同。relma-cel將共同刺激成分與抗體TCR和CD3複合物形成的多聚體複合物分開,可以使用為免疫細胞信號自然形成的內部細胞反應及調節機制,通過共同刺激成分的激活強化T細胞應答。公司認為已上市產品的安全性風險主要由於直接將CD3信號域融合或耦合至T細胞共刺激域的表達CAR構建體的T細胞超活化。而relma-cel的結構可以顯著的提高CAR-T療法的安全性。臨牀試驗數據顯示Relma-cel
在療效相當(ORR=75.9%,CR=48.3%)的情況下,嚴重不良事件發生率顯著小於已經上市的CAR-T產品。
國泰君安證券預計relma-cel有望2021年獲批上市。參考美國CAR-T產品售價和國內的經濟發展水平、國內產業化和市場空間等因素,以及業內意見,預計CAR-T療法價格將在RMB50萬元/劑/年左右,將遠低於國外人民幣200-300萬元水平。
國泰君安證券預計CAR-T療法的診斷治療率在目標患者人羣中的佔比在10%左右。以relma-cel提交NDA的三線瀰漫性大淋巴細胞癌(3L
DLBCL)測算,2021-2022年目標患者在1,000-2,000人。而relma-cel將憑藉其優異的安全性數據,以及良好的醫院關係,取得較高的CAR-T市場份額。
研發聚焦流程
改進研發是藥明巨諾整體平臺的核心部分,公司擁有從發現到臨牀開發有關產品及流程的全面能力。63名研發人員,其中9名為臨牀開發。公司大部分研發活動集中於改進流程、使用改良流程開發下一代候選產品。過去藥明巨諾主要通過與Juno、優瑞科及Acepodia等合作方的關係獲得開發能力,並無進行內部產品開發。中長期計劃建立內部產品開發能力,包括通過利用於2020年6月獲得優瑞科授權引進的ARTEMIS平臺。
銷售
CAR-T需要大力宣傳,公司計劃建立專門的內部銷售與營銷團隊將relma-cel推廣至中國各地,目前的營銷計劃專注於r/r
DLBCL,未來會隨着臨牀試驗進展而逐步拓展。初步目標是於relma-cel初步商業化時建立一個約60至70人的銷售團隊,服務覆蓋中國約50間設有最佳血液和移植中心的頂級醫院。由於這些醫院多數是relma-cel的臨牀試驗中心,因而已經有不少醫生熟悉其應用。未來三年預計將擴充銷售團隊至100-120人,覆蓋100家腫瘤醫院。目前,中國大部分被選為CAR-T療法臨牀試驗地點的醫院為三級甲等醫院。由於三級甲等醫院擁有優秀醫學研發能力、具備資質的人員及充足實驗室和設備,因此較有可能獲得提供CAR-T療法的資格。中國擁有大量三級甲等醫院(約1,442間),預期隨着更多醫院取得提供CAR-T療法的資格,中國CAR-T市場將會進一步增長。
生產
公司目前每年可以支撐5,000名患者的治療藥物生產,將足以滿足公司近幾年的發展需求。同時,relma-cel的製造成功率更高。整個DLBCL註冊臨牀試驗期間生產relma-cel的成功率為100%,高於Yescarta、Kymriah及Tecartus在註冊臨牀試驗期間的總體制造成功率分別為99%、91%至93%及96%。
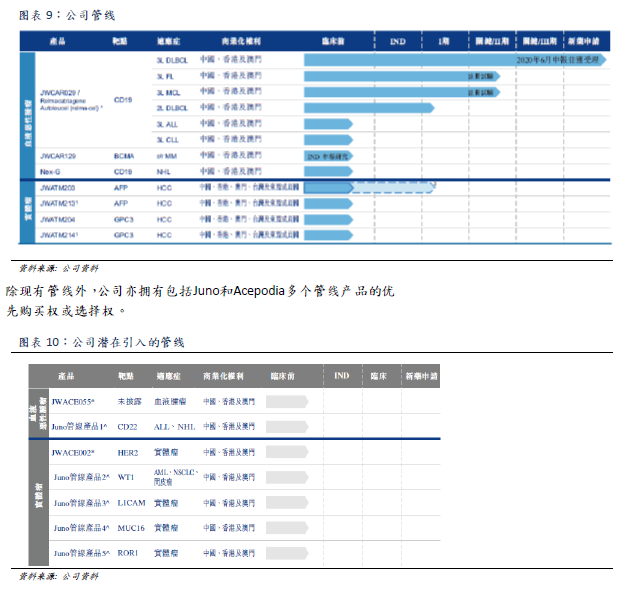
公司管線
由於relma-cel通過針對CD19抗原治療三線DLBCL,療效顯著,且具安全性優勢,公司相信relma-cel可以治療同樣出現CD19抗原的其他血液癌症,讓更多患者受惠。公司目前計劃進行進一步的臨牀研究,目標是向國家藥監局提交其他新藥申請,以獲取將relma-cel用作其他血液癌症(包括FL、MCL、CLL及ALL)治療藥物的批文。此外公司在BCMA
靶點的CAR-T療法以及下一代CAR-T療法也處於臨牀前研究中。另外4項TCR-T治療肝細胞癌的產品管線也在開發中。
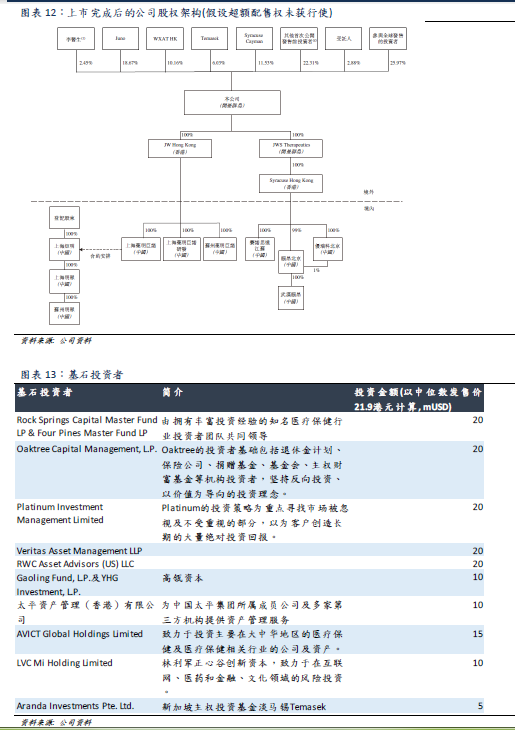
核心團隊、架構
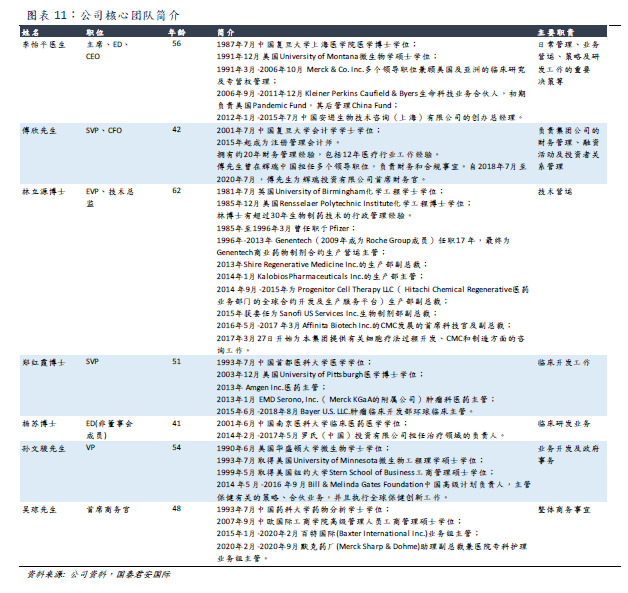
公司管理團隊擁有多年在國際知名領軍藥企的管理經驗,具備廣闊的國際視野,且在技術運營、臨牀開發、臨牀研發、商務運營等方面擁有專業知識。

 公司目前每年可以支撑5,000名患者的治疗药物生产,将足以满足公司近几年的发展需求。同时,relma-cel的制造成功率更高。整个DLBCL注册临床试验期间生产relma-cel的成功率为100%,高于Yescarta、Kymriah及Tecartus在注册临床试验期间的总体制造成功率分别为99%、91%至93%及96%。CAR-T疗法作为定制性很高的个性化治疗方案,由于无法大规模生产摊薄成本,生产成功率将直接影响生产成本。Relma-cel更高的成功率将带来成本领先优势,助力赢得未来的CAR-T市场竞争。
公司目前每年可以支撑5,000名患者的治疗药物生产,将足以满足公司近几年的发展需求。同时,relma-cel的制造成功率更高。整个DLBCL注册临床试验期间生产relma-cel的成功率为100%,高于Yescarta、Kymriah及Tecartus在注册临床试验期间的总体制造成功率分别为99%、91%至93%及96%。CAR-T疗法作为定制性很高的个性化治疗方案,由于无法大规模生产摊薄成本,生产成功率将直接影响生产成本。Relma-cel更高的成功率将带来成本领先优势,助力赢得未来的CAR-T市场竞争。